低盐驯化对西杂鲟幼鱼生长发育的影响
2023-03-29陈会琴孔令富毕保良
陈会琴,胡 青,2,孔令富,2,严 晖,2,赵 耀,毕保良,2
(1.云南农业大学动物科学技术学院,高原渔业学院,昆明650201;2.云南农业大学高原渔业资源保护与可持续利用重点实验室,昆明650201)
鲟作为鱼类中最原始的群体,是迄今为止发现起源最早的脊椎动物之一。目前世界上大约有鲟2科6属27种,其中大部分野生种类濒临灭绝,属世界性保护物种[1]。多年来,鲟被大量捕捞以获取鱼子,鲟鱼子在国际市场上享有“黑珍珠”之称,是国际上经久不衰的名贵高档食品[2]。但因过度捕捞、种质退化和栖息地的丧失,导致许多鲟产业的衰退。因此,通过对人工鲟养殖条件的研究,能减少人类对野生资源的开发和利用,进而推动我国鲟产业的可持续发展。
西杂鲟(Acipenserbaerii♀×A.schrenckii♂)作为广盐性鱼类,环境盐度变化会引起多种生理应激反应。有研究表明盐度变化会对水产动物的血清生化指标[3]及血清激素水平[4-5]等造成重要影响,而水产动物可以通过改变血清离子浓度[6-7]以及鳃、肾和肠的Na+-K+-ATP酶活性[8]来适应环境盐度的改变,进而调节体内渗透压的平衡。此外,鱼类的内分泌活动,包括皮质醇、甲状腺激素(triiodothyronine,T3)、胰岛素样生长因子1(insulinlike growth factor,igf-Ⅰ)和性腺发育相关基因等[9]都在渗透调节过程中起着重要作用。盐度应激对免疫反应也有双向影响,它可能抑制或增强某些免疫参数,具体取决于暴露的剂量和持续时间[10]。应激不仅影响先天免疫反应,而且影响炎症、获得性免疫相关基因的表达。例如,谷胱甘肽巯基转移酶(GST)在多种内源性和外源性化合物的细胞解毒过程中起着非常重要的作用,hsp70和hsp27则介导应激过程中变性蛋白的修复[11]。因此,盐度是影响广盐性鱼类生长发育的重要因子。然而,目前研究盐度变化对鱼类的生长发育、离子调节、应激和免疫相关基因等众多参数的联合分析仍然缺乏。因此,本研究旨在通过测定血清生化指标、激素水平、生长发育和免疫相关基因的表达水平,研究低盐驯化对西杂鲟幼鱼的影响,以期在低盐环境下获得生长快、疾病少、适应能力强、经济价值高的西杂鲟,同时丰富西杂鲟的相关研究数据,为西杂鲟生产养殖过程中的低盐驯化养殖模式的推广提供基础数据和理论借鉴。
1 材料与方法
1.1 实验材料
西杂鲟幼鱼购自云南省会泽县滇泽水产养殖有限公司,在云南农业大学水产实验室暂养7 d,水温10~12 ℃,每天定时投喂,日投饵量为鱼体质量的2%~3%,日换水率为50%。选择90条体质量为(8.1±0.1) g、健康活泼的个体用于低盐驯化实验。
1.2 实验设计
实验设置3个盐度组(0‰、4‰、8‰),分别记为S0、S4、S8,每个盐度组设置3个平行,每个平行10条鱼。S0为对照组,S4处理组,每1d增加1个盐度,S8处理组每1d增加2个盐度,逐渐升高水体盐度,在同一时间内升到最终设定盐度,并驯养15 d。每日10:00和19:00饲喂商品日粮(粗蛋白质42%,粗脂肪12%,粗纤维6.0%,由昆明恒大饲料有限公司提供)2次,每天喂食前换1/3~2/3水,并补充相应盐度的水。S4和S8处理组用水由实验用水与海水晶配置而成,并用盐度计(LYT-610,上海淋誉贸易有限公司)进行校正和检测水体盐度。水质参数:pH值(7~8.5),氨氮<0.5 mg/L,亚硝酸盐<0.1 mg/L,溶解氧>6 mg/L。实验期间,观察和记录实验鱼的日常行为,并用盐度计监测水体,使盐度始终维持在设定的范围内。
1.3 样本采集
采样前禁食24 h,MS222(100 mg/L)麻醉后称重(g)、测量体长(cm)和全长(cm)。用一次性无菌注射器从尾动脉取血,置于1.5 mL离心管中,静置一段时间后,离心(1 500 r/min,30 min)取上清,于-80 ℃保存,用于血清生化指标、抗氧化指标及激素的测定。打开腹腔及鳃盖,采集鳃、肾、肠组织,于-80 ℃保存,用于Na+-K+-ATP酶活性的测定。另外,采集肝脏和脑组织,放入2.0 mL RNase-free离心管中,于-80 ℃保存,用于基因表达量的测定。
1.4 血清生化指标测定
甘油三酯(TG)、总胆固醇(TC)、血糖(GLU)、过氧化氢酶(CAT)、还原型谷胱甘肽(GSH)、总抗氧化能力(T-AOC)和丙二醛(MDA)的测定根据北京盒子生工科技有限公司试剂盒说明书进行。总蛋白(TP)的测定根据北京酷来博科技有限公司试剂盒说明书进行。血清Na+、Cl-的测定根据南京建成生物工程研究所有限公司试剂盒说明书进行。甲状腺激素分别为三碘甲腺原氨酸(T3)、游离三碘甲腺原氨酸(FT3)的测定根据北京北方生物技术研究所有限公司试剂盒说明书进行。皮质醇的测定根据上海酶联生物科技有限公司试剂盒说明书进行。
1.5 Na+-K+-ATP酶活性的测定
称取西杂鲟幼鱼鳃、肾、肠组织各0.1 g,生理盐水润洗后,测定步骤根据北京盒子生工科技有限公司试剂盒说明书进行。
1.6 基因表达量的测定
按照Total RNA Isolation Reagent Kit(biosharp)说明书提取肝脏和脑组织总RNA。用超微量分光光度计(NanoPhotometer NP 80 Touch,德国)检测总RNA浓度和纯度,D260 nm/D280 nm处于1.8~2.0之间。采用GoldenstarTMRT6 cDNA Synthesis Kit反转录试剂盒(擎科生物科技有限公司)将1 μg总RNA反转录为cDNA,-20 ℃保存,用于基因表达量的测定。
实时荧光定量在CFX ConnectTM Optics Module(Bio-Rad,美国)下进行,以18S RNA为内参,引物序列见表1。qPCR反应体系为20 μL:2×T5 Fast qPCR mix(SYBP Green I)(擎科生物科技有限公司)10 μL,正、反引物各1 μL,cDNA模板2 μL,无菌水6 μL。每个处理设置3个重复,每个基因均设阴性对照(不含cDNA)。反应条件为:95 ℃预变性3 min;然后95 ℃变性20 s,退火20 s(退火温度见表1),72 ℃延伸20 s,循环40次,最后72 ℃延伸10 min。用2-△△Ct计算每个基因的相对表达量[12]。
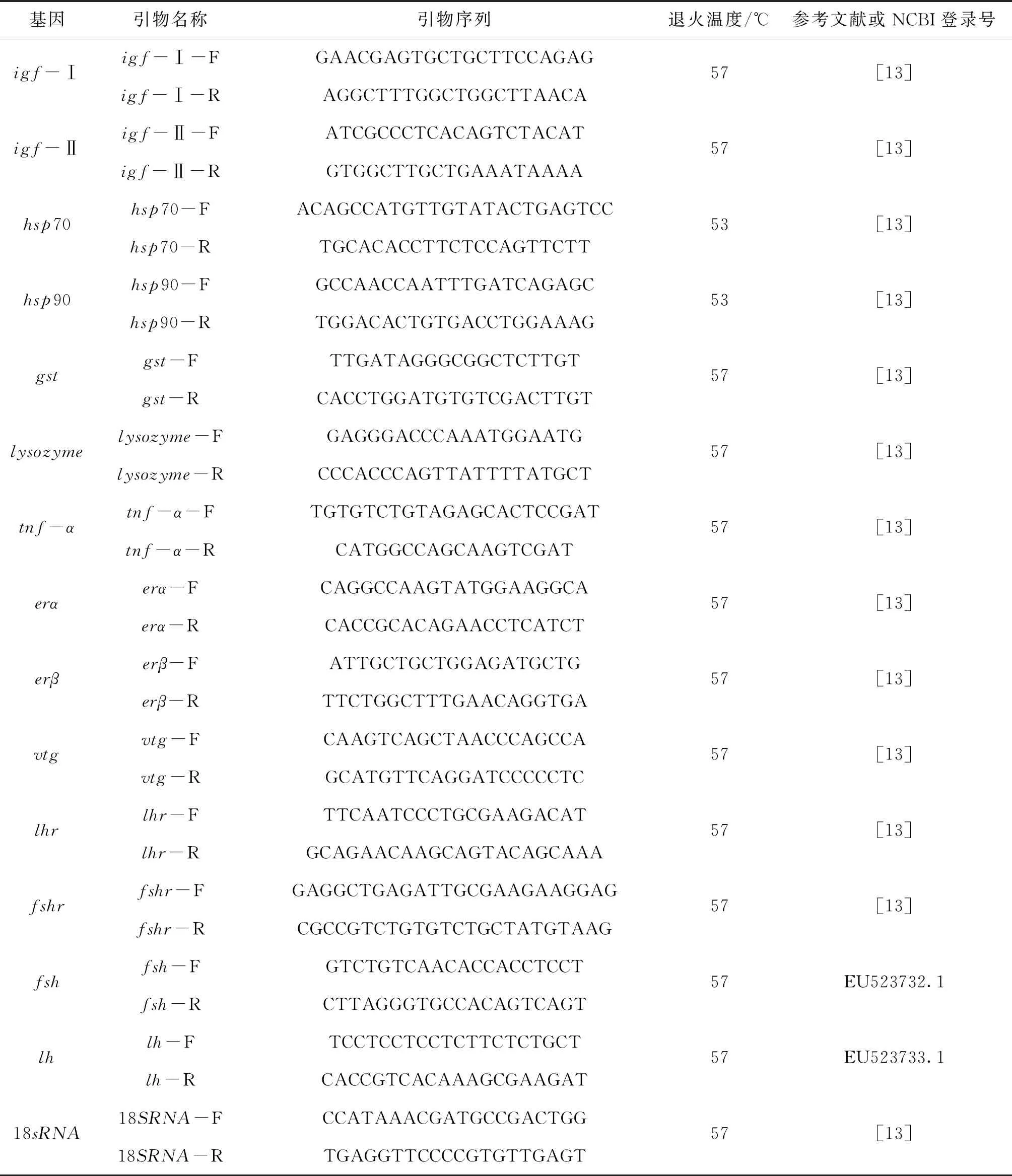
表1 本试验所用引物
1.7 数据处理
数据采用SPSS16.0进行分析,并采用单因素方差分析(One-way ANOVA)Tukey法检验,P<0.05为差异显著,P>0.05为差异不显著。数值均采用平均值±标准偏差(mean±SD)表示。根据结果使用Prism软件绘图。
2 结果分析
2.1 低盐驯化对西杂鲟幼鱼生长的影响
低盐驯化对西杂鲟幼鱼生长的影响如图1所示,鲟幼鱼在3个不同盐度水体中驯养15 d后其体质量(g),体长(cm)和全长(cm),组间均无显著差异。

图1 低盐驯化对西杂鲟幼鱼体长、全长、体质量的影响
2.2 低盐驯化对西杂鲟幼鱼血清生化指标及抗氧化指标的影响
低盐驯化对西杂鲟幼鱼血清生化指标及抗氧化指标的影响如表2所示,3个盐度组西杂鲟幼鱼其血糖、总蛋白、总胆固醇、甘油三酯、过氧化氢酶、还原型谷胱甘肽、总抗氧化能力和丙二醛,均无显著差异。

表2 低盐驯化对西杂鲟幼鱼血清生化指标及抗氧化指标的影响
2.3 低盐驯化对西杂鲟幼鱼血清激素水平的影响
2.3.1 低盐驯化对西杂鲟幼鱼血清T3、FT3含量的影响
低盐驯化对西杂鲟幼鱼血清T3、FT3含量的影响如图2所示,随着盐度的升高,西杂鲟血清T3、FT3含量呈现先升高后降低的变化趋势,但不同处理组与对照组之间均无显著性差异。

图2 低盐驯化对西杂鲟幼鱼血清T3、FT3含量的影响
2.3.2 低盐驯化对西杂鲟幼鱼血清皮质醇含量的影响
低盐驯化对西杂鲟幼鱼血清皮质醇含量的影响如图3所示,随着盐度的升高,西杂鲟血清皮质醇含量呈现先升高后降低的变化趋势,但不同处理组与对照组之间血清皮质醇含量无显著性差异。

图3 低盐驯化对西杂鲟幼鱼血浆皮质醇含量的影响
2.4 低盐驯化对西杂鲟幼鱼Na+-K+-ATP酶活性的影响
低盐驯化对西杂鲟幼鱼鳃Na+-K+-ATP酶活性的影响见图4a,随着盐度的升高,西杂鲟幼鱼鳃Na+-K+-ATP酶活性呈现波动式的上升,S8处理组鳃Na+-K+-ATP酶活性达到最高,显著高于S4处理组,但不同盐度处理组与对照组相比无显著差异。低盐驯化对西杂鲟幼鱼肾Na+-K+-ATP酶活性的影响见图4b,随盐度的升高,西杂鲟幼鱼肾Na+-K+-ATP酶活性在不同盐度处理组与对照组之间无显著差异。低盐驯化对西杂鲟幼鱼肠Na+-K+-ATP酶活性的影响见图4c,随盐度的升高,西杂鲟幼鱼肠Na+-K+-ATP酶活性逐渐上升,但不同处理组与对照组之间无显著差异。

图4 低盐驯化对西杂鲟幼鱼鳃、肾、肠Na+-K+-ATP酶活性的影响
2.5 低盐驯化对西杂鲟幼鱼血清Na+、Cl-含量的影响
低盐驯化对西杂鲟幼鱼血清Na+、Cl-含量的影响如图5所示,随着盐度的升高,血清Na+含量变化差异不显著;西杂鲟幼鱼血清Cl-含量先下降后升高,S4处理组血清Cl-含量显著低于对照组,当盐度升高到8时,血清Cl-含量恢复至对照组水平。
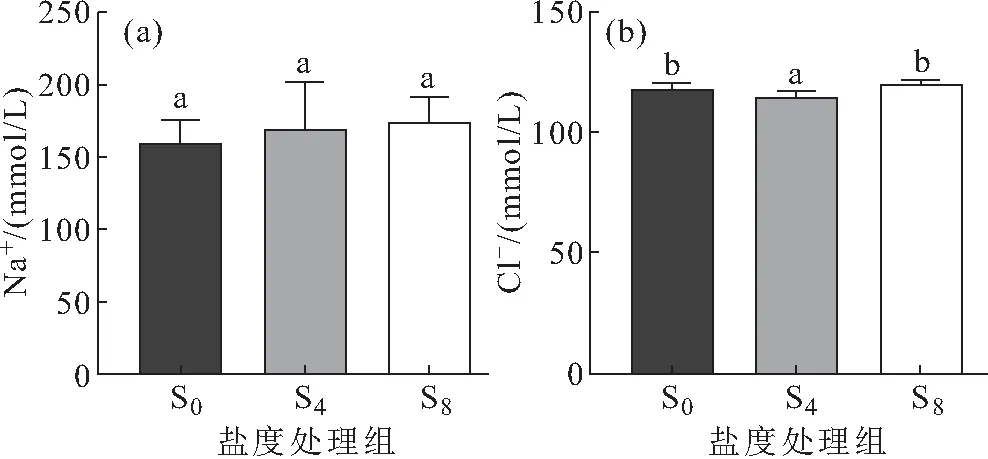
图5 低盐驯化对西杂鲟幼鱼血清Na+、Cl-含量的影响
2.5 低盐驯化对西杂鲟幼鱼生长、免疫及性腺发育相关基因表达水平的影响
2.5.1 低盐驯化对西杂鲟幼鱼生长相关基因的表达水平的影响
随着盐度升高,西杂鲟幼鱼igf-Ⅰ基因的表达水平呈先上升后下降的趋势,igf-Ⅱ基因的表达水平呈先下降后上升趋势,但均无显著差异(图6)。

图6 低盐驯化对西杂鲟幼鱼肝脏中igf-Ⅰ、igf-Ⅱ基因相对表达量的影响
2.5.2 低盐驯化对西杂鲟幼鱼免疫相关基因表达水平的影响
随着盐度升高,西杂鲟幼鱼hsp70、hsp90基因的表达水平呈先下降后升高的趋势(图7a和b);tnf-α基因的表达水平先升高后下降(图7c);gst、lysozyme基因的表达水平有缓慢上升的趋势(图7d和e),但低盐驯化对西杂鲟幼鱼免疫相关基因的表达水平均无显著影响。

图7 低盐驯化对西杂鲟幼鱼肝脏中hsp70、hsp90、tnf-α、gst和lysozyme基因相对表达量的影响
2.5.3 低盐驯化对西杂鲟幼鱼性腺发育相关基因表达水平的影响
随着盐度升高,fsh、lh基因的表达水平逐渐下降(图8a和b),lh基因的表达水平在S8处理组显著低于对照组,但fsh基因的表达水平在不同处理组与对照组之间无显著差异。fshr、erα基因的表达水平先下降后上升,而lhr、erβ基因的表达水平呈下降趋势,但不同处理组与对照组之间均无显著差异(图8c-f)。vtg基因的表达水平呈先升高后下降的趋势,但不同处理组与对照组之间均无显著差异(图8g)。

图8 低盐驯化对西杂鲟幼鱼肝脏和脑中性腺发育相关基因表达量的影响
3 讨论
3.1 低盐驯化对西杂鲟幼鱼Na+-K+-ATP酶活性和血清Na+、Cl-含量的影响
鲟具有特殊的渗透和离子调节机制以适应不同的盐度环境。但鲟幼鱼对盐度变化的反应与成鱼不同,这一点已在许多关于鲟渗透调节能力的试验中得到证实[14]。鳃和肾作为渗透调节的重要器官,盐度变化会导致鱼体渗透压发生改变,从而产生一系列的生理反应,如血清激素水平、能量代谢和抗氧化酶发生异常等。因此,鳃和肾中的Na+-K+-ATP酶被激活以维持渗透压的平衡。有研究表明,在盐度为10、20、25的条件下驯养史氏鲟,鳃Na+-K+-ATP酶活显著高于对照组,且随着胁迫时间的延长受到抑制而呈现下降趋势,随后被重新激活逐渐上升,在适应盐度胁迫后,鳃Na+-K+-ATP酶活性趋于平稳[15]。王晓雯等[16]研究表明,杂交鲟幼鱼在盐度5的条件下胁迫后,鳃Na+-K+-ATP酶活会极显著高于对照组,而后下降至对照组水平。银鲳幼鱼(Pampusargenteus)在低盐胁迫下,随着盐度的下降,鳃和肾中Na+-K+-ATP酶活呈现先升后降的趋势[17]。而本研究发现,低盐驯化西杂鲟幼鱼后,鳃Na+-K+-ATP酶活随盐度的升高呈现出“U”型变化,但无显著差异。另外,肠、肾和膀胱等器官对保持内环境稳态都起到重要作用。但本研究发现,西杂鲟幼鱼在盐度的适应过程中,肾和肠Na+-K+-ATP酶活并没有显著变化,表明在低盐环境下驯化西杂鲟幼鱼15 d后,鳃Na+-K+-ATP酶参与血清渗透压的调节以适应新的环境,而肠和肾参与血清渗透压调节的作用不明显。
鱼类也可通过调节离子吸收和排泄能力维持渗透压平衡,以适应不同的盐度环境。有研究发现,中华鲟(Acipensersinensis)在不同盐度下驯化24h后,血清渗透压和离子浓度(Na+、Cl-)均有不同程度的升高。此后,渗透压和离子浓度开始下降,并趋于一个新的稳态[18],说明血清中Na+和Cl-是血清渗透压调节过程的主要参与者,但在本研究中,低盐驯化15 d后,西杂鲟幼鱼血清Na+浓度并未出现显著性变化,Cl-浓度同鳃Na+-K+-ATP酶活呈现出一致的变化趋势,先降低后升高,表明西杂鲟幼鱼血清Cl-的浓度受鳃Na+-K+-ATP酶活的调控。
3.2 低盐驯化对西杂鲟幼鱼血清生化指标及抗氧化酶的影响
鱼体内血糖处于动态平衡,但极易受环境因素的影响。前期研究表明,栖息于急流中的鱼类相比静水或底栖性的鱼类血糖值偏高[19],表明运动量增加会引起血糖的升高。虽然渗透机制调节中的高能量需求会使组织糖元异生作用增强,从而引起血糖浓度的变化,但本研究发现,低盐驯化15 d后,西杂鲟幼鱼血糖含量未受盐度影响,表明其逐渐适应低盐环境,未使糖代谢产生较大差异。
总胆固醇和甘油三酯是鱼体内代谢的重要物质,也是反应机体摄取和合成蛋白的重要指标。本研究发现,西杂鲟幼鱼血清总胆固醇的浓度与盐度呈正相关趋势,甘油三酯浓度随盐度的上升呈下降趋势,但各组间差异不显著,表明盐度变化会导致西杂鲟幼鱼血清总胆固醇与甘油三酯的含量产生一定的波动,但影响不显著。胆固醇是肝脏合成的一种类脂,在血液中以不同的脂蛋白形式存在,而甘油三酯是脂肪代谢的中间代谢物质。当盐度上升时,西杂鲟幼鱼血清中的总胆固醇逐渐上升,据此推测,此时总胆固醇转化为胆汁酸,促进机体对脂类的吸收,因此血清中的总胆固醇有所升高,而甘油三脂的含量下降,但在低盐条件下驯化西杂鲟幼鱼15 d后,并不会对这个过程造成显著的影响。血清蛋白是组织蛋白质合成的原料,但低盐驯化15 d后,对西杂鲟幼鱼血清总蛋白浓度无显著影响,说明盐度变化对西杂鲟幼鱼肝脏合成蛋白的能力无明显影响。
环境盐度变化引起鱼体生理应激而产生过量的活性氧自由基,为避免氧化损伤,机体调动抗氧化防御体系来维持机体内环境平衡[16],使机体产生应激以适应环境的改变。但长期处于应激状态会导致免疫机能下降,影响鱼体的生长。杨静雯等[20]在研究盐度对虹鳟和硬头鳟(Oncorhynchusmykiss)抗氧化酶活性影响的实验中发现,驯化时间在4~8 d内,各盐度组实验鱼超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、谷胱甘肽氧化物酶(GSH-Px)活性均有不同程度的下降,表明鱼类在受到盐度胁迫时会充分调动机体防御机制应对盐度变化产生的活性氧,使机体产生的活性氧含量降低,而抗氧化酶活力也随之下降。海水驯化对中华鲟(A.sinensis)血清抗氧化能力影响的研究中发现,每天盐度增加1,达到25后继续养殖3个月,海水养殖的中华鲟血清总抗氧化能力明显高于淡水组,表明盐度刺激增强了中华鲟的抗氧化酶活力[21]。而赵峰等[22]研究发现,在水体盐度为10的条件下,对鲟仍未产生氧化胁迫反应。本研究也发现,西杂鲟幼鱼驯化15 d后,盐度对CAT、MDA、GSH、T-AOC等抗氧化指标均无显著影响,说明低盐环境下产生的应激未能激活机体相关抗氧化酶清除氧自由基的能力。
3.3 低盐驯化对西杂鲟幼鱼血清激素水平的影响
神经内分泌系统是渗透调节的重要组成部分,但盐度变化破坏离子平衡后,甚至会引起渗透调节中激素水平的变化。其中性腺激素、皮质醇、胰岛素样生长因子1和甲状腺激素在渗透调节中起着重要作用,能够控制参与渗透调节器官的活动以及维持渗透压的平衡。前期研究发现,在高盐度胁迫下,能够改变血浆的渗透压,引起甲状腺激素水平升高。同时,甲状腺激素常与皮质醇和生长激素等其他激素一起参与鱼类的发育、生长、新陈代谢和渗透调节[23]。裸腹鲟(A.nudiventris)在盐度(0、4、8、12)驯化10 d后,血浆皮质醇的水平升高[24]。另外,将塞内加尔鳎(Soleasenegalensis)从海水(38)转移到不同的盐度(5,15,38和55)中驯化17 d,血浆皮质醇水平升高,而血浆甲状腺激素FT4水平降低,表明在渗透压调节过程中,这两种激素之间存在相互作用[25]。但本研究发现,在盐度为4和8的条件下驯化西杂鲟幼鱼15 d后,皮质醇和甲状腺激素(T3、FT3)水平无显著变化,其体重、体长、全长也均无显著差异,表明15 d的低盐驯化可以提高其耐盐性,进而未对甲状腺功能和生长造成影响。
3.4 低盐驯化对西杂鲟幼鱼免疫相关基因的表达水平的影响
盐度胁迫除了影响渗透压外,还可能影响免疫功能,改变免疫相关基因的表达水平。低盐胁迫银鲳(Pampusargenteus)引起的免疫相关基因表达变化比高盐胁迫更明显[26]。因此,本研究测定了低盐驯化对西杂鲟幼鱼免疫相关基因(hsp70、hsp90、tnf-α、gst、lysozyme)表达水平的影响。其中,热休克蛋白(HSPs)是免疫系统的重要组成部分,在内外环境应激中发挥重要作用。在盐度为12‰时,黑鲷(Myliomacrocephalus)hsp90在肝脏中表达水平最低,在盐度为6和50时升高[27]。为了适应高盐(12、33和50盐度浓度)胁迫,真鲷(Sparussarba)hsp70在肝脏中表达上调[28]。因此,盐度胁迫会增加渗透调节器官的代谢活性,从而导致组织中hsp70表达上调。本研究发现,hsp70、hsp90表达水平呈先下降后升高的趋势,但各组间差异不显著。tnf-α是免疫反应中吞噬细胞产生的主要促炎因子之一。银鲳在低盐(12)胁迫下,肌肉组织中tnf-α表达水平降低[26]。但本研究发现,西杂鲟幼鱼肝脏中tnf-α表达水平先升高后降低,且各组之间无显著变化。溶菌酶活性与先天免疫反应密切相关,它对外来物质的入侵反应敏感。暗纹东方鲀(Takifugufasciatus)肝脏溶菌酶活性在盐度为15时显著升高,并在盐度为30时仍维持较高水平[29]。与本研究结果相似,西杂鲟幼鱼在低盐驯化下,lysozyme基因表达水平逐渐升高,但各组之间无显著变化,因此,溶菌酶的升高表明在病原体入侵期间可以保护宿主的各种体液因子免受干扰。另外,尼罗罗非鱼(Oreochromisniloticus)在盐度为16时,鳃和肝脏中gst表达上调[11],说明盐度增加使得鱼体代谢活性增强,从而引起氧化应激产生更多的活性氧物质(ROS),刺激gst表达上调,来维持鱼体的动态平衡。本研究中,随着盐度升高,gst表达水平逐渐升高,但各组间无显著变化。综上所述,低盐驯化15 d后,对西杂鲟幼鱼免疫相关基因(hsp70、hsp90、tnf-α、lysozyme、gst)没有显著影响。
3.5 低盐驯化对西杂鲟幼鱼生长发育的影响
温度、光周期和盐度等环境因子都会对鱼类的生长产生影响。环境盐度是影响鱼类生长的关键因素之一,特别是在罗非鱼、鲟这类广盐性鱼类中。与脊椎动物类似,鱼类的生长很大程度上受生长激素(GH)/胰岛素样生长因子-I(IGF-I)轴的控制,通过内分泌、旁分泌或自分泌信号机制发挥作用。前期研究发现,鱼类igf-Ⅰ的表达对盐度变化高度敏感。随着盐度的增加,罗非鱼(O.mossambicus)、大西洋白姑鱼(Argyrosomusregius)、大西洋鲑鱼(Salmosalar)和黑鲷igf-Ⅰ的表达水平升高[9,30-31]。S4和S8处理组igf-Ⅰ表达水平与对照组相比有所升高,但无显著差异,表明在不同鱼类中,igf-Ⅰ可能在不同程度上参与了渗透压调节,从而使鱼类能够适应不同的盐度环境。另外,尼罗罗非鱼igf-Ⅱ的表达水平随着盐度的增加呈递减趋势,但盐度为0、4和8g/L时,igf-Ⅱ的表达水平没有显著差异[32]。与本研究类似,在盐度为4和8的条件下驯化西杂鲟幼鱼15 d后,igf-Ⅱ表达水平与对照组相比也无显著差异。
温度、光周期和盐度等也作为重要的环境因子参与鱼类性腺发育的调节。对于洄游性繁殖的鱼类,盐度是影响性腺成熟的重要因子之一。黑头软口鲦(Pimephalespromelas)和尼罗罗非鱼,随着环境盐度的增加,性腺发育和生殖均受到了抑制[33]。大麻哈鱼(Oncorhynchusketa)在产卵季节处于盐度低于0.5的环境中,才能正常发育成熟并完成繁殖活动[34]。在鱼类性腺发育过程中,卵泡刺激素(FSH)刺激性腺分泌雌二醇和睾酮等性类固醇激素,调节性腺的发育和配子的生成,促黄体激素(LH)则主要刺激产生17α,20β-二羟黄体酮,促使卵母细胞和精子的最后成熟并刺激排精和排卵。因此,为了阐明低盐驯化对西杂鲟幼鱼早期性腺发育的影响,本研究测定了脑和肝脏中fsh、lh、fshr、lhr的表达水平,随着盐度的增加,脑中fsh和lh的表达水平呈递减趋势,lh的表达水平在盐度8与对照组之间有显著差异,但肝脏中fshr、lhr和脑中fsh在各组间的表达无显著变化,通过15 d的低盐驯化,对西杂鲟幼鱼早期性腺发育没有直接的影响。另外,雌激素主要调节卵巢的发育、分化、维持以及卵子发生,这些作用主要通过核激素受体超家族中的受体(ers)介导[35]。但本研究发现,通过15 d的低盐驯化,雌激素核受体基因(erα、erβ)的表达水平在各组间无显著差异。卵黄蛋白原(VTG)受到雌激素的调控刺激其表达,本研究中vtg的表达水平也无显著差异。综上所述,通过15 d的盐度驯化,对西杂鲟幼鱼早期性腺发育相关基因表达没有显著影响,具体的调控机制还需进一步研究。
4 结论
本研究系统地分析了西杂鲟幼鱼在低盐驯化后,鳃、肾、肠Na+-K+-ATP酶活和血清Na+、Cl-含量、抗氧化指标、生化指标、激素水平及性腺发育相关基因表达水平的变化情况。研究结果表明,为适应低盐环境,西杂鲟幼鱼鳃Na+-K+-ATP酶在不同程度上参与了渗透压的调节,但低盐驯化对西杂鲟幼鱼生理状态及早期性腺发育均无显著影响。因此,为了促进西杂鲟的健康养殖,还要兼顾其他环境因素,如温度、光照、光周期等,适合西杂鲟幼鱼的最佳养殖环境还需进一步研究。
