湿地生态系统植硅体及其封存有机碳研究进展
2023-03-29王方怡游惠明洪志猛巫丽芸游巍斌何东进
王方怡,游惠明,洪志猛,曹 彦,4,巫丽芸,游巍斌①,何东进,5②
(1.福建农林大学林学院,福建 福州 350002;2.福建省南方森林资源与环境工程技术研究中心,福建 福州 350002;3.福建省林业科学研究院,福建 福州 350002;4.福建江夏学院金融学院,福建 福州 350002;5.福建农业职业技术学院,福建 福州 350002)
随着全球经济的发展,CO2排放量持续增加并引发一系列环境问题[1],而碳汇是一种有效吸收并储存大气CO2的方式。因此,如何长期稳定地固碳成为当前亟需解决的问题[2-3]。植硅体(phytolith)是一种微体植物化石,是高等植物从地下水中吸取单硅酸〔Si(OH)4〕,而后沉积于植物细胞间隙、内腔和细胞壁中的具有不同组合及独特形态的非晶态二氧化硅(SiO2·nH2O)矿物[4-6]。根据植硅体追溯母源植物细胞的种类,是推断植物群落演替、古气候变迁的关键线索[7-9]。植硅体在形成过程中封存有0.1%~6.0%的有机碳(phytolith-occluded carbon,PhytOC),简称植硅体碳[10-11]。尽管植硅体碳在土壤有机碳中占比仅为0.72%~9.26%[12],但其在植硅体坚硬外壳“保护”下于土壤或沉积物中留存长达数千年,相比于其他土壤有机碳的周转期至少高2个数量级,成为储存在土壤中的一个安全碳库[13]。因此,植硅体碳被认为是碳汇长期稳定的重要机制之一,并被认为可能是全球碳失汇的原因之一,是促进全球碳平衡和缓解气候问题等的重要途径[14]。目前,植硅体碳汇的相关研究已引起国内外众多学者的广泛关注[15-16]。
生态系统包括森林、草原和湿地等多种类型,其中,湿地包括沼泽、泥炭地、湖泊、河流及水稻田等[17]。湿地生态系统有“地球之肾”之美誉,是世界上最具有生产力的生态系统之一,是生物多样性的发源地[18]。湿地封存的碳对陆地碳的贡献率可高达15%,在全球生态系统碳汇中扮演着重要角色,进一步了解湿地植硅体固碳的潜力具有重要意义[19-20]。鉴于此,通过深入了解国内外相关研究动态,总结与归纳湿地生态系统植硅体与植硅体碳的基础研究、提取技术和应用,并展望未来的研究方向,以期科学评估湿地生态系统碳储功能,为湿地生态系统植硅体研究和经营管理以及生态环境保护提供理论依据。
1 湿地生态系统植硅体及植硅体碳的基础研究
1.1 湿地生态系统中植硅体形态与分类研究
1.1.1湿地生态系统中植硅体形态
植硅体形态研究始于学者对不同科属植物植硅体形态进行描述,这不仅是植硅体研究的根基,而且拓展了植硅体应用的广度和深度。当前,湿地生态系统植硅体形态研究集中于禾本和草本植物植硅体形态类型,禾本科常见植硅体形态见图1[21]。
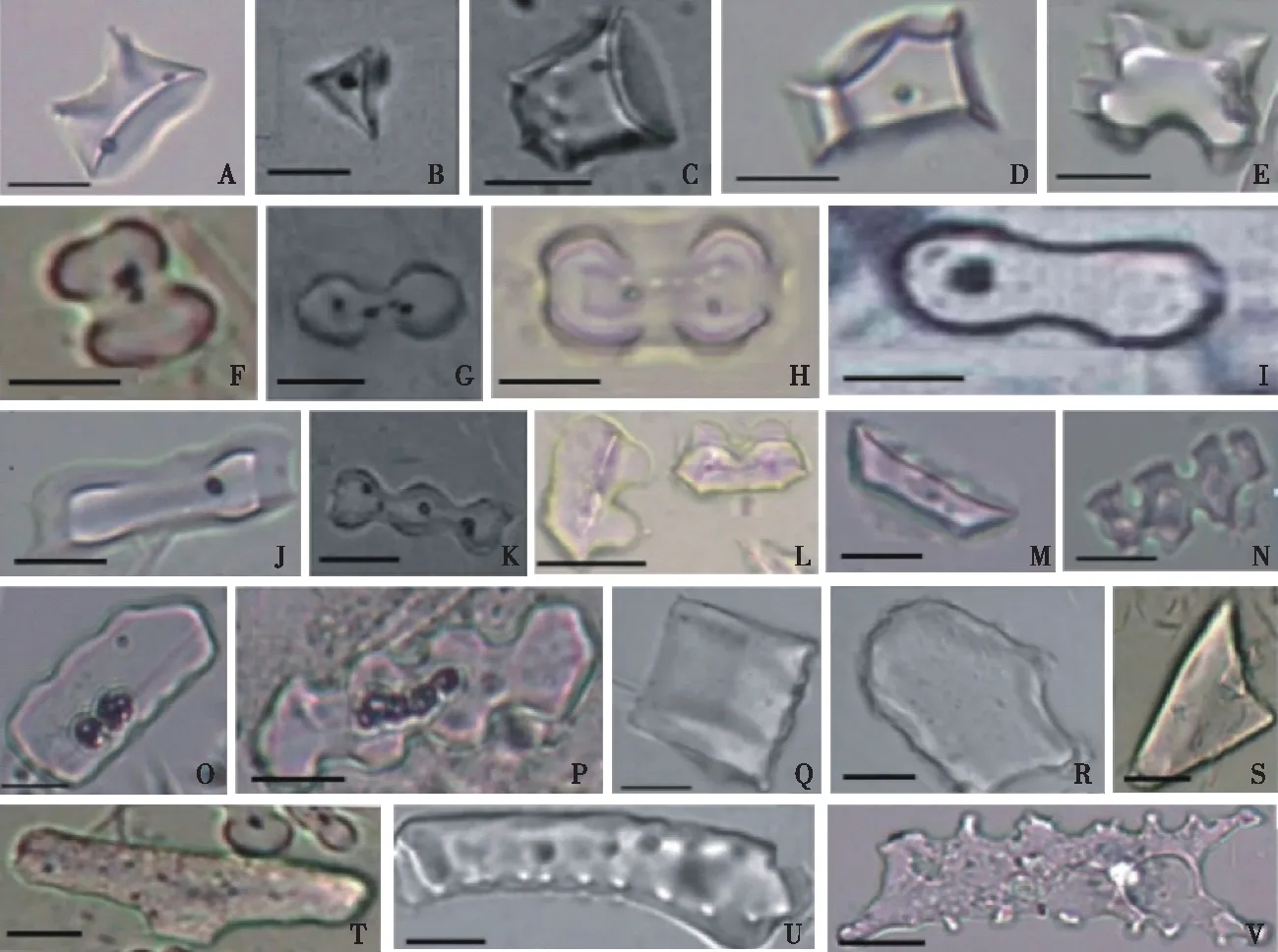
A—鞍型;B—尖顶帽型;C—平顶帽型;D—帽型;E、L—双峰颖片;F、G、J—黍哑铃型;H—水稻哑铃型;I—针茅哑铃型;K—多铃型;M—长鞍型;N—椎骨状;O—弱齿型;P—齿型;Q—方型;R—芦苇扇型;S—尖型;T—有树突的棒型;U—疣状突起棒型;V—牛角棒型。
研究发现,植物植硅体分布于根、茎、叶等部位,但其形态、组合各异[22]。水稻(Oryzasativa)植硅体形态在叶片中为扇型和哑铃型,在稃壳中为双峰型[23];黄河三角洲湿地芦苇(Phragmitesaustralis)的特征型植硅体,包括叶片的哑铃型和棒型植硅体,穗中的棒型、短鞍型和竹节型植硅体,根系中的哑铃型植硅体[24];长春南湖芦苇帽型和尖型植硅体主要分布于茎中,而硅化气孔多产生于叶中[25]。植物的不同细胞体发育的植硅体形态呈现出独特性。长白山区湿地表土植物短细胞沉积齿型、帽型、鞍型等植硅体,而非短细胞则生成棒型、尖型、方型等植硅体[26];禾本科植物的扇型植硅体由泡状细胞生成,哑铃型、鞍型植硅体则源于短细胞[23]。不同生长阶段各植硅体类型的含量变化特征有所异同。长春南湖芦苇生长过程中,叶中的硅化气孔含量递增,茎中则先增加后减少,而扇型、尖型等含量变化无显著规律[21]。同一类型湿地中,植硅体形态具有物质特异性,同种植物所处湿地环境差异产生的植硅体形态也有异同。主要植硅体形态类型见表1[24-25,27-32],对于长白山河滩中的杨柳科、香蒲科和藜科,不同科属主要的植硅体形态类型各异;生长在黄河三角洲河口湿地和长春南湖湿地的芦苇也呈现不同类型的植硅体形态;作为分布最广泛的湿地类型,泥炭地植硅体形态类型丰富,且不同泥炭地产生的植硅体类型有所异同。植硅体对判别植物群落具有一定的指示性。长白山区泥炭湿地植硅体中早熟禾亚科植硅体占优势,而IRIARTE等[33]发现乌拉圭亚高山区湿地土壤植硅体中黍亚科植硅体占比最大,因此,郭梅娥等[26]推断这是由于两地分别以黍亚科和早熟禾亚科植物为优势种所致。

表1 中国湿地植被和土壤的主要植硅体形态类型[24-25,27-32]
1.1.2湿地生态系统中植硅体形态稳定性
外界环境因素是湿地植硅体形态、组合各异的原因。应对不同的气候条件,黄河三角洲平原植硅体的形态类型表现出明显响应[34]。处于不同的土壤湿度环境中,东北松嫩平原芦苇部分植硅体大小产生显著差异[35];介冬梅等[36]研究发现芦苇植硅体的形态组合随湿度梯度产生明显变化,进一步推断湿度的增大在一定程度上有利于芦苇植硅体的发育。在不同纬度、地形和温热条件下,东北泥炭表土植硅体的分布和组合明显受到影响[37];而长白山区湿地表土植硅体主要影响因子是温度,随着温度的升高,植硅体种类固定,体积增大,植硅体组合差异显著[26];东北地区芦苇植硅体类型随着温湿度的改变无明显响应,具有稳定性[38],而鞍型植硅体浓度对温度的变化很敏感,从温带到暖温带呈递增趋势[32]。大气CO2浓度升高亦会对植硅体形态造成显著影响[39]。LI等[40]研究表明随着CO2浓度升高,松嫩草原芦苇植硅体不同类型和大小的比率发生改变,植硅体个体呈变小趋势。土壤营养状况也是影响植硅体形态的重要因子。随着氮浓度的增加,北方泥炭地植物的植硅体种类基本不变,但形态发生改变且具有差异性[31]。随着盐碱浓度的增加,羊草(Leymuschinensis)植硅体也增大[41]。
1.1.3湿地生态系统中植硅体的分类
在植硅体形态研究的基础上,建立植硅体的分类体系对植物分类以及古环境的重建具有非常重要的作用。为了避免分歧,2005年国际植硅体命名小组首次确立国际植硅体命名标准,并对植硅体形态做了细致规范化界定。我国主要以14个植硅体形态类型为基准,包括弱齿型、多齿型、哑铃型和棒型等,根据植硅体形态特征与环境的对应关系,这些植硅体又被分为示冷型(帽型、棒型、尖型、齿型和导管型)和示暖型(扇型、哑铃型、方型、鞍型和长方型)两种类型[4]。
尽管学者们以研究对象、研究方向及分类依据为出发点演变出多种分类方法,但基本形成两大主流分类系统:(1)根据植硅体自身形态特征的形态分类法,如扇型、平滑棒型、突起棒型、长方型等;(2)基于植硅体母源植被角度的自然体系分类法,分为禾本科、木本科、蕨类等[9]。目前,禾本科是草本植硅体研究的关注重点,学者们提出了基于禾本科植物的多套植硅体分类体系[21],而对其他科属植硅体的探索仅局限于其中零星的几种,分类体系的构建基础还不够完善,容易出现以偏概全的问题。同时,由于木本植硅体的形态较为繁杂,难以进行规范化描述和分类,并且研究覆盖面较小,多集中于松科和棕榈科,因而木本植硅体尚无较为完善的分类体系。
1.2 湿地生态系统中植硅体与植硅体碳含量及分布
1.2.1湿地植物植硅体与植硅体碳含量及分布
植硅体伴随着植物的生长而产生。月度植硅体含量呈正态分布,7月达到最高值[42]。植硅体含量和植物吸收硅的能力呈正相关关系,喜硅植物具有更强的硅化能力,更有益于植硅体的形成,可封闭更多的植硅体碳[23]。如禾本科植物吸收硅能力强,植硅体和PhytOC含量皆居于前列,尤其是水稻,PhytOC质量含量高达(0.25±0.07)%[43]。
植物植硅体在各器官表皮细胞中分布不均匀。叶片一般具有最高的植硅体含量[22]。研究发现在白洋淀湿地中,距水边不同距离的芦苇,其各器官植硅体含量均表现为叶>鞘>根>茎[42];而李自民等[44]以嘉兴杭嘉湖平原中5个水稻品种为研究对象,发现各器官植硅体含量表现为鞘>叶>茎>根>穗;SUN等[45]研究发现51个水稻品种植硅体含量各异,且器官之间含量值范围跨度较大,为9.69~175.52 g·kg-1。
同一类型湿地生态系统中的不同植物,植硅体与植硅体碳含量差异明显。杭州西溪[46]湿地18种植物中植硅体含量较高的是蒲苇(Cortaderiaselloana)、狗尾草(Setariaviridis)和三数马唐(Digitariaternata)等,而PhytOC含量较高的是狗牙根(Cynodondactylon)、荩草(Arthraxonhispidus)和芦苇等[47-48]。在稻田生态系统中,相比于其他科属,禾本科和莎草科植物有更高的植硅体含量,而禾本科中野生稻植硅体含量位居前列[49]。
1.2.2湿地土壤植硅体与植硅体碳含量及分布
湿地土壤植硅体和PhytOC主要富集于表层且含量丰富。经过50 a的水稻种植土壤表层植硅体积累量达4.04 g·m-2·a-1,PhytOC生产通量(以CO2计)为0.15~0.89 g·m-2·a-1[47]。白洋淀湿地土壤表层PhytOC生产通量(以CO2计)为0.03 g·m-2·a-1,PhytOC生产量(以CO2计)为5.49×106g·a-1[48]。奥克弗诺基沼泽泥炭土表层也沉积着大量植硅体[50]。有关水耕人为土对耕种时间的响应研究表明,有300 a植稻史的土壤植硅体含量高达17.51 g·kg-1,且不会随着耕种时间延长而增加[51]。由于土壤表层总有机碳(TOC)远大于下层,PhytOC/TOC比值随着远离表层而递增[52]。
植硅体的植源性造就了其含量随土层加深而减少的分布特点。土壤空隙是植硅体向土壤深处移动的通道,最深可达2.2 m,且植硅体含量逐渐递减[12];ZUO等[53]对该结论达成共识;罗东海等[54]针对不同土地利用方式土壤的研究也得出类似结论;而桂林市碳酸盐岩土壤20 cm以下则很少甚至没有发现植硅体的存在[55]。同时,植硅体的迁移与溶解速率及历程会受土壤孔隙度、酸碱度和水分状况等因素的影响[56]。灌溉频度对芦苇植硅体下沉路径影响的试验结果显示,与低频灌溉〔(2.7±1.6) mm〕的植硅体相比,高频灌溉〔(3.7±0.2) mm〕的植硅体可在离土壤表层更远的位置沉积[57];水耕人为土中由于犁底层的紧密性,植硅体的运移受到牵制[51]。
1.3 湿地生态系统中植硅体碳的影响因子
稳定性是植硅体碳的重要特性,了解影响植硅体碳的因素,有利于维持植硅体碳的稳定性和提高安全土壤碳封存速率。植硅体碳的影响因子由内在因子和外在因子所控制。内在因子主要指植硅体本身化学组成成分、植物元素及植物本身遗传特性等;外在因子主要包括气候、地表水文、CO2浓度以及土壤营养状况等。
1.3.1内因的影响
植硅体含量分布具有物种特异性。研究发现,同一湿地生长环境中,不同植物、不同部位植硅体含量和PhytOC含量各异[47-48]。不同植物吸硅能力差异性也会影响植硅体的产生[7]。张楠等[58]发现高吸硅能力的野生型水稻植硅体含量比其突变体更高。芦苇植硅体含量在8月达到峰值,9月达临界值,推测该现象与植物对硅的需求规律相关[38]。白洋淀湿地芦苇SiO2与其植硅体含量呈显著正相关,表明植物吸收Si的量越高,沉积在组织内的植硅体量也增加[42]。研究发现西溪湿地植物植硅体含量与其SiO2质量分数也呈显著正相关关系[46]。
同时,植硅体和植硅体碳内部组分间具有相关性。LI等[47]研究发现水稻植株PhytOC含量与植硅体中干物质的量、植硅体封存有机碳的效率有关。西溪湿地植物PhytOC含量与植硅体中有机碳含量、植硅体中干物质含量呈正相关关系[59],植硅体含量与其SiO2质量分数呈显著正相关关系[46]。盆栽水稻各器官中PhytOC含量与植硅体含量、植硅体中有机碳含量呈正相关关系[60]。
1.3.2外因的影响
(1)气候。气候的两大要素是气温和降水,而两者均受到纬度、海拔和海陆因素的影响,因此,这些因素也反映了一定的气候特征。在不同纬度下东北地区芦苇植硅体含量发生变化[61],两者未呈显著线性关系;但在纬度较低条件下植硅体含量相对较大,在纬度较高条件下植硅体含量相对较小。长白山湿地植硅体含量的影响因子包括研究区植被、湿度和海拔等,但对温度变化反应最为敏感[26]。从温带到暖温带,东北地区芦苇植硅体含量呈递增趋势,但在不同湿度区,其随温度的变化规律不同[32]。增温有助于松嫩草原羊草植硅体的生成,且能缓解施氮对羊草植硅体的抑制作用[62]。
(2)地表水文。湿地植硅体和植硅体碳含量对不同湿度环境有明显响应。湿度变化对不同器官、不同形态植硅体的影响有所差异。介冬梅等[36]发现湿度增加使长春南湖芦苇叶的硅化气孔增多,而鞍型植硅体减少,茎中植硅体含量变化无规律可循[25]。随着湿度增加,不同研究中植硅体和植硅体碳含量变化规律有所差异。LI等[47]研究表明西溪湿地近水区和近岸区芦苇植硅体含量变化规律表现为11 m>0.5 m>4 m>1 m>15 m>20 m;米慧珊等[63]认为闽江河口湿地植物靠近水边的距离越远,PhytOC含量就越高;而长白山湿地中水环境促进了植物硅化气孔的生成,植硅体封存有机碳的能力更强[29]。
(3)CO2浓度。大气CO2浓度升高可以作为自然生态系统的一种气体“肥料”,提高了植物光合作用,进而影响植物生长过程中植硅体含量。松嫩平原湿地中羊草广布,随着CO2浓度升高,LI等[64]发现其植硅体含量亦增加;介东梅等[65]认为不同形态植硅体含量受影响程度呈现差异性,尤以帽型植硅体变化最显著。
(4)土壤营养状况。土壤中有机质的积累会使湿地植硅体含量发生变化。研究发现增加芦苇秸秆等有机质的归还,对白洋淀湿地土壤植硅体含量提高有促进作用[42];水稻秸秆还田量与植硅体含量也呈显著关联性[51]。对施加不同水平岩粉条件下水稻植硅体稳定性的研究表明,盆栽水稻在岩粉含量分别为0、50、100、250和500 g·盆-1条件下,其各器官植硅体、植硅体碳含量(除叶)和植硅体碳生产通量显著增加[60]。随着氮浓度的升高,黑龙江大兴安岭泥炭地植物的植硅体含量大多表现为正向反馈,且不同物种的影响程度有所区别[31];然而,施氮对松嫩草原羊草群落中羊草植硅体有负面效应[62]。盐碱胁迫促进了羊草帽型植硅体的产生[41]。酸性环境有利于植硅体的长期完好保藏,而在碱性土壤(pH>8)中植硅体溶解性增强,且随碱性增大溶解速率加快[66]。如硅藻类植物植硅体在pH=3条件下基本上不可溶,在碱性条件下开始溶解直至消失,但是很缓慢[67];松嫩草原羊草植硅体含量随着环境pH值的增加呈现减少趋势[65]。土壤中离子含量也会对植硅体含量产生影响。东北地区湿地土壤SO42-、NO3-、Ca2+、Na+和K+含量与芦苇植硅体浓度呈较大相关性,其中,Ca2+、K+和SO42-对芦苇植硅体浓度影响较大[68]。随着若尔盖湿地退化程度的加剧,土壤有机碳库中PhytOC占比增加,与总有机碳(TOC)的相关性减弱[69]。
2 湿地生态系统植硅体及植硅体碳的提取技术
2.1 植硅体的提取
现有植物中提取植硅体的方法主要有切片法、灰像法、干式灰化法和湿式灰化法[70-71],不同提取方法的差异见表2。湿式灰化法是被广泛推崇的方法,为了节省样品处理时间、减小实验潜在的交叉污染和扩大测试样品数量,PARR等[72]对湿式灰化法进行改良,即采用微波消解法,将样品加入盛有HNO3和HCl的消化管中,在微波消解仪中消解,过筛、过滤后烘干得到植硅体。该方法广泛用于提取湿地植物,如水稻[58,73]、芦苇[9,35-38]、狗尾草[46]和蒲苇[46]等的植硅体。根据不同实验样品需要,为更有效地提取植硅体,有些学者对原有方法做了改进,如唐先干等[74]提取野生水稻植硅体时,加入25 mL浓HNO3放置48 h后,在电热板上加热,反复加入浓HNO3,直至溶液清澈,冷却后用蒸馏水离心(5 000 r·min-1,10 min)清洗2次,再用无水乙醇离心清洗2次。BOGDAN等[73]对水稻秸秆使用4 mL HNO3和1.5 mL H2O2,在190 ℃条件下对实验材料采用微波方式消解20 min,也有效提取了植硅体。

表2 不同植硅体提取方法对比分析
湿地土壤和沉积物植硅体的提取多采用重液浮选法,是目前国内外提取土壤和沉积物以及悬浮颗粒物中植硅体通行的唯一有效方法[42,75]。湿地土壤较为特殊,有机质的富集提高了土壤腐殖酸含量,增强了土壤对酸碱度变化的缓冲性能,用传统的微波消解法较难确定是否去除完全。重液浮选法利用植硅体具有相对较低密度的特点,通过配制含有一定比例碘化钾(KI)或碘化锌(ZnI)等的重液,可区分出相对体积质量大于植硅体的物质,浮选出植硅体。张新荣等[30]提取东北泥炭湿地植硅体时,在原有方法基础上做了改良,样品中加入6% KOH以除去土壤中的腐殖酸。重液浮选法已发展成熟且被广泛应用,但仍存在不够简洁、高效和精确等问题。
2.2 植硅体碳的提取与测定
PhytOC的测定方法主要有碳元素分析仪法、酸溶法[76]和碱溶分光光度法[77]。碱溶分光光度法即为加入强碱溶解植硅体,采用重铬酸钾-硫酸溶液氧化分光光度法定量测定PhytOC的方法。该方法规避了前两者存在的特定需求、安全隐患和环境污染等不足,能够低损耗、经济、高效地达到测定要求。目前,测定湿地植硅体碳含量时多采用该方法[21,24]。
然而,植硅体中碳的真实质量分数仍是目前的争论焦点。植硅体纯化方法的不同会导致PhytOC含量存在巨大差异。采用湿灰化法或微波消解法进行测定可能导致植硅体外部有机碳消解不完全,从而使植硅体中碳的真实质量分数被高估。而干灰化法中的高温过程会使植硅体高度破裂,内部碳被释放,从而使植硅体中碳质量分数被低估。前后者的数值差异达6~30倍[4]。因此,优化植硅体纯化方法将有助于准确测定植硅体中碳质量分数,为准确评估PhytOC封存潜力奠定基础。
3 湿地生态系统植硅体及植硅体碳的应用
3.1 植硅体在湿地古生态环境研究中的应用
了解以往地球环境的变迁历史和演化机制,预测未来生态环境发展趋势,是当前众多学者研究全球气候变化的聚焦点。植硅体具有产量大、分布广、形态独特且性质稳定的特点,属原地沉积,不易飞扬,是探寻古植被、古气候变迁过程的重要工具[78-80]。目前,植硅体在湿地生态系统考古中主要用于分析原生植被种类和古气候环境两大方面。
3.1.1利用植硅体分析原生植被种类
植硅体为植物微体遗存,其形态组合特征可反映母源植物类型,用于探寻现有湿地景观的发展历程和重现古湿地景观。KEALHOFER等[81]通过研究湖泊沉积物植硅体和孢粉,探索晚更新世以来东南亚大陆的古植被变化,追踪人类对环境的改造;RAMSEY等[67]通过阿兹拉克盆地沉积物中芦苇和莎草科等植硅体推测该地在更新世结束前为湿地沼泽景观;江苏昆山朱墓村遗址植硅体记录了在良渚文化时期该地有湿地景观[61]。将植硅体研究应用于重建湿地古环境中,主要依赖于现代湿地植物的植硅体研究。根据地中海西部表层土壤中的植硅体、孢粉记录,结合现有的植物景观,伊比利亚半岛三角洲地区全新世时期生态环境得以重建[82]。植硅体还可以将植物的属、种,甚至亚科进行区分。澳大利亚昆士兰Long Pocket湖泊沉积物植硅体记载了该地全新世早期以来植被构成相对稳定,以C4草本植物为主,有少量木本植物生长,干旱程度逐渐降低[83];对奥地利Blatna Brezovica遗址沉积物植硅体的研究发现,人类活动影响使得淡水湖转变为以泽泻属(Alisma)和黑三棱属(Sparganium)为主的湿地沼泽[28];新西兰博卡湾沉积物植硅体记录表明,冷干气候条件下,湖底生长有木本植物,而暖湿条件下生长有草本或莎草植物;植硅体随火山灰层的出现而变化,火山喷发过后,植硅体组合发生变化,推测出草本植物取代木本植物[82]。植硅体稳定碳同位素为重建古环境植被提供新的视角。由于C3和C4植物碳同位素组成存在差异,且植硅体碳与植物总有机碳同位素组成具有很好的相关性[84],因此,植硅体稳定碳同位素可以用于重建古环境C3和C4植物生物量的相对变化和演变过程,这对于揭示古环境的植被变迁具有重要意义[85]。同时,利用古土壤中植硅体13C丰度分布特征并结合14C测年,对研究地质历史时期植被面貌变迁的过程或许有突破性的进展[86]。
3.1.2利用植硅体分析气候演化过程
土壤和沉积物中植硅体可以提供丰富的环境信息。BRACCO等[87]通过米林潟湖流域沉积物植硅体,反演研究区古气候演化过程;新西兰博卡湾沉积物植硅体也记录了古气候条件[88]。根据表土植硅体的形态组合与采样点气候参数间的相关关系,建立表土植硅体组合-主要气候因子的转换函数,其已被成功地应用于地质历史时期古气候重建。如顾延生等[89]通过研究植硅体形态组合特征,结合孢粉及其温湿度指数重现了鄱阳湖区3 500多年来的古气候演化过程;赵洁等[90]研究浙江景宁望东洋湿地泥炭土壤植硅体形态和组合,并结合气候指数,推测出研究区古气候;马超等[27]结合研究区温度指数,利用植硅体反映鄱阳湖过去的气候演化;焦洁钰[91]利用东辽河中下游流域沉积剖面植硅体,得出中全新世以来研究区为草原群落,并利用古气候指数反演气候过程。尽管利用植硅体形态组合重建古环境研究取得较为显著的成果,但植硅体气候指数的建立只考虑植物种类及数量的变化,而对环境因子造成同种植物植硅体形态组合的变化考虑不足[92];另外,一些植硅体气候指数的解译还存在争论。因此,利用植硅体气候指数或转换函数重建古环境的定量研究准确性还有待于进一步提高。利用植硅体稳定碳同位素分析方法开拓了古气候重建的新领域。CARTER[93]对不同类型现代植物与植硅体稳定碳同位素组成间的差值进行定量和校正研究,结果表明,植硅体稳定碳同位素比值可用于计算大气中CO2同位素的值。植硅体稳定碳同位素可以用于重建古大气中CO2的变化,是富有潜力的古环境重建研究指标[7]。但由于同位素分馏的复杂性和区分植物不同部位植硅体的困难性,目前利用其重建古环境研究的工作还很少开展[80]。
3.2 湿地生态系统植硅体碳汇贡献研究
湿地生态系统在全球固碳中占有重要地位,深入研究各组成部分固碳能力可提高碳汇潜力估算的精准度和全面性,同时也是湿地植硅体及植硅体碳的重要应用领域之一。
全球湿地植物每年固定4.39×107t CO2[15],我国湿地植硅体每年固定CO2达0.04×106~1.05×106t[47]。从各组分来看,2012年全球水稻种植面积为15.50×106hm2,假设全球水稻PhytOC生产通量相近,那么全球水稻植硅体每年约封存6.10×106~15.4×106t CO2,约等于同年全球CO2排放量的0.02%~0.05%[60];中国稻谷种植面积为30.10×106hm2[15],稻田湿地生态系统中水稻PhytOC生产通量(以CO2计)为46.5~279.31 kg·hm-2·a-1[68],每年可封存2.04×106t CO2[94],土壤PhytOC生产通量(以CO2计)约为1.48~8.88 kg·hm-2·a-1[44],碳汇潜力为0.27×106t CO2[43];SUN等[95]发现水稻籽壳PhytOC生产通量(以CO2计)为0.45~3.46 kg·hm-2·a-1;LI等[47]研究表明杭州西溪湿地PhytOC生产通量(以CO2计)为3~77 kg·hm-2·a-1;以芦苇为主的白洋淀地上部分PhytOC生产通量差异性较小(48~54 kg·hm-2·a-1,以CO2计),其土壤(0~15 cm)中PhytOC生产通量(以CO2计)达33.7 kg·hm-2·a-1,碳汇潜力(以CO2计)为5.49 t·a-1[48];芦苇根、茎、叶和鞘各器官均产生PhytOC,其生产通量(以CO2计)分别为1.06~1.17、1.06~1.39、0.95~1.69和0.91~0.95 g·m-2·a-1[47]。
由表3[6,48,94,96-97]可知,湿地生态系统对全球碳汇的贡献具有举足轻重的地位,同时不同生态系统中气候、植被和土壤等因素的差异可能导致植硅体碳汇量各异,进一步证明估算湿地生态系统碳汇潜力具有重要意义。此外,湿地具有突出的PhytOC生产通量,通过合理选种芦苇、水稻等高植硅体含量的植物来扩大湿地面积,是提高湿地生态系统固碳潜力的有效措施[48]。

表3 中国主要陆地生态系统植硅体碳生产通量和生产量[6,48,94,96-97]
4 未来展望
随着温室效应的加剧和碳循环平衡需求的迫切,如何最大程度地发挥湿地生态系统植硅体的长期稳定固碳作用成为重要议题。然而,对湿地植硅体及其封存有机碳的定性和定量研究亟待加强,可从以下几个方面加以推进。
(1)建立植硅体形态和含量及封存有机碳的基础数据库。目前,对植硅体的研究大都局限于某种单一的湿地类型,或是基于某一地区湿地生态系统不同植被、不同器官植硅体含量差异的研究,而对于更大尺度范围植硅体含量的研究则较少。从缩小尺度的角度来看,植硅体广布于植物的各个部位,且已有研究发现各器官的植硅体和PhytOC含量有所区别,可见,应针对植株各器官乃至分子细胞水平进行精细化探索。同时,湿地覆盖范围广且具有生物多样性,有必要增加研究样地数量,致力于不同湿地类型、植物、树龄和生长阶段研究,涉及更宽广的时空尺度,建立全面、系统的植硅体形态和含量数据库,为准确估算湿地生态系统植硅体碳汇提供保障,促进植硅体基础和应用研究的深入。
(2)全面探究植硅体对环境因子的响应,建立预测植硅体碳汇的模型。众多学者多是对植硅体及其封存有机碳含量的时空差异性和物种特异性进行探讨,而对引起其异同的内在因子、外在因子,以及响应机制的相关研究还较为匮乏。区分不同环境因子对湿地植硅体及其封存有机碳的影响较为困难,且同一环境因子对湿地不同植物种类、土壤类型植硅体的作用程度也存在异同,同时有关影响因子作用机制的探讨较少。因此,有必要充分了解影响植硅体碳汇的潜在环境因子,进一步加强植硅体定性与定量研究,通过构建评价及量化植硅体碳汇潜力的模型,并将其应用到实际预测工作中,对植硅体碳汇未来走势做出判断,为湿地生态系统碳汇预估提供数据支撑。
(3)建立植硅体的产生、溶解和沉降的循环系统。土壤与地上植物植硅体间不仅仅是简单的数量关系,其中,还涉及植硅体的保存、迁移和搬运等各种因素的影响,因此,表土与植物群落植硅体间的定量关系有待进一步深入分析。而目前研究多聚焦于湿地植物-土壤系统,它们的联结纽带——凋落物和植物根系则易被忽略。土壤中植硅体碳主要来自于凋落物的输入,而植物根系是土壤营养物质的传输通道,然而至今湿地植硅体在凋落物中的归还特征、根系中的迁移皆尚不明确。因此,系统地分析探讨植硅体在植物、根系、凋落物和土壤中的迁移、埋藏规律,建立植硅体产生、溶解和沉降的循环系统,对全面掌握植硅体在系统中的流转状况,避免遗漏植硅体碳汇量的估算,厘清全球生物地球化学固碳机制具有十分重要的意义。
