一株光合细菌的筛选及促进苦草生长的特性
2023-03-29高蓉蓉邓雪婷吴炜顺盛下放何琳燕
高蓉蓉,邓雪婷,吴炜顺,盛下放,何琳燕
(南京农业大学生命科学学院/ 农业农村部农业环境微生物重点实验室,江苏 南京 210095)
沉水植物不仅可以吸收水环境中的氨、氮等营养物质,还能分泌化感物质抑制水中藻类的生长繁殖[1-3],降低水体浑浊度,提升水体透明度[4],在净化水质、维持水环境生态平衡方面起着至关重要的作用。沉水植物对重金属元素有一定的富集作用,可以降低水环境中重金属含量[5-6]。然而低温、过量重金属、稀薄底泥和光照不足等条件使水生植物生长发育受阻、生理代谢过程发生紊乱[7-8]。目前,一些学者采用改良底质[9]、提高光补偿深度[10]、改变种植方式[11]和外源添加生根剂[12]等方法来提高沉水植物存活率,而这些方法具有费用高、处理时间长、环境影响大、可能造成二次污染等缺点,所以需进一步扩展促进沉水植物生长的方法。
植物根际促生菌(plant growth-promoting rhizobacteria, PGPR)指生活于植物根系,能够促进植物生长和吸收营养物质的一类细菌,它可以通过固氮、磷酸盐增溶或生产铁载体来增强植物营养,通过产生植物激素或影响酶活性来改善根系生长发育[13]。目前已鉴定出多种PGPR菌株,主要种类包括芽孢杆菌属(Bacillus)、假单胞菌属(Pseudomonas)、固氮菌属(Azotobacter)和根瘤菌属(Bradyrhizobium)[14]。有研究表明接种PGPR菌株能够促进高营养环境下沉水植物生长。WANG等[15]发现在沉积物高有机质胁迫条件下,分离的8株植物促生菌(1株为葡萄球菌属,7株为芽孢杆菌属)显著促进苦草生长,株高最多增加96%,而且PGPR菌株对沉积物中无机态N、P具有一定控制作用。王会会等[16]发现接种根际促生菌PC2(Bacillusstratosphericus)能使苦草株高、根长、地上鲜重和根鲜重比对照分别增加165.0%、17.4%、378.8%和165.1%。然而在一些浅水环境或低营养环境水体中,特别是一些池塘在养殖前期,底泥有机质少,土层较薄,不利于水草扎根,植物难以定殖,抑制沉水植物生长。因此,探索微生物促进沉水植物生长的方法和作用机制具有重要意义,有望开发新型生物促根剂和修复水环境的新技术。
光合细菌(photosynthetic bacteria,PSB)是地球上最早具有原始光能合成系统的原核生物,广泛分布在稻田、湖泊、河流、海洋、污水污泥和土壤中。目前,光合细菌广泛应用于污水处理[17]、预防鱼虾类疾病[18]、提高农作物产量和植物抗逆能力[19-21]等领域。因此,从湖泊水样中筛选出光合细菌,综合分析光合细菌对苦草(Vallisnerianatans)和大苦草(Vallisneriagigantea)两种常用沉水植物生长特性的影响,以期为微生物促进沉水植物的生长和水质改良提供一种新思路和理论依据。
1 材料与方法
1.1 供试材料
水样来源于江苏金坛长荡湖,水体样品选取表层水,取0.5 m深度以内的水样用50 mL离心管装取,立即置于装有冰块的保温箱中保存,当天送回实验室保存。参照菌株SphingomonassanguinisYJ11来自笔者所在实验室收藏。试验植物苦草(Vn)和大苦草(VgG)来自湖北省洪湖市滨湖街道。试验水体为自来水,底泥来自江苏南京下马坊遗址公园河道。
LB培养基:胰蛋白胨10.0 g,酵母膏5.0 g,NaCl 10.0 g,琼脂16 g,蒸馏水1 000 mL,pH为7.0。1/5 LB培养基:胰蛋白胨2.0 g,酵母膏1.0 g,NaCl 2.0 g,琼脂16 g ,蒸馏水1 000 mL,pH为7.0。光合细菌富集培养基[22](LPM):NH4Cl 1.0 g,NaCl 1.0 g,CH3COONa 3.0 g,MgCl20.2 g,NaCl 1.0 g,KH2PO40.2 g,TM储液1 mL,酵母膏0.8 g,蒸馏水1 000 mL,pH为7.2。TM储液:H3BO30.70 g,MnSO4·H2O 0.389 g,NaMoO4·2H2O 0.188 g,Cu(NO3)2·3H2O 0.01 g,蒸馏水1 000 mL,pH为7.2。光合细菌分离纯化固体培养基(SPM):上层培养基(USPM)在富集培养液中加入w=1.5%的琼脂,下层培养基(DSPM)在富集培养液中加入w=2.0%的琼脂。无机磷培养基:葡萄糖10.0 g,(NH4)2SO40.5 g,酵母膏0.5 g,NaCl 0.3 g,KCl 0.3 g,MgSO40.3 g,FeSO40.03 g,MnSO40.03 g,Ca3(PO4)25.0 g,蒸馏水1 000 mL,pH为7.0~7.5。
1.2 光合细菌的筛选
1.2.1光合细菌的富集
取10 mL水样经滤纸过滤后,在8 000 r·min-1(离心半径为68 mm)条件下离心5 min,弃去上清液,用2 mL无菌去离子水重悬沉淀,加入装有8 mL无菌富集培养基的试管中,再加入2 mL液体石蜡隔绝空气,一次性封口膜密封,置于30 ℃、[光]照度为3 000 lx环境中培养,等到培养液由无色透明变为红色后,从中取出2 mL菌液,置于装有8 mL无菌富集培养基的试管中,再次富集,反复富集,直到菌液颜色变为深红色为止。
1.2.2光合细菌的分离纯化
将光合细菌富集液按照10倍逐级稀释,取10-4、10-5、10-6和10-74个梯度稀释液各100 μL均匀涂布于DSPM培养基,待表面干燥后,平铺约20 mL USPM培养基[23],凝固后置于30 ℃、[光]照度为3 000 lx环境中培养1周,待平板中长出单菌落后,挑取两层培养基间单菌落,在SPM固体培养基上反复划线分离,直至整个培养基表面为单一形态菌落且镜检无杂菌,将纯化后的菌株接种到密封性良好的DSPM斜面试管中,4 ℃条件下保存。
1.3 细菌生物学特性的检测
1.3.1细菌产吲哚-3-乙酸(Indole-3-acetic acid,IAA)能力的测定
将分离纯化后的菌株接入含有L-色氨酸(100 mg·L-1)的1/5 LB液体培养基中,在30 ℃、180 r·min-1条件下振荡培养3 d。将培养好的菌液以5 000 r min-1(离心半径为68 mm)离心10 min,取离心后2 mL上清液,加入50 μL 10 mmol·L-1正磷酸,再加入2 mL Sackowski′s显色剂,充分混合,室温条件下避光显色反应30 min,在530 nm波长条件下测定吸光值[24]。以IAA标准品按上述条件反应制作标准曲线,根据标准曲线计算菌株IAA产量。
1.3.2细菌产生物膜能力的测定
将分离纯化后的菌株培养至对数生长期,按φ=2%的接种量接种于液体LB培养基试管中,在28 ℃培养箱中静置培养3 d,观察液体表面和试管壁是否产生膜状物质,记录生物膜形成情况。
1.3.3菌株溶磷能力的测定
参考黄涛[25]的方法并做适量改进:将培养至对数期的N1和YJ11细菌按φ为1%的接种量分别接入无机磷培养基中,以不接菌处理作为CK,每个处理3个重复;置于30 ℃、170 r·min-1条件下振荡培养6 d。取5 mL菌液以4 ℃、5 000 r·min-1(离心半径为68 mm)离心10 min取上清液,加2滴2,6-二硝基苯酚,之后滴加稀盐酸调至溶液无色,最后加钼锑抗显色液5 mL,定容至刻度线,CK使用空白培养基。测定溶液在720 nm波长的吸光度。
1.3.4细菌生长温度范围测定
将菌株划线接种至LB培养基平板上,分别在7、15、30和37 ℃条件下培养7 d,对各温度能产生明显菌落的菌株进行记录。
1.4 基于16S rDNA序列分析的菌株鉴定
用细菌总DNA提取试剂盒(GENEray)提取菌体总DNA。采用细菌扩增通用引物27F和1492R进行PCR扩增,扩增体系为Premix 12.5 μL,上游引物27F 1 μL,下游引物1492R 1 μL,模板DNA 1 μL,ddH2O 9.5 μL,扩增程序为95 ℃预变性10 min,94 ℃变性1 min,55 ℃退火45 s,72 ℃延伸1.5 min,35个循环,最后72 ℃延伸10 min。PCR产物经w=1%琼脂糖凝胶电泳检测后送检测机构测序,获得序列后在NCBI和EzTaxon网站进行比对,并用MEGA 6软件绘制进化树。
1.5 不同菌株对沉水植物生长的影响
1.5.1盆栽试验设置
每种沉水植物设置3个处理:(1)无菌水(CK);(2)接种N1菌悬液(N1);(3)接种YJ11菌悬液(YJ11)。将供试菌株YJ11接种于1 L LB培养基中,30 ℃、180 r·min-1条件下振荡培养20~24 h至对数生长中后期,在3 000 r·min-1(离心半径80 mm)条件下离心15 min收集菌体,用无菌水清洗2次,然后用200 mL无菌水将菌体重悬,制成菌悬液(109CFU·mL-1)。将光合细菌N1按φ=10%接种量接种到200 mL光合细菌富集培养基,置于30 ℃、[光]照度为3 000 lx环境中由无色透明培养至深红色后,按照YJ11菌悬液制备方法制成菌悬液。分别截取生长旺盛、大小一致的苦草和大苦草根约2 cm,茎7 cm,用φ=75%乙醇消毒,清水洗净后,分别浸于上述菌悬液4 h后,移栽到口径23 cm、高25 cm的塑料桶中,桶底平铺厚度约4~5 cm除去杂质的底泥,加入5 L自来水,并记录液面高度。苦草、大苦草每桶种10株,将根插入底泥约2 cm深处,均匀种植,每个处理设置3个重复,培养4周。试验结束后,测量不同处理沉水植物生长、生理指标。
1.5.2沉水植物生长指标的测定
分别测量苦草和大苦草株高、根长、鲜重和干重。
1.5.3沉水植物生理指标的测定
根活力采用氯化三苯基四氮唑(TTC)法[26]测定。叶绿素含量采用丙酮乙醇混合法[27]测定:称取0.2 g新鲜叶片,置于25 mL有塞试管中,加入10 mLV〔丙酮(80%)〕∶V(乙醇)=1∶1混合液,置于避光条件下72 h,当叶片变白褪色,分别测定645、663 nm波长条件下吸光值(O645和O663)。叶绿素含量(mg·g-1)为(20.2O645+8.02O663)×1 000×(V/W),其中,V为植物叶片样品浸提液体积,mL;W为植物叶片样品鲜重,g。沉水植物根部抗氧化酶活性测定方法:超氧化物歧化酶(SOD)活性采用氮蓝四唑(NBT)法测定,以NBT光还原50%为1个酶活单位(U),酶活性以U·g-1表示;过氧化氢酶(CAT)活性采用过氧化氢比色法测定,以1 min 240 nm波长条件下吸光值变化0.01为1个酶活性单位,酶活性以U·g-1·min-1表示;过氧化物酶(POD)活性采用愈创木酚法[28]测定,以1 min 470 nm波长条件下吸光值变化0.01为1个酶活性单位,酶活性以U·g-1·min-1表示。
1.5.4苦草根表及组织内细菌数量
采用LB固体培养基通过平板计数方法定量统计鲜重条件下苦草根表和根内细菌数量。根表:首先用无菌去离子水清洗苦草根部,用无菌滤纸吸干水分后,称重,置于无菌离心管中,加入5 mL无菌去离子水,涡旋振荡30 s,即得到菌悬液。根内:将根表面用无菌去离子水清洗后,无菌滤纸吸干水分,称重,在超净工作台中先后用φ为75%乙醇表面消毒3~5 min,再用无菌去离子水漂洗干净后,置于无菌研钵中研磨成匀浆,制得菌悬液。
1.5.5苦草根表细菌形态结构表征
将苦草根部从底泥中轻轻取出,用无菌PBS缓冲液清洗根部残留底泥(需缓慢冲洗,不能将根表细菌洗掉),采用冷冻扫描电子显微镜(英国Quorum PP3010T,拍摄仪器:Hitachi SU8010)观察根部细菌形态。
1.6 数据处理与统计分析
采用Excel 2016、GraphPad Prism和SPSS 25.0进行数据处理,采用GraphPad Prism绘图,采用SPSS 25.0进行单因素方差分析(One way ANOVA),显著水平设为P<0.05。
2 结果与分析
2.1 光合细菌的筛选与鉴定
如图1所示,光合细菌富集1周后,试管中富集液开始呈现红色;富集2周后,富集液颜色加深,试管壁有红色菌体附着;富集3周后,富集液颜色变为红棕色,试管壁有红色菌体附着增加,并且试管底部有大量红色沉淀。

图1 光合细菌富集液颜色变化
采用光合细菌固体培养基从长荡湖水样中分离纯化出一株产生红色菌落的细菌,编号为N1。菌株N1的16S rDNA片段经PCR扩增后测序,将获得的16S rDNA序列通过NCBI数据库进行BLAST比对,采用MEGA 6软件构建进化树,发现菌株N1与RhodopseudomonaspalustrisATCC 17001的相似性为99.64%,属于沼泽红假单胞菌(图2)。将菌株16S rDNA序列提交至NCBI Gene Bank,获取登录号为OL662901。
将光合细菌N1和菌株SphingomonassanguinisYJ11作为后续试验的供试菌株。菌株N1菌体呈短棒状,菌落较小,呈圆形,表面光滑,少隆起,边缘整齐,较湿润;菌株YJ11呈短棒状,菌落较小,呈圆形,为黄色,湿润(图3)。
2株供试菌株生物学特性见表1。菌株N1产IAA能力高于菌株YJ11,且产生物膜,溶磷能力可达93.36 mg·L-1,生长温度范围为15~40 ℃,最适温度为28~30 ℃。
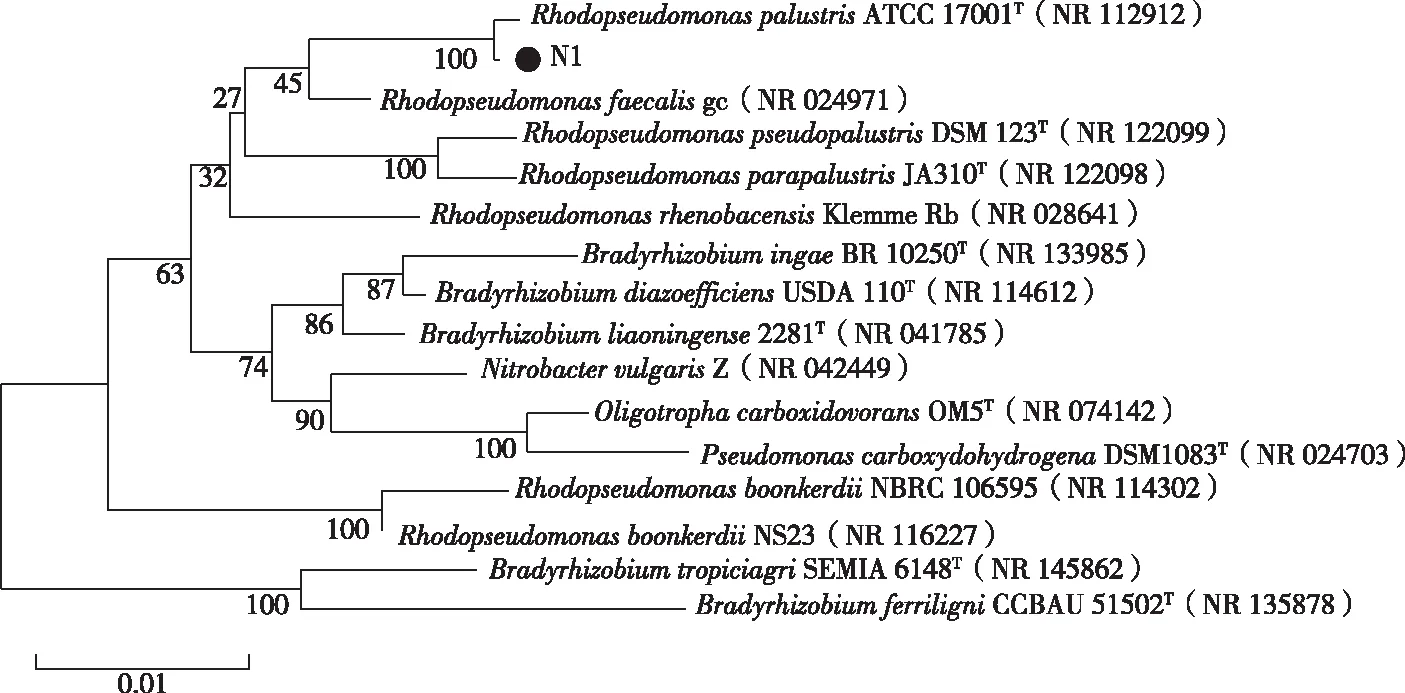
图2 基于菌株N1部分16S rDNA序列构建的系统发育树
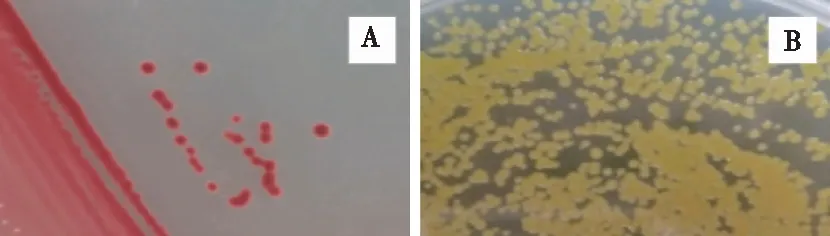
A为菌株N1在光合细菌分离培养基上的菌落形态,B为菌株YJ11在LB培养基上的菌落形态。
2.2 不同菌株对沉水植物生长指标的影响
如表2和图4所示,接种N1和YJ11菌悬液后,各处理组苦草和大苦草生长明显优于CK,根系更粗壮,根须数量更多,且颜色更白更健康。与CK相比,N1组2种苦草株高和根长显著增加16.6%~40.0%(P<0.05),YJ11组2种苦草株高和根长增加4.4%~30.0%(P<0.05),但接种菌株YJ11对大苦草株高没有显著促生作用。

各处理含义见表2。
由表2可知,不同菌株对2种苦草鲜重、干重的影响存在差异。与CK相比,接种菌株N1后苦草和大苦草鲜重分别显著增加24.5%和58.8%(P<0.05),干重也分别显著增加20.0%和22.7%(P<0.05),而接种YJ11没有显著提高苦草和大苦草鲜重、干重。
综合上述各项生长指标,发现接种菌株N1显著提高苦草株高、根长、干重和鲜重。与菌株YJ11相比,菌株N1对苦草的促生作用更显著。

表1 两株供试菌株生物学特性
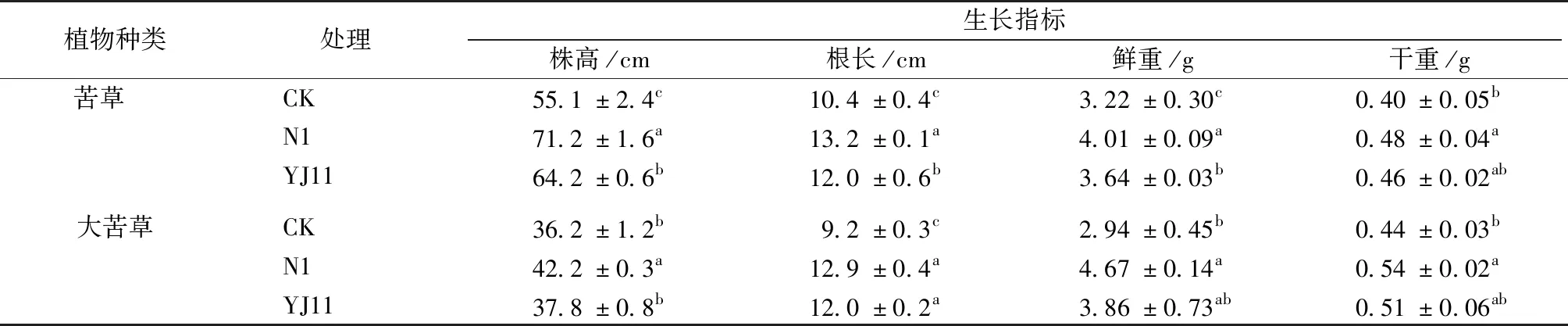
表2 接菌处理对苦草和大苦草生长指标的影响
2.3 不同菌株对沉水植物生理指标的影响
2.3.1不同菌株对沉水植物根活力的影响
由图5可知,不同菌株对沉水植物根活力的影响存在差异。与CK相比,接种菌株N1和YJ11后苦草、大苦草根活力显著增加20.2%~47.5%(P<0.05),且菌株N1效果更好。

同一组直方柱上方英文小写字母不同表示同一种植物不同处理间根活力差异显著(P<0.05)。各处理含义见表2。
2.3.2不同菌株对沉水植物叶片叶绿素含量的影响
由图6可知,与CK相比,接种菌株N1、YJ11后苦草叶片叶绿素含量分别显著增加28.4%和15.6%(P<0.05),且N1处理效果更好。接种菌株N1能显著增加大苦草叶绿素含量(33.3%),接种菌株YJ11则不能。

同一组直方柱上方英文小写字母不同表示同一种植物不同处理间叶绿素含量差异显著(P<0.05)。各处理含义见表2。
2.3.3不同菌株对沉水植物根部抗氧化酶活性的影响
由图7可知,不同菌株对沉水植物根部抗氧化酶系统产生不同程度影响。与CK相比,接种菌株N1后苦草SOD活性显著升高15.7%(P<0.05),而各处理大苦草SOD活性没有显著差异。与CK相比,接种菌株N1后苦草和大苦草POD活性分别显著增加37.8%和28.4%,CAT活性分别显著升高29.5%和22.0%(P<0.05)。接种菌株YJ11仅能显著增加苦草POD和CAT活性(45.9%和41.7%),而不能显著提高大苦草抗氧化酶活性。

同一幅图中,同一组直方柱上方英文小写字母不同表示同一种植物不同处理间某指标差异显著(P<0.05)。各处理含义见表2。
2.4 苦草根表及组织内细菌数量
由图8可知,接种菌株N1后苦草和大苦草根表及根内细菌数量分别达到6.17×103和4.50×103以及7.83×103和6.11×103CFU·g-1,远远多于CK和YJ11处理。接种菌株YJ11后苦草和大苦草根表及根内细菌数量也呈显著增加。

同一组直方柱上方英文小写字母不同表示同一种植物不同处理间某指标差异显著(P<0.05)。各处理含义见表2。
2.5 苦草根表细菌形态结构表征
采用冷冻扫描电子显微镜观察细菌在苦草根部定殖的形态特征(图9)。图9显示,CK苦草根面长边均平行于根的纵轴,且排列紧密,根表面呈现皱纹状结构,提供了较大的表面积供细菌附着,这些结构为细菌黏附提供了更多的定殖位点,有助于细菌在根表面形成生物膜。图9(H、I、Q和R)显示,接种菌株N1和YJ11后苦草根表多处均能观察到菌体,菌株N1在苦草根表附着紧密,细菌之间粘连性好,形成大量微菌落聚集在一起,附着在苦草根表;菌株YJ11在苦草根表定殖的菌落大多以零星散落方式附着,且细菌之间粘连性较差,不再以微菌落聚集形式定殖,也未观察到明显的生物膜结构。
3 讨论
沉水植物具有“水下森林”的作用,不仅具有吸收和富集根际微生物、降解水中污染物、净化水质的作用,而且还能够提升景观效应。目前,很多研究表明水质、底质、光照和水流等环境因子严重制约着沉水植物的生长[29],如何促进沉水植物的生存和生长是水生生态景观建设的难点。

A、B、C、J、K和L为放大100倍;D、E、F、M、N和Q为放大500倍;G、H、L、P、Q和R为放大1万倍。各处理含义见表2。
目前,研究表明一些植物促生菌以及水生植物体内分离出的内生菌可以促进水生植物生长,包括芽孢杆菌属、不动杆菌属、假苍白杆菌属、泛菌属和假单胞菌属[16,30]等。不仅低营养环境会影响水生植物生长,水体中有机质含量过高也会对其产生胁迫效应,而微生物可以通过降解水体中高负荷沉积物促进沉水植物生长[31]。与菌株YJ11相比,笔者筛选出的光合细菌N1具有较好的溶磷能力,且高产IAA,显著提高苦草株高、根长、鲜重、干重、根活力和叶绿素含量等指标,促进苦草生长。IAA是植物生长调节剂,能够吸收促进植物根系生长所必需的营养物质,进而促进根的生长[32]。王会会等[16]研究发现Bacillusstratosphericus、Bacillussubtilis和Bacilluscereus对苦草生长具有显著促进作用,且Bacillusstratosphericus的IAA产量最高,溶磷能力最强,对苦草的促生效果最好,笔者研究结果与之一致。
有研究表明,一些光合细菌可以通过产生铁载体、5-氨基乙酰丙酸(5-ALA)、核苷酸、氨基酸、ACC脱氨酶和IAA以及溶磷、固氮等多种促生长机制来促进植物生长。胡碧惠等[33]发现RhodopseudomonaspalustrisCQV97能够产生异羟肟酸型铁载体,为深入理解光合细菌制剂防病、促生长机制奠定基础。BATOOL等[34]发现光合细菌RhodopseudomonaspalustrisCS2和RhodopseudomonasfaecalisSS在As胁迫条件下仍可以显著增加豇豆根长和地上部长度。GE等[35]研究结果表明接种RhodopseudomonaspalustrisG5显著增加黄瓜枝条高度、叶绿素含量、根活力以及SOD和POD活性,降低丙二醛含量,减轻Cd对黄瓜的伤害。笔者研究中,接种沼泽红假单胞菌N1后2种苦草根活力、叶绿素含量、抗氧化酶活性都显著提升,且菌株N1对苦草的促生作用好于菌株YJ11。王艺蒙[36]从基因组水平上系统分析了99株不产氧光合细菌(APB)促进植物生长相关功能基因的分布规律,发现APB可以通过产生IAA和5-氨基乙酰丙酸、溶磷、调节乙烯合成等机制直接促进植物生长,通过合成铁载体、胞外多糖和亚精胺来提高植物抗逆性以及通过合成金属硫蛋白、胞外多糖来降低有效重金属含量,以间接促进植物生长。可见,光合细菌对植物的促生作用是多方面、多层次的,今后还需强化光合细菌促生作用的分子水平研究。
由于水具有流动性,细菌不易在水生植物根部定殖。生物膜的形成不仅对细菌自身起到很好的保护作用,而且使其能够在植物根部有效定殖。BEAUREGARD等[37]研究结果表明Bacillussubtilis中一些参与细菌生物膜形成的基因也参与了其在拟南芥根部的有效定殖。笔者研究中,2株供试菌株N1和YJ11都具有产生物膜的能力,接种后2种苦草根表和根内细菌数量比CK均显著增加,且菌株N1在苦草根表面附着紧密,借助生物膜聚集在苦草根表,进而更有效发挥其对植物的促生能力。在今后研究中,还可以通过基因工程技术改良菌株产生物膜能力,强化其在自然水体中定殖于水生植物根际的能力,使光合细菌在水生植物生长以及水质净化过程中发挥积极作用。
4 结论
从自然水样中筛选到一株光合细菌RhodopseudomonaspalustrisN1,将其和植物促生菌YJ11接种到苦草和大苦草植物根部,发现接菌处理后2种苦草生长状况显著优于CK,菌株N1能更好地提高苦草根活力、抗氧化酶活性和形成根表生物膜,增强植物抵抗胁迫环境的能力,为微生物促进沉水植物生长以及水质改良提供理论依据和生物资源。
