不同抗旱性小豆根系对干旱-复水的生理生态响应
2023-03-29罗海婧张久刚崔爱民张永清
单 皓,罗海婧,张 松,张久刚,张 虎,崔爱民,薛 超,张永清
(1.山西农业大学小麦研究所,山西 临汾 041000;2.山西师范大学生命科学学院,山西 太原 030000)
水是农作物生长发育过程中必不可少的保障条件。随着全球降雨量的减少,干旱逐渐成为严重影响作物生长发育的自然灾害[1-3]。2018年,我国共有771.18万hm2农作物受旱灾影响,经济损失高达255.3亿元。植物在长期适应干旱环境过程中,产生了御旱性、耐旱性、逃旱性和复水恢复性[4],研究并利用作物的这些特性,对提高旱作区作物的产量具有重要的理论与实际意义。目前,国内外学者已对多种农作物[5-10]抗旱性的生理生态响应进行了多方面研究:Baghel 等[11]研究了大豆在重度水分胁迫下的生理反应,发现叶肉细胞结构和相关功能的损耗会降低植物的净光合速率;刘婷婷等[12]研究认为,复水恢复性对于高粱幼苗的抗旱生长具有更重要的作用,净光合速率和叶片相对含水量在一定程度上能够作为鉴定高粱干旱适应性的指标;李国领等[13]研究表明,众麦1号小麦在受到干旱胁迫后,通过提高相关生理参数,保持光合速率处在较高水平,从而提高产量;徐田军等[14]研究认为玉米的耐旱指数在一定程度上能够反映其对干旱胁迫的敏感程度,且耐旱指数与耐旱性和稳产性呈正相关关系;王兰芬等[15]筛选出可以作为绿豆芽期抗旱鉴定的适宜评价指标,又采用苗期反复干旱法遴选出幼苗存活率、萎蔫指数和株高为绿豆苗期抗旱性评价的适宜指标[16]。前人的研究主要集中在小麦、玉米等大宗作物,有关小豆抗旱及复水方面的研究尚不够深入。
小豆作为山西省重要的小杂粮作物,富含蛋白质、膳食纤维、糖类、维生素及黄酮,不仅具有核黄素、蛋白质和花色苷等丰富的营养成分,同时还是重要的食品和饮料加工原料[17]。吉雯雯等[18]以发芽率、发芽势、发芽指数、相对根长和活力指数5个指标对小豆发芽阶段的抗旱性进行评价和分析。尹宝重等[19]研究表明,干旱胁迫能够显著降低小豆幼苗可溶性蛋白和可溶性糖的积累,促进叶绿素的分解,加速叶片游离脯氨酸和叶片丙二醛的产生,且随着干旱胁迫程度的增加,影响越发明显。张晓红等[20]研究认为小豆受到干旱胁迫后,过氧化氢酶活性、游离脯氨酸含量和可溶性糖含量明显增加,且抗旱能力越强,增幅越明显。
综上可知,前人对于小豆抗旱性的机制及生理生态响应进行了多方面研究,并取得了一定的研究成果[21-23]。但从研究方向和内容上看,对于小豆抗旱性的研究主要集中在小豆幼苗以及叶片的御旱性、耐旱性、逃旱性的生理指标响应,对于小豆根系及复水恢复性的研究较少。因此,本研究以抗旱性不同的3种小豆品种为材料,分析干旱及复水条件下小豆苗期根系的多种生理指标的变化趋势,揭示小豆根系的干旱复水响应规律,为小豆的抗旱育种以及抗旱机制探究等提供参考。
1 材料与方法
1.1 试验材料
供试品种为3个抗旱能力不同的红小豆品种:京农2号、遵化红、B1783(经前期沙培试验筛选,其抗旱性表现为:京农2号>遵化红>B1783),由山西省农业科学院作物科学研究所提供。为了模拟实际生产中因黄土高原小流域治理而出现的“新造地”,供试土壤取自距地表3 m以下的生土,其基础肥力为:全氮0.5 g·kg-1、有机质含量6.4 g·kg-1、速效磷3.0 mg·kg-1、速效钾150.4 mg·kg-1、土壤pH 8.4。
1.2 试验设计
试验在山西师范大学生命科学学院试验基地抗旱棚进行。棚外加遮防虫网和防雨棚,使红小豆整个生育期在自然光下生长,同时消除雨水对试验的影响。选用聚乙烯塑料盆(上部直径31 cm,底部直径23 cm,高28 cm)进行盆栽试验,为了保证试验期间幼苗的养分水平保持一致,每盆装风干土13 kg,同时分别施加尿素0.43 g·kg-1、氯化钾0.275 g·kg-1、过磷酸钙0.7 g·kg-1作为肥底。按照常规的方法适时播种,所有盆土等量浇水以保证种子顺利出苗,待第1片复叶完全展开后,进行干旱胁迫处理。试验按照土壤相对含水量分为5个处理:①充分供水CK(田间持水量的60%~70%);②中度干旱胁迫MS(45%~55%);③重度干旱胁迫SS(30%~40%;)④中度干旱胁迫复水MS-CK(45%~55%复水到60%~70%);⑤重度干旱胁迫复水SS-CK(30%~40%复水到60%~70%)。采用称重法控制土壤水分,每隔1 d 于下午固定时间称重,若下降到设定的水分含量下限时,立即补充水分,共胁迫30 d;胁迫到期后,复水处理组当日复水至CK,复水7 d,其他水分处理不做处理。所有处理均在复水7 d后测定根系形态及生理生化指标,每个水分处理重复3次。所有栽培管理措施中,除水分处理不同外,其他均保持一致,每隔7 d随机调换盆栽摆放位置。
1.3 测定指标与方法
形态指标的测定:主根长用游标卡尺测量;根冠比测定采用105℃杀青,75℃烘干至恒重称重法。
生理指标的测定:根系活力的测定,采用氯化三苯基四氮唑(TTC)法[24];根系超氧化物歧化酶(SOD)活性的测定,采用氮蓝四唑(NBT)光还原法[22];根系过氧化物酶(POD)活性的测定,采用愈创木酚比色法[25];根系过氧化氢酶(CAT)活性的测定,采用紫外吸收法[26];根系丙二醛(MDA)含量的测定,采用硫代巴比妥酸法(TBA)法[27];根系可溶性糖含量的测定,采用蒽酮比色法[27];根系可溶性蛋白质含量的测定,采用考马斯亮蓝G-250染色法[27];根系脯氨酸含量的测定,采用茚三酮显色法[28]。
1.4 数据处理与分析
用Microsoft Excel 2007软件进行试验数据计算(平均值及标准差),用SPSS 17.0软件Duncan新复极差法对各项指标进行方差分析和显著性检验,结果用平均值±标准差表示,用Origin 2018软件作图。
2 结果与分析
2.1 干旱-复水条件对小豆根系形态的影响
由表1可知,干旱胁迫显著抑制了小豆根系的生长发育,但不同品种受抑制程度不同。与充分供水相比较,干旱胁迫下3个品种小豆的根干重、主根长随着胁迫程度的升高而降低,各处理间差异显著(P<0.05);根冠比与胁迫程度的强弱成正比,差异不显著。根干重在MS处理下和SS处理下,与CK相比,京农2号降低了4.55%、8.82%,遵化红降低了5.99%、10.04%,B1783降低了6.35%、10.35%。根冠比在MS处理和SS处理下,与CK相比,京农2号增加了1.99%、2.41%,遵化红和B1783无显著变化。主根长在MS处理和SS处理下,与CK相比,京农2号降低了5.21%、12.15%,遵化红降低了7.00%、14.11%,B1783降低了8.48%、16.53%。可能京红2号对干旱胁迫的调节适应能力较强,有较强的的抗旱性,遵化红次之,B1783最差。
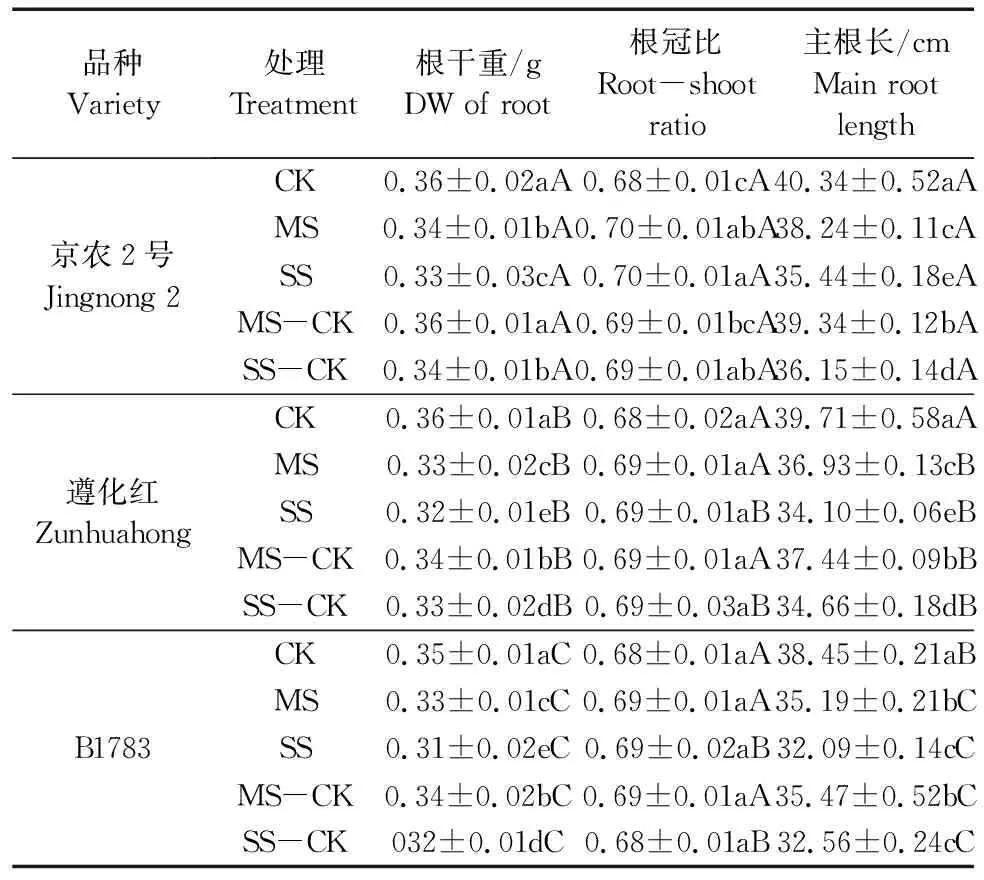
表1 不同抗旱性小豆根系生长对干旱-复水的响应Table 1 Responses of root system in different drought-tolerant adzuki beans to drought-rehydration
复水后3个品种小豆的根干重、主根长低于对照,但都高于相应的干旱处理,MS-CK组的上升幅度明显高于SS-CK组。结果显示,3个品种中,京农2号表现出的复水后补偿效应最大。在MS-CK和SS-CK处理下,京农2号的根干重上升为CK的98.58%、94.51%,主根长上升为CK的97.50%、89.61%。复水后各处理根冠比无显著变化。
2.2 干旱-复水条件对小豆根系生理生化特性的影响
2.2.1 对根系活力的影响 由图1可知,充分供水下,京农2号的根系活力高于遵化红和B178314.47%、25.95%,差异显著(P<0.05)。与充分供水相比,中度和重度胁迫下,3个品种小豆的根系活力随着干旱胁迫程度加重都呈下降趋势,差异显著(P<0.05)。其中京农2号的根系活力降幅最低,分别降低了7.91%和18.83%;遵化红和B1783分别降低了13.81%、34.11%和20.06%、52.30%。复水处理后,3个品种小豆的根系活力低于对照,但都存在不同程度的回升,复水处理后的根系活力MS-CK>MS,SS-CK>SS,差异显著(P<0.05)。其中京农2号的根系活力上升为对照的96.29%、85.93%;遵化红和B1783分别上升为对照的94.04%、74.73%和88.14%、55.87%。3个品种复水恢复能力表现为:京农2号>遵化红>B1783。
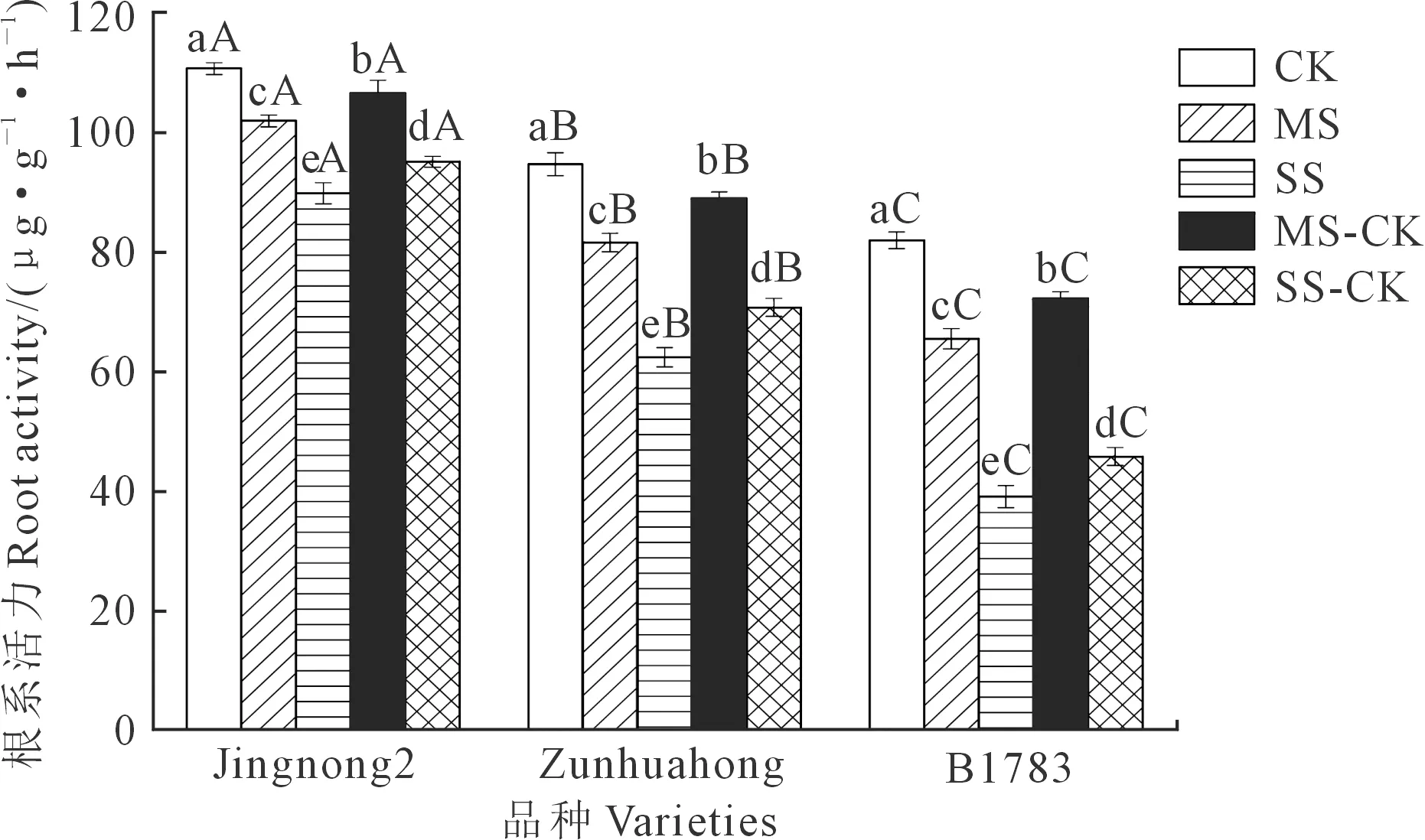
图1 不同抗旱性小豆根系活力对干旱-复水的生理响应Fig.1 Physiological response of different drought-resistant adzuki beans root system vigor to drought-rehydration
2.2.2 对根系抗氧化酶活性的影响 由图2可知,在充分供水条件下,京农2号的SOD、POD和CAT活性显著高于遵化红和B1783。与充分供水相比较,中度和重度干旱胁迫下,3个小豆品种根系的SOD、POD和CAT活性都有不同程度的升高,存在显著差异(P<0.05);京农2号3种酶活性最高,且上升的幅度最大,SOD活性提高了9.27%、15.02%,POD活性提高了57.86%、86.76%,CAT活性提高了26.20%、37.70%。不同品种在同一程度干旱胁迫下,3种酶活性差异显著,且SS>MS>CK。

图2 不同抗旱性小豆根系抗氧化酶活性对干旱-复水的生理响应Fig.2 Physiological responses of antioxidant enzyme activities in root of different drought-resistant adzuki beans to drought-rehydration
复水处理后,3个品种小豆根系SOD、POD和CAT活性高于对照,SS>SS-CK,MS>MS-CK,差异显著(P<0.05)。其中京红2号3种酶活性回降的幅度最大,SOD活性MS-CK比MS降低了4.91%,SS-CK比SS降低了7.52%;POD活性MS-CK比MS降低了36.14%,SS-CK比SS降低了26.61%;
CAT活性MS-CK比MS降低了10.94%,SS-CK比SS降低了4.52%。3个品种抗旱性表现为:京农2号>遵化红>B1783。
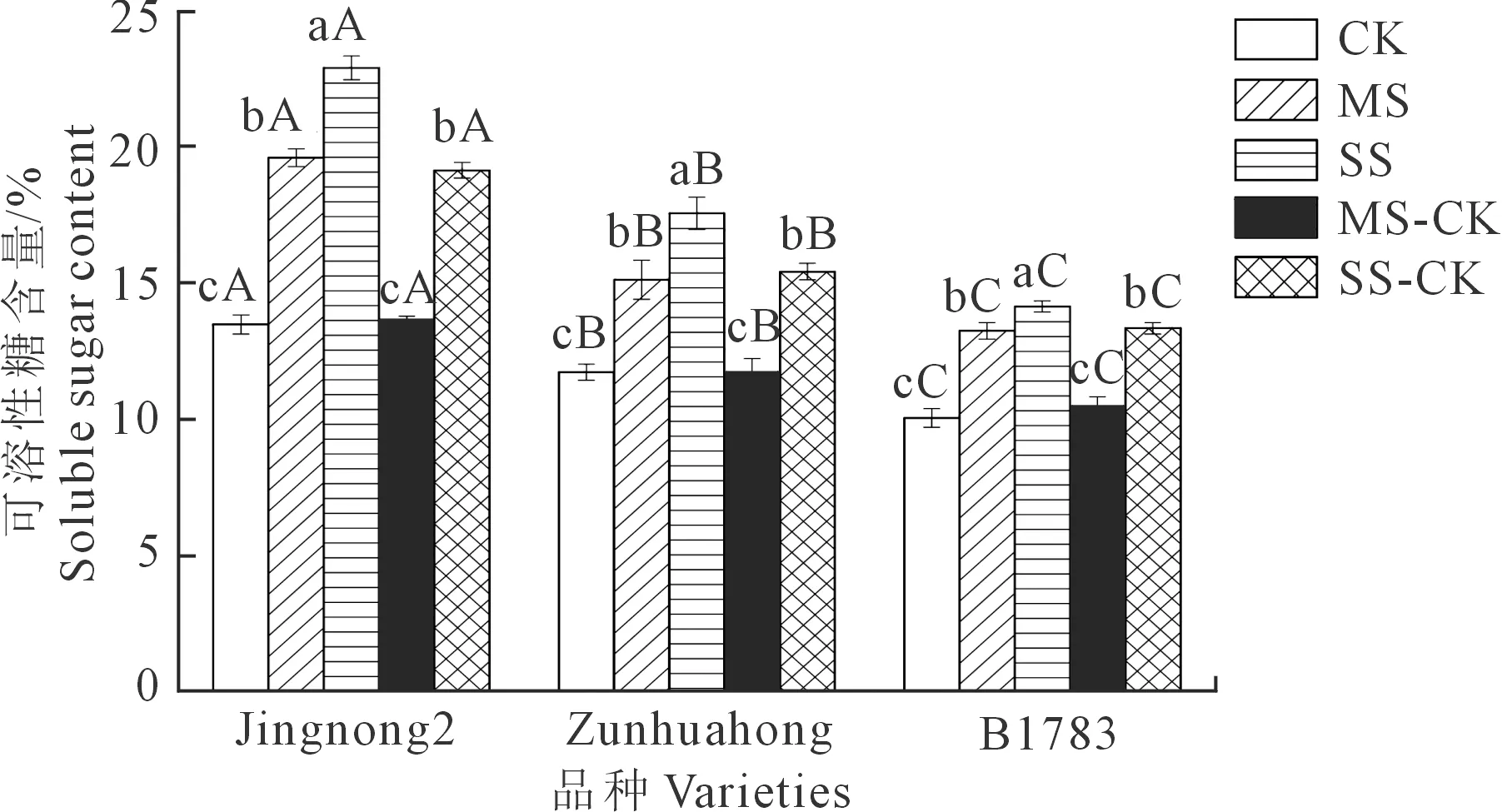
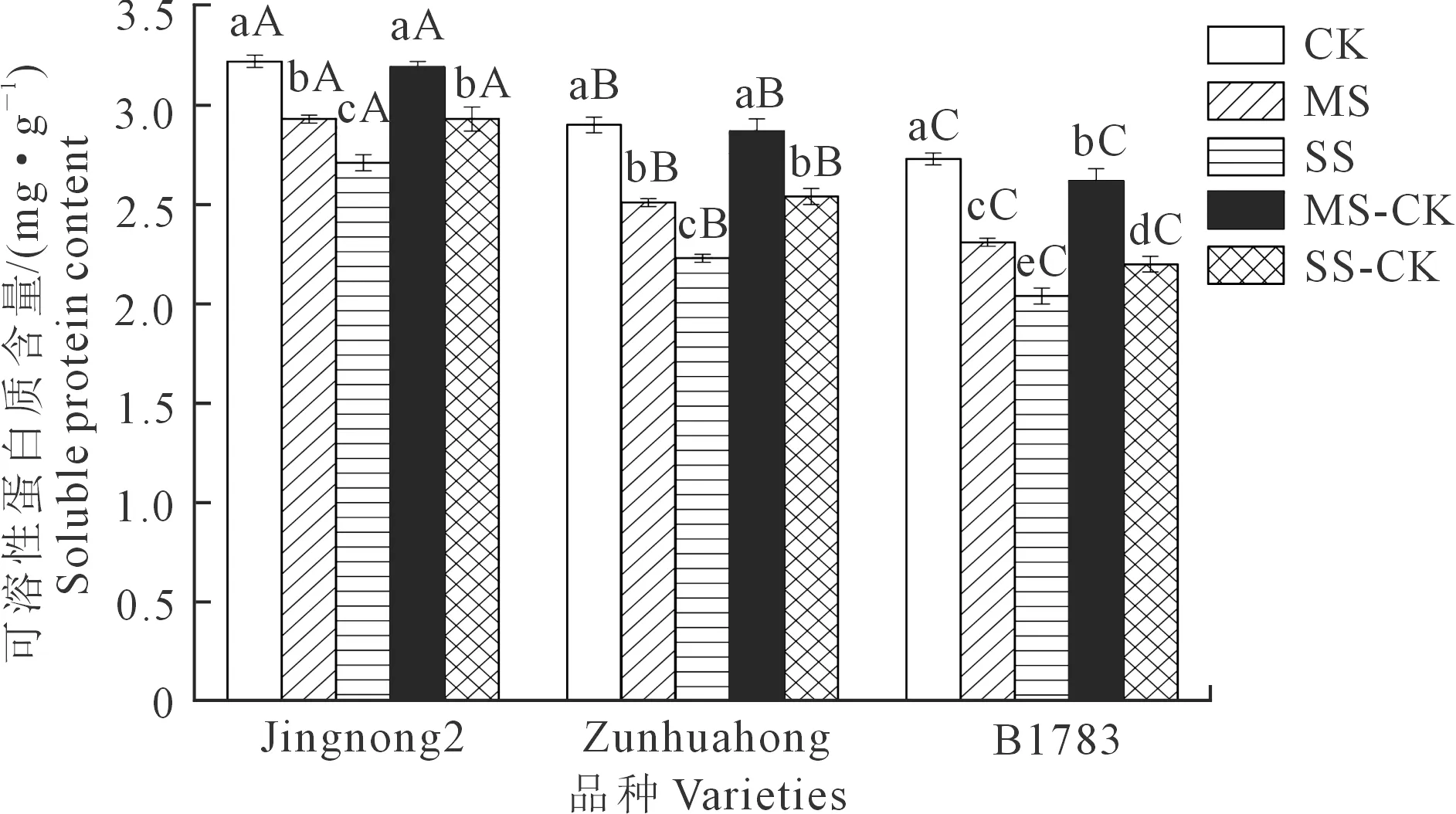
2.2.3 对根系丙二醛(MDA)的影响 由图3可知,3个品种的小豆根系MDA含量与干旱胁迫的强弱成正比。在充分供水条件下,京农2号的根系MDA含量显著低于遵化红和B1783。与CK相比,MS组和SS组3个品种的MDA含量都升高,且SS>MS,差异显著(P<0.05)。在相同条件下,京农2号的MDA积累量相对较少,对干旱胁迫的抵抗力较强。复水处理后,3个品种小豆的根系MDA含量存在不同程度的降低,但仍高于对照组,根系MDA含量表现为:SS>SS-CK>MS>MS-CK>CK。相同处理下的根系MDA含量表现为:京农2号<遵化红 图3 不同抗旱性小豆根系MDA对干旱-复水的生理响应Fig.3 Physiological response of MDA in different drought-resistant adzuki beans root system to drought-rehydration 2.2.4 对根系可溶性糖的影响 由图4可知,与充分供水相比较,中度和重度胁迫下不同抗旱品种根系可溶性糖含量均随着胁迫程度的增加而升高。相同处理下可溶性糖含量表现为:京红2号>遵化红>B1783。复水后,3个品种根系可溶性糖含量仍高于CK组。在MS-CK、SS-CK处理下,3个品种根系可溶性糖含量明显低于MS、SS处理,下降幅度为京农2号>遵化红>B1783。 图4 不同抗旱性小豆根系可溶性糖对干旱-复水的生理响应Fig.4 Physiological response of soluble sugar in different drought-resistant adzuki beans root system to drought-rehydration 2.2.5 对根系可溶性蛋白质的影响 由图5可知,与充分供水相比较,中度和重度胁迫下不同抗旱品种根系可溶性蛋白质含量随着干旱胁迫程度的增强而降低,差异显著(P<0.05),且品种的抗旱性越强,降低量越小。中度干旱胁迫下,3个小豆品种的可溶性蛋白质含量分别较充分供水处理降低了8.89%、13.45%和15.45%。复水后,3个品种小豆的根系可溶性蛋白质含量比CK组低,但较MS、SS组均存在不同程度的升高,且复水处理的根系可溶性蛋白质含量显著高于MS和SS处理。 图5 不同抗旱性小豆根系可溶性蛋白质对干旱-复水的生理响应Fig.5 Physiological response of soluble protein of different drought-resistant adzuki beans root system to drought-rehydration 2.2.6 对根系脯氨酸的影响 由图6可知,与充分供水相比较,中度和重度胁迫下3个抗旱品种根系脯氨酸含量随着干旱胁迫程度的加深而升高,且品种的抗旱性越强,增加量越大。复水处理后,3个品种小豆的根系脯氨酸含量均比CK组高,但较MS、SS组均存在不同程度的下降,且复水处理的根系脯氨酸含量明显低于MS和SS处理。 图6 不同抗旱性小豆根系脯氨酸对干旱-复水的生理响应Fig.6 Physiological response of proline in different drought-resistant adzuki beans root system to drought-rehydration 干旱是影响作物生长和生产的关键环境胁迫因素之一,其导致植物发生多种多样的生理生化以及分子响应等[29]。干旱-复水试验作为作物干旱机制研究的热点内容,已在玉米、大豆、小麦等作物证实了干旱阈值内进行干旱胁迫并及时复水,作物的株高、叶面积和生物量等超过正常灌水水平,即“补偿或超补偿效应”[30]。 根系是作物感受土壤水分亏缺最初的部位,它的生长形态及生理特征会随着水分情况改变,且影响植株地上部生长[31]。根冠比是指植物地下部分与地上部分的鲜重或干重的比值,它的大小反映了植物地下部分与地上部分的相关性,外界生长环境条件对其有一定的影响[32]。根系活力是衡量根吸收能力的主要指标,它在一定程度上反映了植物的生命活动和新陈代谢的强弱[33]。本研究表明,干旱胁迫下3个供试品种小豆的根干重、主根长、根系活力均随着胁迫程度的升高而降低;复水后,干旱胁迫对小豆的根干重、主根长、根系活力影响有所减弱,各指标均呈现增加的趋势。可能是干旱胁迫影响了部分根毛吸收水分和营养的能力,导致根系在一定程度上木质化、弱化。3个品种中京农2号的下降幅度最小,表现出的复水后补偿效应最大,表明京农2号抗旱性最佳。 在遭受干旱胁迫时,作物体内会产生自由基和H2O2等活性氧,而活性氧的累积可直接或间接攻击细胞膜上生物大分子,导致膜损伤,进而造成作物的损伤。MDA是植物细胞膜脂化最重要的产物之一,其大小可反映植物膜系统的受损程度[34]。植物一般通过两种途径来缓解或清除活性氧的危害,一种是通过抗氧化酶系统,即增加SOD、POD和CAT的活性,SOD、POD和CAT协同作用可防御活性氧或其他过氧化物自由基对细胞生物大分子物质的破坏作用,从而使植株免受伤害[35];另一种抗氧化途径是渗透调节,即植株通过产生渗透调节物质来中和或缓解有害物质的损伤[26]。本研究中,随着干旱胁迫的加深,小豆根系MDA含量增加,表明细胞膜的孔隙增大,离子外泄,引起细胞代谢混乱,小豆根系遭受的氧化损伤加剧。此外,小豆根系的SOD、POD和CAT活性明显升高;其中,京农2号的SOD、POD和CAT活性增幅最大,B1783的增幅最小。可能是抗旱性强的小豆品种能够大幅提高抗氧化酶活性,抗旱性弱的小豆品种抗氧化酶活性提升不明显。复水后,根系MDA含量降低,且抗旱能力越强,下降幅度越大,这与张红萍等[36]的研究结果一致。根系SOD、POD和CAT活性都呈现不同程度的下降,京农2号的下降幅度最大,可能是复水后,抗旱性强的小豆品种对水分的响应速度较快,从而迅速调整作物体内的酶活性,类似的结果也呈现在闫江艳等[37]的研究中。 作物在遭受干旱胁迫时能够产生游离脯氨酸、可溶性糖、可溶性蛋白等渗透调节物质,维持细胞生长所需膨压,保证植物细胞的正常代谢活动进行。有研究表明,植物在干旱胁迫下普遍出现游离脯氨酸和可溶性糖大量积累、蛋白质合成受阻的现象[38-39]。在本研究中,3个品种小豆根系可溶性糖含量和脯氨酸含量均随着干旱胁迫程度的加深而增加,可溶性蛋白质含量随着干旱胁迫程度的加深而降低,且各品种间差异显著。京农2号在相同的干旱胁迫下,可溶性糖含量和脯氨酸含量的增加量最大,可溶性蛋白虽然降低,但仍可维持较高水平,这些物质一方面为小豆根系提供能量和物质基础,另一方面和有害物质螯合或中和,降低危害或形成无害物质,从而减少对根系的损伤。此外,京农2号复水后的补偿作用明显高于遵化红、B1783,表明该品种抗旱能力较遵化红、B1783高。本研究表明,抗旱性强的品种可能具有更强的抗氧化修复能力和渗透调节能力,这与韩金龙等[40]的研究结果一致。 干旱胁迫对小豆的根系造成了不同程度的损害,引起了小豆根系活力、根系可溶性蛋白质含量下降,根系SOD活性、POD活性、MDA含量、可溶性糖含量、脯氨酸含量升高。不同抗旱性小豆干旱-复水后的恢复能力存在较大差异,整体表现为抗旱能力越强的小豆品种,干旱-复水后的恢复能力也越强。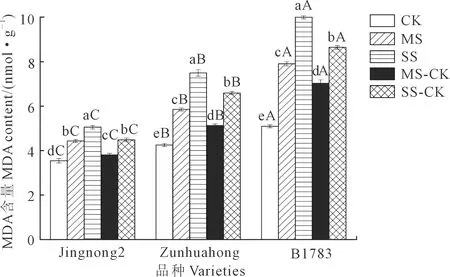

3 讨 论
4 结 论
