超声波清洗技术在硬式腔镜器械清洗消毒中的应用
2023-03-27刘洁
刘洁
武警天津总队执勤第四支队勤务保障大队卫生队(天津 300162)
外科腔镜技术的迅猛发展使微创手术患者获益,其临床应用范围十分广泛。硬式腔镜器械的精密度高,价格相对昂贵,需妥善保管和维护。但同时硬式腔镜器械的结构也较为复杂,其内径细长,咬合齿、轴关节、凹凸槽较多,分泌物或细胞组织易在上述部位残留,明显增加清洗消毒的难度,若清洗消毒不合格,可导致系列交叉感染问题的发生[1-2],进而影响医院的医疗质量。为了延长硬式腔镜器械的使用寿命并控制医源性感染的发生,需尤为重视清洗消毒相关工作。近年来,随着腔镜器械消毒管理工作的不断深入,超声波清洗技术的地位日益突显[3],为提高器械清洗消毒质量和控制医源性感染提供了优化途径。本研究探讨超声波清洗技术在硬式腔镜器械清洗消毒中的应用价值,现报道如下。
1 材料与方法
1.1 一般材料
选取2020 年7 月至2021 年8 月武警天津总队执勤第四支队卫生队回收待清洗的400 件硬式腔镜器械作为研究对象,利用随机数字表法分成对照组和观察组,每组200 件。每组胸腔镜75 件,纵隔镜55 件,止血钳40 件,双极钳30 件。两组硬式腔镜器械的具体种类构成和数量比较,差异均无统计学意义(P>0.05),具有可比性。
纳入标准:临床比较常用的硬式腔镜器械;可拆解且有管腔、齿槽和轴节构造的硬式腔镜器械;已经被使用污染且及时回收待清洗消毒的硬式腔镜器械。排除标准:被特殊污染和明确要求需特殊处理的硬式腔镜器械。
1.2 方法
由同一组器械清洗人员(均熟练掌握《内镜清洗消毒技术操作规范》[4])按照相应的方法进行清洗消毒。
对照组采用手工清洗程序进行清洗消毒:将回收的腔镜器械进行充分拆解,拆解至最小单元后,先用流动水冲洗掉器械表面的污渍残留,对于较难冲洗的部位可选择特制清洁毛刷进行刷洗,尤其是器械的轴节、咬合面和凹凸槽等部位,清洗擦拭时注意避免划伤器械;完成上述清洗操作后,将器械放置于低泡型多酶清洗液(3M-70503 型号多酶清洗液,规格5 L,多酶稀释比为1∶100)中浸泡6~8 min,然后在流动水下用合适型号的管道刷、毛刷对器械再次进行手工刷洗,管腔内壁用高压水枪冲洗,最后依次进行纯化水漂洗、润滑剂润滑、高压气枪吹干水分、80 ℃干燥箱烘干等处理。
观察组在对照组基础上采用超声波清洗技术:手工清洗程序步骤同对照组,完成多酶清洗液浸泡、刷洗的环节后,将器械完全浸泡在超声波清洗机(山东新华医疗,QX 2000 型)内的酶洗槽内,酶洗槽内配有低泡型多酶清洗液(多酶稀释比为1∶100),清洗温度为45 ℃,超声波加酶清洗8 min 后,再依次进行流动水冲洗、纯化水漂洗、润滑剂润滑、高压气枪吹干水分、80 ℃干燥箱烘干等处理。
1.3 观察指标
分别采用5 倍放大镜法、细菌学测试法和三磷酸腺苷(adenosine triphosphate,ATP)生物荧光法对两组的清洗消毒效果进行评价,其中细菌学测试法和ATP 生物荧光法主要针对管腔、咬合齿、凹凸槽等比较难清洗的腔镜器械部位进行检测。(1)5 倍放大镜法:将清洗后的器械充分打开暴露,先用肉眼观察,然后借助5 倍放大镜(3M公司),仔细观察器械把手、轴关节、咬合齿、凹凸槽等部位,无污渍残留判定为合格,若发现任意部位有污渍残留,则判定为不合格。(2)细菌学测试法:将无菌棉拭子在0.9%氯化钠注射液中浸湿,分别对器械管腔、咬合齿、凹凸槽等部位进行仔细擦拭,擦拭完成后置入0.9%氯化钠注射液试管中送检,若未检出致病微生物且细菌总数<5 cfu/cm2则判定为合格。(3)ATP 生物荧光法:用ATP 采样棒分别涂抹腔镜器械管腔、咬合齿、凹凸槽等部位,将海绵头放置于采样器中并折断顶部的塑料圆柱,释放试剂后震荡15 次,放入美国Hygiena PLUS 手持式ATP 荧光检测仪后按“OK”键,15 s 后读取检测结果,ATP 荧光值的相对光单位(relative light unit value,RLU)<45 则判定为合格。
1.4 统计学处理
采用SPSS 19.0 统计软件进行数据分析,计数资料以率表示,采用χ2检验,P<0.05 为差异有统计学意义。
2 结果
2.1 5 倍放大镜法检测结果
5 倍放大镜法检测结果显示,观察组咬合齿、凹凸槽清洗合格率和器械清洗合格率均高于对照组,差异有统计学意义(P<0.05),见表1。
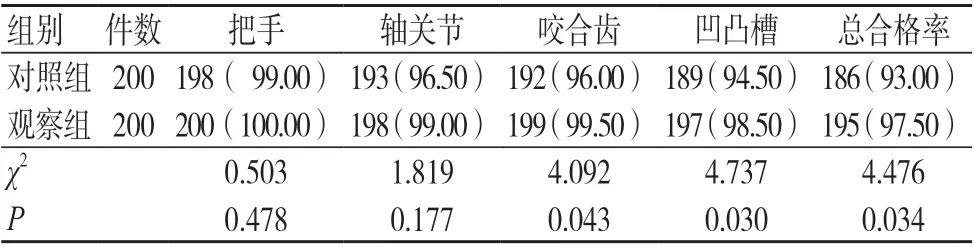
表1 两组5 倍放大镜法检测合格率比较[件(%)]
2.2 细菌学测试法检测结果
细菌学测试法检测结果显示,观察组管腔、咬合齿、凹凸槽清洗合格率和器械清洗合格率均高于对照组,差异有统计学意义(P<0.05),见表2。

表2 两组细菌学测试法检测合格率比较[件(%)]
2.3 ATP 生物荧光法检测结果
ATP 生物荧光法检测结果显示,观察组管腔、咬合齿、凹凸槽清洗合格率和器械清洗合格率均高于对照组,差异有统计学意义(P<0.05),见表3。
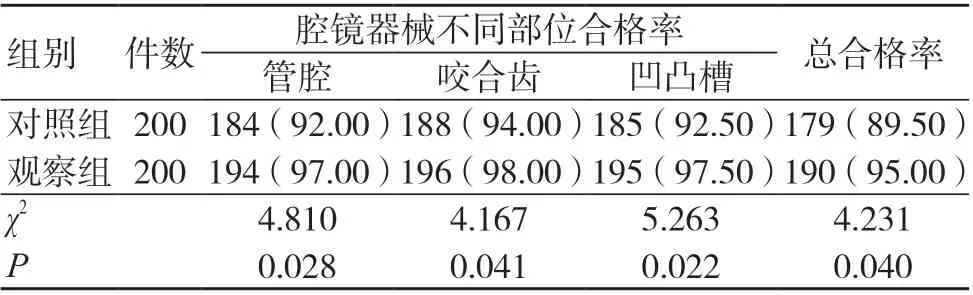
表3 两组ATP 生物荧光法检测合格率比较[件(%)]
3 讨论
内镜器械使用后需及时回收和清洗,若清洗不及时,污染物附着于器械的黏附力会增强,如较细管腔内的血迹清洗不及时可凝固附着于器械内壁上,形成血痂和细菌保护膜,不仅增加清洗消毒难度和医源性感染风险,而且因清洗相对困难,清洗时易损坏器械,缩短器械使用寿命。与普通手术器械相比,硬式腔镜器械的构造更复杂,型号各异,多带有轴关节、细孔、管腔、咬合齿或凹凸槽等结构,一些狭缝、小孔或死角的部位易残留污染物,清洗消毒难度明显更高[5],而提高硬式腔镜器械的清洗消毒质量对预防医源性感染具有重要意义[6]。
规范的手工清洗程序是硬式腔镜器械清洗合格的必要条件,需将器械拆解至最小单元,选择规格合适的清洗工具进行手工清洗,同时借助多酶清洗液帮助消毒灭菌。多酶清洗液具有大量的蛋白酶和活性酶,对黏附在器械上的蛋白质、黏多糖等有较好的清除作用[7]。但从实际工作情况来看,手工清洗质量有待提高。
近年来,超声波技术在医学相关领域的应用进展迅速。超声波技术在医疗器械清洗消毒中的作用原理是,借助超声波发生器产生高频机械振荡循环,超声波在多酶清洗液中传播并产生“空化效应”,一方面能破坏污染物对器械表面的吸附性,另一方面这种“空化效应”还能瞬间产生较大的冲击力,破坏生物保护膜和污染层并使其剥离脱落[8],非常适合清洁管腔、凹凸槽等手工清洗相对困难的器械部位;此外,将多酶清洗液的温度设置为45 ℃,能发挥最大酶活性,和超声波结合使用可使清洗消毒效果更佳[9]。本研究结果显示,采用5 倍放大镜法、细菌学测试法和ATP 生物荧光法检测后,观察组清洗消毒效果均优于对照组(P<0.05),这与张静辉和陈洁霞[10]的研究结果相似,也证实了超声波清洗技术的应用优势。需要注意的是,手工清洗与超声波清洗不可替代,两者结合能更好地提高清洗消毒效果。综上可知,超声波清洗技术应用于硬式腔镜器械清洗消毒中的价值显著,与单纯手工清洗相比,超声波清洗技术与手工清洗的完美结合既明显提高了清洗合格率,也有利于控制医源性感染和减少不必要的医疗意外,为此类器械的安全使用、延长使用寿命提供了保障。
