六价硒在氢化物原子荧光法测定时的转化条件研究
2023-03-25马瑞杰
马瑞杰
(1.国家城市供水水质监测网太原监测站,山西 太原 030009;2.太原水质监测站有限公司,山西 太原 030009)
硒是一种非金属元素,广泛地存在于地壳、生物、土壤、水体中。在自然界中,硒的存在方式有两种:无机硒和生物活性硒。按照化合价分类,硒元素又可分为负二价、正四价、正六价和零价单质硒。硒可被应用在光敏材料、催化剂等领域中,同时硒也是人体必需的微量元素,适量的硒能提高人体免疫力,但常期过量的摄入会对人体产生危害,可能会造成人体中毒、皮肤变色、蛀牙、头发和指甲脱落、指甲畸形等疾病。硒的污染主要来源于硒矿山开采、冶炼、炼油、精炼铜及特种玻璃等行业。一般天然水中主要含有六价和四价硒,在GB5749—2006《生活饮用水卫生标准》中,明确规定了生活饮用水中总硒质量浓度的限值为10μg/L。
氢化物原子荧光法是水中硒、汞、砷等元素检测的主要方法之一,该方法中分析元素能够与可能引干扰的样品基体分离,消除干扰;与溶液直接喷雾进样相比,氢化物原子荧光法能将待测元素充分预富集,进样效率几乎100%,能获得较低的检出限。但是在该方法中,一种元素只有固定的价态才能与还原剂硼氢化钾或硼氢化钠反应,生成该元素的气体氢化物,从而进入原子荧光仪得以被检测,其他的价态必须经过一定前处理反应,转化为可被检测的价态。例如,硒元素,其四价可以直接与硼氢化钾反应,生成气态氢化物SeH4,而六价硒则不与硼氢化钾反应。有些资料及仪器厂商认为,含六价硒的样品在一定量盐酸的作用下,放置反应一定时间,可以将六价硒还原为四价硒,从而能被检测。本文对这一说法进行实验验证,以及对六价硒向四价硒转化条件进行探索研究。
1 方法原理
在盐酸介质中以硼氢化钾或硼氢化钠作为还原剂,将四价硒还原成硒化氢(SeH4)气体,带入原子化器中进行原子化,在硒特制空心阴极灯照射下,基态硒原子被激发至高能态,在去活化回到基态时发射出特征波长的荧光,在一定浓度范围内,其荧光强度与硒含量成正比,通过与标准系列比较即可定量。
2 仪器及试剂
2.1 仪器
AFS-9560 原子荧光光度计,海光;自动进样器,海光;电子天平,精确度0.1 mg;可控温恒温水浴箱;1 mL、10 mL 移液枪;不同规格容量瓶、比色管、量筒、烧杯若干。
2.2 试剂及配置
此实验中试剂均采用优级纯,纯水达到实验室二级,氩气纯度为99.99%。
盐酸溶液(5+95):取30 mL 浓盐酸加入570 mL纯水中,混匀后作为载液使用。
氢氧化钠溶液(1.0 mg/L):称取5.0 g 氢氧化钠溶于400 mL 纯水中,稀释至500 mL。
硼氢化钾溶液(2.0 mg/L):称取10.0 g 硼氢化钾溶于氢氧化钠溶液(2.2.3)中,混匀后作为还原剂使用。
硒(六价)溶液Ⅰ(500 mg/L):称取1.197 5 g 硒酸钠于100 mL 烧杯中,加入适量纯水搅拌溶解,然后移入1 L 容量瓶中,纯水定容至刻线,摇匀待用。
硒(六价)溶液Ⅱ(500 μg/L):用移液枪准确移取1.00 mL 硒(六价)溶液Ⅰ至1L 容量瓶中,纯水定容至刻线,摇匀待用。
硒(四价)标准溶液(100 mg/L),国家标准物质中心购买。
硒(四价)标准使用溶液(1 g/L):用移液枪准确移取10.0 mL 硒(四价)标准溶液至1 L 容量瓶中,纯水定容至刻线,摇匀待用。
3 实验部分
3.1 仪器条件
接通实验室电源,依次启动通风系统、电脑主机、荧光光度计、自动进样器,然后进入软件工作站,等待仪器自检完毕后选择硒元素灯,根据工作经验设定原子荧光仪最佳工作条件。设定参数为:灯电流80 mA;负高压280 V;原子化器高度8 mm;载气流量400 mL/min;屏蔽气流量800 mL/min;进样体积1.5 mL;读数时间12 s;延迟时间2 s;读数方式选择峰面积。仪器参数设置好,将仪器预热30 min 后开始检测。
3.2 制作标准曲线
标准曲线选择0.50、2.00、5.00μg/L 及10.00、16.00、20.00 μg/L 共6 个质量浓度点。该荧光光度计具有自动稀释功能,只需配制最大质量浓度20.00 μg/L的点,即移取5.00 mL 硒(四价)标准使用溶液(2.2.8)至250 mL 容量瓶中,再加入12.5 mL 浓盐酸,用纯水定容至刻线,混匀后放置10 min 使用。
仪器预热完毕后,将氩气打开,调整压力值至0.3 MPa 左右。将盐酸溶液倒入载流槽中,硼氢化钾溶液放在仪器固定位置,开始做仪器空白实验。满足工作条件后,将配置好的20.00 μg/L 的硒(四价)溶液倒入专用试管中,放置在自动进样器指定位置,开始测定。测的标准系列质量浓度及对应荧光值见表1,绘制好的标准曲线见图1。
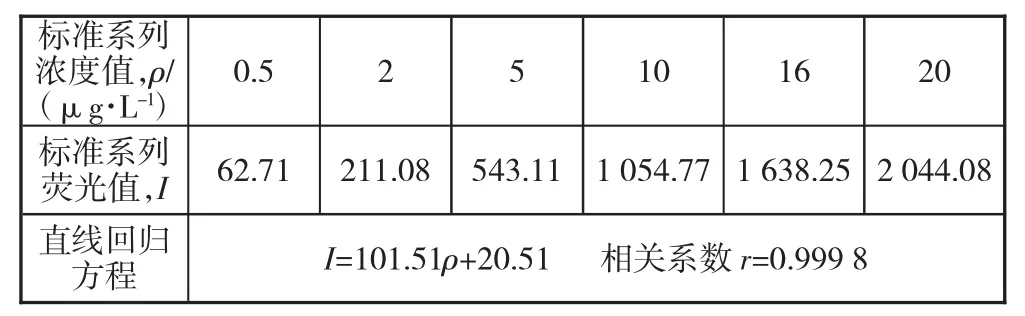
表1 标准系列浓度及相关数值

图1 标准曲线图
3.3 硒(六价)与放置反应时间关系的实验
在实验室常温下,取12 只干净的50 mL 容量瓶分成4 组,每组3 只,然后向每只容量瓶中加入1.0 mL硒(六价)溶液Ⅱ,容量瓶中硒(六价)质量浓度为10 μg/L,再加入5.0 mL 浓盐酸,最后用纯水定容至刻度线并摇匀。第一组放置1 h 后对硒的浓度进行测定,第二组、第三组、第四组分别在放置6、24、48 h 后进行测定,各组样品测定的硒浓度值见表2。该方法中硒的测定下限为0.50 μg/L,对于样品中检测值小于该值的,报出形式为<0.50 μg/L。注:硒(六价)转化率=实验中可检测硒质量浓度÷实验前加入的硒(六价)浓度×100%。
通过表2 的数据分析,在一定的盐酸浓度下,样品放置时间从1 h 增加至48 h,硒的检测值均<0.50 μg/L,硒(六价)转化率均<5%,而更长的放置时间实验在实际的应用不大,因此可以认为,在加入一定质量浓度的盐酸后,样品中的硒(六价)不可能通过增加放置时间,而转化为可被检测的硒(四价)。

表2 硒(六价)与放置反应时间关系的实验数据
3.4 硒(六价)与反应温度关系的实验
实验发现,常温下在较长的放置反应时间后,硒(六价)在一定的盐酸浓度下并不能转化为可检测的硒(四价),考虑到化学反应受反应温度的影响,进行下面的实验。取9 只干净的50 mL 比色管分成3 组,每组3 只,然后然后向每只容量瓶中加入1.0 mL 硒(六价)溶液Ⅱ,硒(六价)质量浓度为10 μg/L,再加入5.0 mL 浓盐酸,最后用纯水定容至刻度线并摇匀。将第一组、第二组、第三组样品分别放置水浴锅中,水浴温度分别为50、75、100 ℃,水浴1 h 后将样品取出冷却至室温,然后将样品分别倒入专用试管中,放在进样盘指定位置,对硒的浓度进行测定,测定结果见表3。
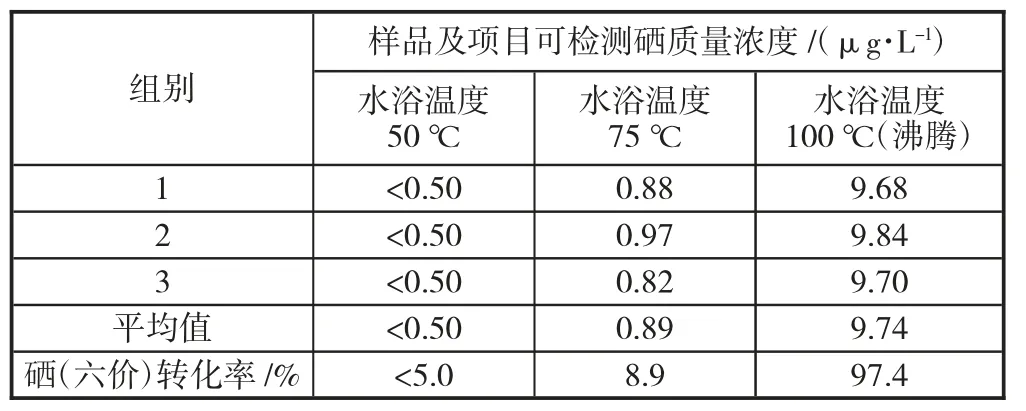
表3 硒(六价)与反应温度关系的实验数据
表3 结果分析可得出,在反应温度100 ℃(沸腾)时,硒(六价)在一定的酸浓度下可以转化为硒(四价),转化率为97.4%,能够满足水质分析要求;在反应温度低于100 ℃(沸腾)时,硒(六价)没有转化为可检测的硒(四价)或转化率较低。
3.5 硒(六价)转化条件优化实验
前面的实验中,样品中盐酸加入量均为10 mL(总体积的20%),为了优化实验条件,下面继续探索硒(六价)转化与盐酸加入量的关系。取15 只干净的50 mL 比色管分成5 组,每组3 只,然后然后向每只比色管中加入1.0 mL 硒(六价)溶液2,硒(六价)质量浓度为10 μg/L,再向5 组比色管中分别加入1 mL(2.0%)、2.5 mL(5.0%)、5 mL(10%)、7.5 mL(15%)、10 mL(20%)浓盐酸,用纯水定容至刻度线,摇匀后放入水浴锅中,水浴温度为100℃,加热1h 将样品取出冷却至室温,然后将样品分别倒入专用试管中,放在进样盘指定位置,对硒的浓度进行测定,测定结果见表4。
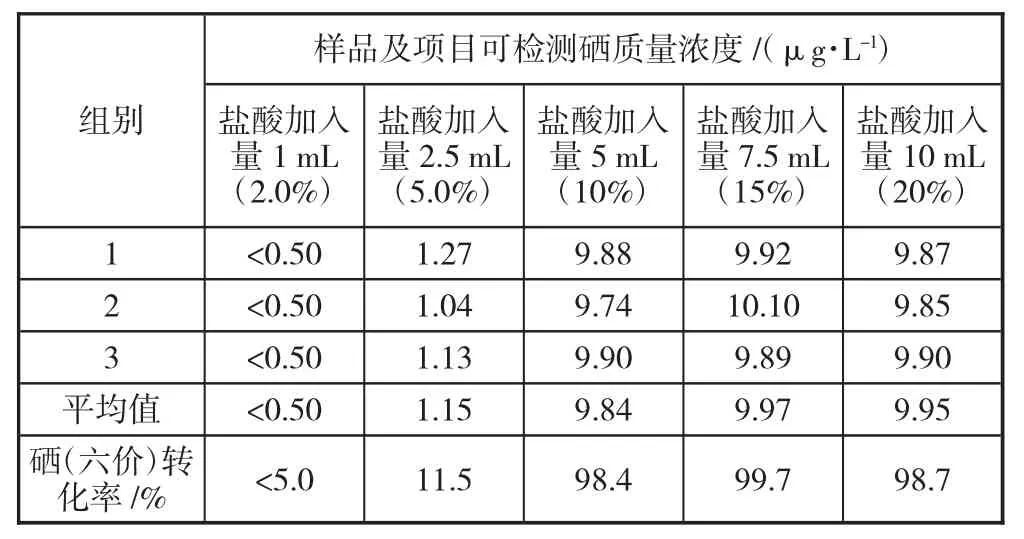
表4 硒(六价)转化条件优化实验
通过表4 结果可以看到,实验中盐酸加入量超过5 mL 后,即样品总体积的10%,硒(六价)的转化率为98.4%、99.7%、98.7%,均能满足水质分析要求,且都比较接近,盐酸加入量的增加,并不能明显提高硒(六价)的转化率。
4 结论
经实验结果证实,在一定的盐酸浓度下,六价硒在常温下放置反应48 h 后不能转化为可直接在氢化物原子荧光法测定的四价硒,但是在合适的反应温度下,水浴100 ℃(沸腾)时,六价硒的转化率为97.4%和98.7%,能够满足水质分析要求。在条件优化实验中,盐酸加入量超过5mL 的3 组实验中(样品总体积50 mL),六价硒的转化率为98.4%、99.7%、98.7%,均可满足分析要求。考虑到降低实验成本,节能降耗,在样品中六价硒质量浓度小于10 μg/L 时,盐酸的加入量可选择样品总体积的5%,可以获得准确的数据结果。
