小黑杨转录因子PsnbHLH162基因在盐和低温胁迫下应答分析
2023-03-23刘森尧贾丰璘樊高锋周博如姜廷波
刘森尧 贾丰璘 国 庆 樊高锋 周博如 姜廷波
(林木遗传育种国家重点实验室,东北林业大学,哈尔滨 150040)
植物在其生命过程中极易受到低温和盐害等非生物胁迫,非生物胁迫极大地影响着植物的分布、生长发育状态和生产力[1]。例如,土壤盐渍化会使种子生命力衰弱,胚芽、胚根等生长受抑,严重时甚至停止萌发。而对植物地上部位造成的影响是,随受盐害时间的增加植物的株高和茎粗的生长都受到严重的抑制;随盐浓度的提升,植物的株高和茎粗的生长也开始变缓慢。持续的低温直接影响了植物的生长发育过程,降低了植物自身的光合作用,抑制了根、茎、叶部的代谢活动,造成植物的产量大幅度下降[2]。
为适应生存环境,植物必须利用自身的生理生化过程来应对非生物胁迫。研究发现,植物遭受到非生物胁迫时,会感知胁迫因素并产生信号传递,做出适应性应答。在这一过程中会有大量的转录因子参与其中。bHLH转录因子作为植物中第二大转录因子家族,被证明参与了植物对非生物胁迫的应答过程。目前,转基因植物相对于野生型植物,对逆境环境有较大的抵抗能力,生存率较高。这一观点,已经得到大量试验验证。在拟南芥(Arabidopsis thaliana)中,SPATULA基因与低温抗性响应相关,过表达此基因可提高植株在低温环境下的存活率[3]。同样,CE1与FAMA、MUTE和SPCH四者彼此作用,且都与干旱、高温抗性响应相关,过表达植株通过控制气孔细胞的开闭和光合作用减少水分的流失[4],直接参与植物应对胁迫的自身调节过程。bHLH92基因与盐胁迫响应相关,过量表达bHLH92可增强它的耐盐性[5]。在84k杨(Populus alba×P.glandulosa‘84k’)中,PtrUNE12与盐胁迫响应相关,在过表达转基因植株中,PtrUNE12可以通过调控杨树活性氧代谢来提高耐盐能力[6]。在转基因落叶松(Larix olgensis)中,LobHLH34与盐和干旱抗性响应相关,发现转基因植株的耐盐性和抗旱性得到稳定提高[7]。在露地菊(Chrysanthemum×grandiflora)中,Cgb-HLH113基因与盐胁迫响应相关,过表达植株的耐盐 性 得 到 增 强[8]。在 甜 橙(Citrus sinensis)中,bHLH18基因与低温抗性响应相关,过表达植株可调控抗氧化酶基因的表达,从而增强其抗寒能力[9]。在核桃(Juglans regia)中,JrICE1基因同样与低温抗性响应相关,在过表达植株中,抵抗低温的能力也得到了提高[10]。这些都为证实bHLH转录因子参与植物响应非生物胁迫过程提供了有效依据,也为进一步探索在盐胁迫或低温胁迫条件下,PsnbHLH162基因在小黑杨(Populus simonii×P.nigra)体内的作用机理提供了参考。
小黑杨是具有较强的抗旱、抗寒、抗盐碱能力的本土树种,它生长速度快、易遗传转化的特性,使其成为研究木本植物非生物胁迫的模式植物[11]。但在盐碱地中,小黑杨的生长和产量受到抑制,不能够获取较大的经济价值。因此需要获取优良的抗逆树种,使小黑杨能够在盐碱地中正常生长,同时改善土壤环境,获取更高的经济价值和生态价值收益。本试验通过获取小黑杨Psnb-HLH162基因,对其在盐、低温胁迫下的基因应答模式进行统计分析,以期为揭示基因在小黑杨应答非生物胁迫的调控网络提供理论依据,为培养优良的抗逆新品种提供支持。
1 材料与方法
1.1 试验材料
1.1.1 植物材料
长势良好的2 个月小黑杨组培苗、3 个月本氏烟草(Nicotiana benthamiana)土培苗,均来自于林木遗传育种国家重点实验室保存。
1.1.2 菌株和载体
植物过表达载体pBI121-GFP,酵母表达载体pGBKT7,酵母阳性对照质粒pGBKT7-53,酵母菌株Y2HGold,农杆菌株(Agrobacterium tumefaciens)GV3101 均为林木遗传育种国家重点实验室保存。大肠杆菌(Escherichia coli)TOP10 感受态细胞、pMD19-T载体购自TaKaRa公司。
1.2 试验方法
1.2.1 杨树PsnbHLH162基因的克隆
从Phytozome(https://phytozome.jgi.doe.gov/pz/portal.html)下载了毛果杨(P.trichocarpa)的基因组序列,从中获得了毛果杨转录因子基因(Potri.015G074500)的ORF 序列,以此分别设计长度 为22 bp 的PsnbHLH162 F1和23 bp 的Psnb-HLH162 R12 条引物。选取长势优良的小黑杨组培苗,采集新鲜的50 mg 叶片,通过CTAB 法直接获取小黑杨的RNA,以其为模板进行反转录获得cDNA,以小黑杨cDNA为模板,预变性94 ℃,4 min;变性94 ℃,30 s,退火54 ℃,30 s;延伸72 ℃,45 s,33轮循环;再延伸72 ℃,10 min的PCR反应程序扩增片段长度537 bp的PsnbHLH162基因(见表1)。

表1 本研究所用的引物Table 1 Primer sequences used in this study
1.2.2 杨树PsnbHLH162基因的生物信息学分析
克隆出长度537 bp 的PsnbHLH162基因,通过琼脂凝胶电泳,回收胶中目的DNA,进行测序。找到NCBI数据库(https://blast.ncbi.nlm.nih.gov/Blast.cgi)将测序后正确序列与毛果杨(Potri.015G07450 0)的ORF区进行序列比对。之后进行生物信息学分析,ExPASy(https://web.expasy.org/protparam/)直接分析PsnbHLH162 蛋白的理化性质。在TMpred中对PsnbHLH162 蛋白进行跨膜域分析;使用EXPLASy Proteomics tools 中SOPMA 软件分析Psnb-HLH162 蛋白的二级结构;采用SWISS-MODEL 对PsnbHLH162蛋白进行三级结构预测。
采用NCBI-ORF Finder(http://www.ncbi.nlm.nih.gov/gorf/gorf.html)和ProtParam 软 件 对Psnb-HLH162基因进行序列分析;找到同源性高的,再利用Bioedit 对PsnbHLH162 蛋白进行多序列比对;最后用MEGA 7软件对与此蛋白同源性较高的植物构建系统发育进化树。
1.2.3 构建植物表达载体PBI121-PsnbHLH162-GFP和亚细胞定位
通过同源重组构建植物表达载体,设计长度为27 bp 的PsnbHLH162 F2和PsnbHLH162 R22 条引物,以回收后的PsnbHLH162基因为模板,通过PCR 反应大量获取PsnbHLH162基因,然后用1%琼脂糖凝胶电泳并在紫外灯下检测,回收胶中目的DNA。用SalⅠ酶将PBI121-GFP 质粒酶切线性化后,再次通过琼脂凝胶电泳,回收胶中目的DNA。之后把1 μL PBI121-GFP 酶切产物、4 μLPsnbHLH162基因回收产物和5 μL Infusion 酶,置于50 ℃金属浴内连接30 min,然后冰浴5 min,最后将连接产物转入TOP10 感受态大肠杆菌。从PBI121-GFP 载体上设计2 条通用引物pBI121F 和pBI121R,通过PCR 扩增检测单克隆菌落,将正确的菌落扩大培养,次日提取PBI121-PsnbHLH162-GFP 质 粒。最 后 再 将PBI121-PsnbHLH162-GFP 转入农杆菌感受态(GV3101),通过PCR 反应检测单克隆菌落,条带正确的菌落扩大培养。
通过烟草注射法[12]将阳性对照含PBI121-GFP质粒和融合表达蛋白PBI121-PsnbHLH162-GFP 的农杆菌分别侵染进入烟草表皮,黑暗场所下培养48 h,并在激光共聚焦显微镜下观测蛋白在烟草细胞中的定位。
1.2.4 PsnbHLH162蛋白转录激活活性分析
根据PsnbHLH162基因的ORF 区设计引物,引入NdeⅠ和NcoⅠ酶切位点,引物设计为Psnb-HLH162 BDF和PsnbHLH162 BDR,以PsnbHLH 162基因为模板进行PCR 扩增反应,之后通过琼脂凝胶电泳,回收胶中目的DNA。将pGBKT7 载体和胶回收产物双酶切,并使用T4 连接酶构建载体,最后转化进大肠杆菌中,进行蓝白斑筛选。1 d后,将白色单菌落使用pGBKT7载体通用引物BD F和BD R进行检测并送测序,获得pGBKT7-Psnb-HLH162重组质粒。
内含pGBKT7空载质粒的酵母为阴性对照,内含pGBKT7-53 的酵母菌株为阳性对照。分别将pGBKT7-PsnbHLH162重 组 质 粒、pGBKT7 空 载 质粒、pGBKT7-53 转入Y2HGold 酵母细胞中,通过PCR 进行检测后用接种环分别蘸取3 种酵母菌液在SD-Trp、SD/-Trp/-His/X-α-Gal 缺陷培养基上点点,30 ℃倒置培养3 d 左右,观察菌落生长状态与能否变蓝来检验PsnbHLH162 蛋白是否具有转录激活活性。
1.2.5 盐胁迫和低温胁迫下PsnbHLH162基因表达的qRT-RCR
为探究PsnbHLH162基因在盐胁迫和4 ℃低温胁迫下基因在各组织的相对表达量,挑选组织培养1 个月且健康的小黑杨,在霍氏营养液中水培30 d,分成2 个大组,分别用盐、低温进行胁迫,其中NaCl 胁迫配置150 mmol·L-1NaCl 溶液,按时间点进行浇灌处理;低温胁迫在气候模拟箱内,设置温度为4 ℃,进行处理。在上述处理0、3、6、12、24、48 h 后,对叶、茎、根的组织进行取样。苗木培育条件为14 h/10 h 光暗循环,24 ℃,相对湿度60%,所有胁迫处理包含5 个时间点,每个时间点都内含有3个生物学重复。
分别采集叶、茎、根组织后,提取RNA,反转录成cDNA 后进行qRT-RCR(荧光定量PCR)。根据定量引物设计原则,设计长度为21 bp 的Psnb-HLH162F3和22 bpPsnbHLH162R3 2条引物,进行qRT-RCR,以内参基因ACT为对照,程序设定为95.0 ℃ 30 s,95.0 ℃ 5 s,60.0 ℃,34 s,95.0 ℃ 15 s,60.0 ℃ 1 min,95.0 ℃ 15 s,置于定量PCR仪(ABI7500)中。最后用2-ΔΔCt法计算出PsnbHLH162基因相对表达量。
1.2.6 PsnbHLH162基因启动子的克隆和分析
用小黑杨基因组DNA 作为模板,根据Phytozome 中获取的毛果杨同源基因Potri.015G07450-0.1编码区上游大约2 000 bp 的序列设计引物QDbHLH162 F与QDbHLH162 R并进行PCR 扩增,琼脂凝胶电泳检测后将大小正确的DNA 片段回收,之后与pMD19-T载体连接,转入大肠杆菌后送生物公司进行测序。
将PsnbHLH162基因启动子序列导入Plant-CARE数据库中,分析顺式作用元件。
2 结果
2.1 PsnbHLH162基因的克隆与生物信息学分析
通过克隆小黑杨cDNA 获取长度为537 bp 的PsnbHLH162基因,通过NCBI 程序进行序列比对,观察到与毛果杨转录因子基因(Potri.015G074500)的ORF序列同源比对率达99.07%。
对PsnbHLH162基因生物信息学分析可知,PsnbHLH162 蛋白含186 个氨基酸,其氨基酸分子质量为20 354.68,分子式为C891H1477N255O267S10,理论等电点(pI)为9.51,是稳定的亲水性蛋白(见图1:A,C),不稳定指数(Ⅱ)是36.96(Ⅱ数值>40 为不稳定,Ⅱ数值<40 为稳定),总平均亲水性(GRAVY)是-0.275(当GRAVY>0 为疏水性蛋白,GRAVY<0 为亲水性蛋白),脂肪系数(AI)是91.85。TMHMM Serverv.2.0 分析PsnbHLH162 蛋白是不含跨膜区域的非跨膜蛋白(见图1B)。蛋白序列二级结构预测表明:该蛋白有51.69%的α螺旋含96 个氨基酸、11.24%延伸链含21 个氨基酸、1.69%的β转角含3 个氨基酸和35.39%的不规则螺旋含66个氨基酸(见图2A)。三级结构预测结果如图所示(见图2B)。

图1 PsnbHLH162 蛋白信号肽、跨膜结构域及亲疏水性的预测A.PsnbHLH162 蛋白信号肽预测;B.PsnbHLH162 蛋白跨膜结构预测和分析;C.PsnbHLH162蛋白氨基酸亲疏水性区域分布Fig.1 PsnbHLH162 protein signal domain,trans-membrane domain and prophecy A.Prediction of protein signal peptide of PsnbHLH162;B.Prediction and analysis of transsmembrane structure of PsnbHLH162 protein;C.Distribution map of the amino acid hydrophobicity region of Psnb-HLH162 protein

图2 PsnbHLH162蛋白二级(A)和三级结构(B)预测Fig.2 PsnbHLH162 protein secondary(A)and tertiary structure(B)measurement
系统进化树和同源序列比对同时显示小黑杨PsnbHLH162 蛋白在第17 到69 个氨基酸之间内含1个HLH保守结构域(见图3),由52个氨基酸组成此结构。将小黑杨PsnbHLH162 氨基酸序列与相同基因的10 个其他植物的氨基酸序列进行比对,结果表明与毛果杨(XP_002318646.1)、毛白杨(XP_034918711.1)高度同源。同源比对率分别为98.31%、95.51%(见图4)。根据以上的比对结果,对这11个物种的bHLH162蛋白构建系统发育树。系统发育进化树说明了小黑杨与毛果杨、毛白杨之间遗传距离近,亲缘关系近;而与拟南芥、烟草、玉米(Zea mays)等遗传距离较远,亲缘关系较远(见图5)。
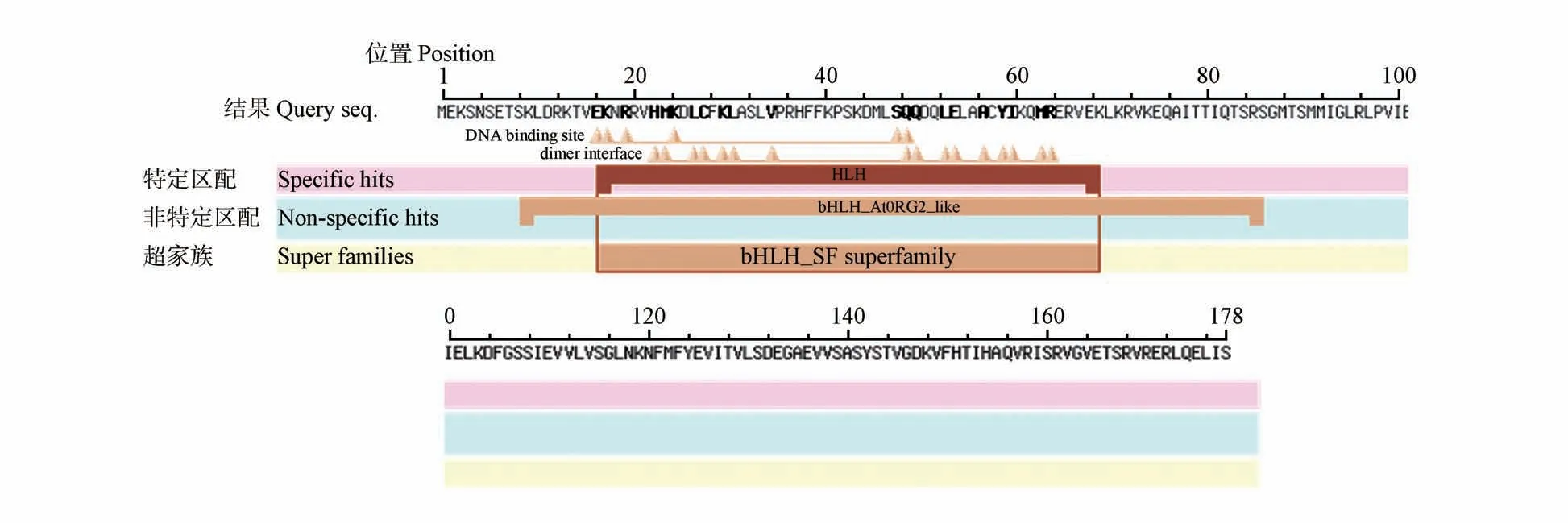
图3 PsnbHLH162蛋白保守结构域Fig.3 PsnbHLH162 protein conserved domain

图4 PsnbHLH162同源序列比对Fig.4 Homologous sequence alignment of PsnbHLH162

图5 PsnbHLH162系统进化树Fig.5 Phylogenetic Tree of PsnbHLH162
2.2 小黑杨PsnbHLH162蛋白的亚细胞定位
在激光共聚焦显微镜内观察到的绿色荧光蛋白如图6 显示:阳性对照PBI121-GFP 质粒在细胞内的细胞核、细胞膜上全部表达,呈现出绿色荧光。PBI121-PsnbHLH162-GFP 质粒仅在细胞核内发出绿色荧光,直接证明PsnbHLH162蛋白是在烟草细胞核内表达。
2.3 PsnbHLH162蛋白转录激活活性分析
为验证小黑杨PsnbHLH162 蛋白是否具有转录激活活性,将含有pGBKT7 空载质粒,pGBKT7-PsnbHLH162质粒,阳性对照质粒pGBKT7-53 的Y2HGold 酵母菌株分别在SD/-Trp 和SD/-Trp/-His/X-α-Gal 2种固体培养基上培养菌株,3 d后取出观察平板内酵母菌的生长状态。由图7 可知,3 种酵母菌都可在SD/-Trp 固体培养基上正常生长,但在SD/-Trp/-His/X-α-Gal 二缺固体培养基上生长的是pGBKT7-53 质粒的酵母菌,并且酵母呈现出蓝色,其余2 种都无法生长。有效地证明了Psnb-HLH162蛋白无转录激活活性。

图7 PsnbHLH162的转录激活活性检测Fig.7 Detection of transcriptional activation of PsnbHLH162
2.4 小黑杨转录因子PsnbHLH162基因的时空表达
利用qRT-PCR 技术对PsnbHLH162基因在盐、低温2 种胁迫条件下的时空表达模式进行分析。以0 h 时该基因表达量为参照,分析2 种胁迫条件下各组织在5个时间点该基因的相对表达量。
结果显示,在NaCl溶液处理后,试验组与对照组比对,发现PsnbHLH162基因的相对于0 h 的相对表达量存在差异,在叶、根组织中先升高后降低,总体呈现出上调趋势。在叶中表达量0~24 h上升,24~48 h 下降,其中胁迫处理24 h 后到达顶峰,表达量为0 h的7.510倍。在根中表达量0~12 h上升,12~48 h 下降,在胁迫处理12 h 后到达顶峰,表达量为0 h 的51.405 倍。基因在茎组织中的表达量0~6 h 先升高,6~24 h 降低,24~48 h 再升高,呈现出上调趋势,在处理48 h 后到达顶峰,表达量为0 h 的8.707 倍。与叶茎两组织相比,基因在根中上升趋势最为显著,证实此基因主要在根中应答(见图8)。

图8 小黑杨PsnbHLH162基因盐胁迫处理下不同时间在叶、茎、根的相对表达量变化*代表与0 h数据具有显著性差异,P<0.05;下同Fig.8 Changes in the relative expression of PsnHLH162in leaves,stems and roots under salt stress at different times* represents a significant difference from the 0h data,P<0.05;the same as below
在气候模拟箱中4 ℃处理后结果表明:相对于0 h 的表达量,PsnbHLH162基因在叶、茎两组织中的相对表达量先上升后下降,总体呈现出上调趋势。在叶中表达量0~24 h 上升,24~48 h 下降,在胁迫处理24 h 后到达顶峰,表达量为0 h 的6.592倍。在茎组织中表达量0~12 h上升,12~24 h下降,在处理12 h 后到达顶峰,表达量为0 h 的736.548 倍。在根中表达量0~3 h 上升,3~6 h 下降,6~48 h 再次上升,表达量在处理24 h 后到达顶峰,为0 h 的16.861 倍。与叶相比,该基因在茎和根中表达差异显著,但最高的还是在茎组织中(图9)。

图9 小黑杨 PsnbHLH162基因4 ℃低温处理下不同时间叶、茎、根的相对表达量变化Fig.9 Changes in the relative expression of PsnHLH 162in leaves,stems and roots under 4 ℃ at different times
以上结果证实:PsnbHLH162基因对高盐、低温胁迫具有明显的适应性应答反应。此基因表达量水平具有组织特异性,具体表现为NaCl胁迫下,基因在根组织中表达量最高,而在低温条件下,反而茎组织中表达量最高。
2.5 PsnbHLH162基因启动子的克隆和分析
使用PlantCARE 对PsnbHLH162基因的启动子序列中的顺式作用元件进行分析。结果表明该启动子内含许多核心启动子元件和激素应答元件(见表2),包括脱落酸应答元件ABRE、生长素应答元件TGA-element。此外,还发现了许多光应答元件(GTGGC-motif、chs-CMA2a、TCT-motif)和一些参与昼夜节律控制、参与盐、低温、干旱诱导反应的元件,表明PsnbHLH162基因有可能在小黑杨的生长发育和感受昼夜变化的生理过程也发挥重要作用。
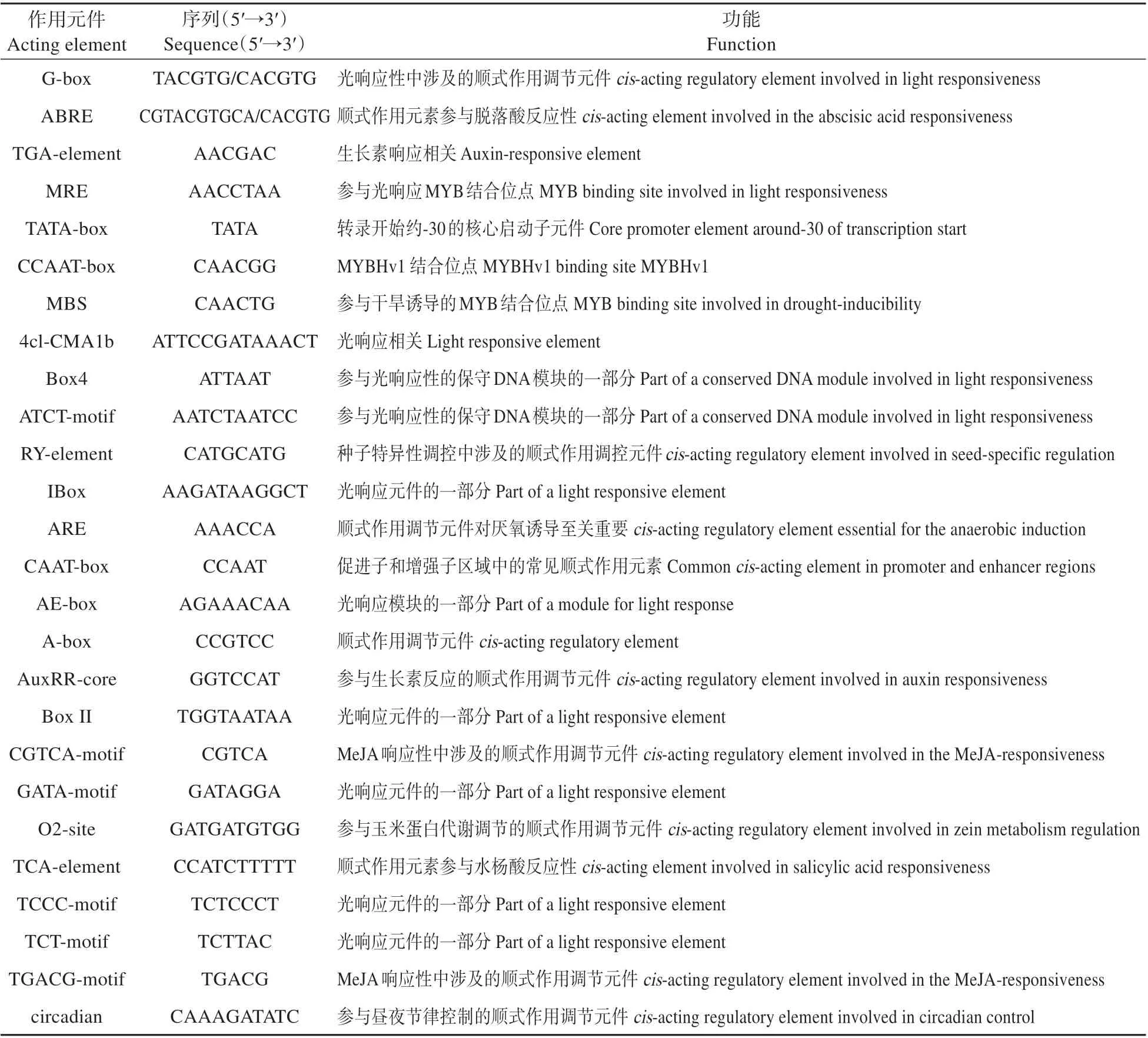
表2 PsnbHLH162基因启动子上的顺式作用元件分析Table2 Analysis of the cis-acting elements on the promoter of PsnbHLH162
3 讨论与结论
本研究从小黑杨中扩增出长度为537 bp的Psnb-HLH162转录因子,该基因蛋白共编码186 个氨基酸。通过对PsnbHLH162的氨基酸序列进行保守结构域的预测得知N端具有高度保守的HLH结构域,蛋白是非跨膜蛋白。其二级结构预测表明是含11.24%延伸链、1.69%的β转角、35.39%的不规则螺旋、51.69%的α螺旋。亚细胞定位结果证明PsnbHLH162 蛋白的亚细胞定位情况,结果表明该蛋白为核定位蛋白,基因是在细胞核内表达。
在酵母细胞中对PsnbHLH162 蛋白的转录激活活性进行验证,该蛋白在酵母细胞中无转录激活活性。与SPL基因[13](为bHLH 转录因子)相同,其在细胞中也无转录激活活性。现已证明SPL基因被上游基因转录激活,之后开始进行转录翻译。相反,PagUNE12[14]具有转录激活活性,能够自我激活转录,不需要与其他基因相互作用再进行转录。PagUNE12与PsnbHLH162不同。因此推测PsnbHLH162可能是与其他基因相互作用,使其发生转录,进而进行调控植物生理过程。
目前,bHLH 转录因子参与植物对逆境响应相关研究也越来越多地被报道,如在水稻(Oryza sativa)中OsbHLH1[15]参与了抗低温胁迫应答,在拟南芥(Arabidopsis thaliana)中,AtbHLH122[16]的过表达可增加耐盐性、渗透调节能力和脯氨酸浓度,在黄瓜(Cucumis sativus)中,CsbHLH041[17]赋予了黄瓜幼苗耐盐性。但bHLH 转录因子在杨树内研究相对较少,盐和低温胁迫下的研究报道更少。在本研究中,对生长状态相同的小黑杨进行5个时间点的盐胁迫处理和4 ℃低温胁迫处理,通过RT-qPCR结果表明,在盐胁迫处理后,PsnbHLH162基因相比于0 h 在叶、茎、根3 个组织中表达量显著上调,叶在处理24 h 后到达顶峰,表达量为7.510 倍;茎在处理48 h 后到达顶峰,表达量为8.707 倍;根在处理12 h后到达顶峰,表达量为51.405倍。经4 ℃低温胁迫后结果表明:PsnbHLH 162基因相比于0 h 在叶、茎、根3 个组织中的表达存在差异,总体呈现出上调趋势,叶在处理24 h 后到达顶峰,为对照组6.592 倍;茎在处理12 h 后到达顶峰,为对照组736.548 倍;根在处理24 h 后到达顶峰,为对照组16.861 倍。以上结果证明PsnbHLH162基因参与了小黑杨对盐和低温的应答过程,隶属于逆境胁迫调控因子。
通 过PsnbHLH162与PsnNAC030[18]基 因 的 应答模式进行对比,小黑杨在高盐、低温4 ℃胁迫下,相比于0 h,PsnbHLH162基因在各部位的表达量也在增长。但是在4 ℃低温胁迫下,PsnbHLH162茎部的相对表达量超高,多达736.548 倍,但Psn-NAC030也有245.687 倍表达量,它们具有相似的结果;而盐胁迫下PsnbHLH162在茎部相对表达量有8.707 倍,PsnNAC030有7.43 倍,两者都响应盐胁迫,这暗示了在2 种非生物胁迫下PsnbHLH162与PsnNAC030在小黑杨体内响应调控机制一样。同时也说明在低温条件下,茎组织中PsnbHLH162的响应调控机制可能与在叶、根部有明显不同。但还需要在获取转基因过表达株系后,进一步探索是否为不同的应答调控方式。在根部中,相比于0 h 两种胁迫后基因表达量皆高,分别达到51.405倍、16.861倍,这也证实在胁迫后,根部也是其主要的应答部位,不仅仅只在茎组织中主要应答。
对PsnbHLH162基因启动子进行预测分析后发现,具有13 个MYB 和3 个MYC 特异结合位点,而在拟南芥中,已经发现bHLH 和MYB 相关转录因子AtMYC2和AtMYB2分别与MYC 和MYB 识别位点特异性相互作用,在体外激活拟南芥原生质体中MYC 和MYB 识别位点驱动的β-葡萄糖醛酸酶报告基因的转录[19]。这从侧面证明了PsnbHLH162基因本身不具有转录激活能力,需要其他基因与PsnbHLH162启动子相互作用,来激活PsnbHLH162基因进而调控植物生理过程。在拟南芥中,过表达OsMYB3R-2,转基因植株对寒冷、干旱和盐胁迫的耐受性明显增加,转基因种子萌发对脱落酸(ABA)或NaCl的耐受性也高于野生型[20]。拟南芥过表达AtMYB44的非生物胁迫的耐受性明显提高[21-22]。过表达StMYB1R-1在马铃薯(Solanum tuberosum)中通过增强AtHB-7、RD28、ALDH22al和ERD1等干旱调控基因的表达,减少植物的水分流失,提高了抗旱性[23]。这些转基因植株都证实了MYB家族多数基因都参与植物非生物胁迫的应答过程,之后可通过酵母单杂交试验来寻找Psnb-HLH162上游的MYB 和bHLH 家族的调控基因,揭示它们彼此之间的作用关系,是否为组合控制[24]。启动子区域内还发现了大量的光响应元件和1 个circadian 元件,推测基因与植物生长发育和感知昼夜节律变化有关联[25]。已知植物激素脱落酸介导各种生理过程,包括对干旱、低温和盐胁迫的反应。在启动子区域中发现3 个ABRE 序列和2 个MBS 序列,这证实PsnbHLH162参与盐和低温胁迫响应,同样参与干旱胁迫的应答过程,之后可获取转基因苗木后做进一步干旱胁迫验证。
以上研究说明PsnbHLH162基因在应对盐、低温胁迫过程中起到重要作用,参与整个植物个体的调控网络。但整个应答的过程是复杂的,需要进一步的探索转录因子协调不同应答信号转导途径的作用机理。为未来揭示PsnbHLH162基因在盐、低温胁迫响应过程中的所扮演的角色提供参考,也为培育出小黑杨耐盐、耐低温新品种奠定基础。
