香芹酚对鲁氏接合酵母的抗菌活性及其机制
2023-03-23王虎玄彭中花朱亚南孙宏民
王虎玄,彭中花,王 聪,朱亚南,孙宏民
(陕西科技大学食品科学与工程学院 西安 710021)
鲁氏接合酵母(Zygosaccharomyces rouxii)是一种常见的食品腐败酵母,具有嗜糖、耐酸等生理特性,可引起浓缩水果汁、蜂蜜、果酱等腐败变质[1]。团队前期从浓缩苹果汁(70°Brix,pH 3.5)和浓缩海红果汁(68°Brix,pH 3.4)中均分离出鲁氏接合酵母,并证实该菌能够在两种浓缩汁中生长,可见其污染能力极强,危害较大[2-3]。鲁氏接合酵母污染,不仅改变食品外观,影响风味,降低营养价值,而且能代谢食品中糖分产气,造成食品胀包。尤其是玻璃、金属等密封包装,严重胀包会导致包装爆裂,对消费者安全危害极大。基于此,开发高效、安全的控制方法,及时预防、消除食品加工与贮存中鲁氏接合酵母污染,具有重要的意义。
食品加工与贮存中主要通过添加食品防腐剂控制微生物污染,然而,当前应用广泛的食品防腐剂大多是化学合成品,具有抗菌效果差,可被微生物降解以及对人体具有潜在毒性等应用弊端。随着人们对食品营养健康与质量安全要求的提高,开发天然、高效的新型食品防腐剂引起全球相关科研工作者的广泛关注[4-5]。香芹酚(图1)是牛至、百里香等植物精油中的活性成分,已被美国食品药品监督管理局批准为“公认安全”的抗菌物质,也被列入我国GB 2760-2014《食品安全国家标准食品添加剂使用标准》,作为香精香料允许在食品中添加。研究表明,香芹酚对微生物具有高效抗菌活性,这种高效抗菌作用与香芹酚的疏水性及其结构中酚羟基的亲水性有关[6]。团队前期以山梨酸钾、苯甲酸钠等传统食品防腐剂为参比,从多酚类、黄酮类、醌类等数十种植物源天然化合物中筛选对鲁氏接合酵母具有高效抗菌活性的化合物,发现香芹酚具有强大的抗菌作用[7]。此外,团队前期研究发现香芹酚对苹果汁(30°Brix,pH 3.5)中高污染量鲁氏接合酵母【约6.3 lg(CFU/mL)】的生长表现出比山梨酸钾、苯甲酸钠、多羟基肉桂酸等更强的抑制活性[1]。可以看出,香芹酚作为一种潜在的天然食品防腐剂,在高效控制鲁氏接合酵母污染方面具有广阔的应用前景。然而,香芹酚具体通过何种途径对鲁氏接合酵母发挥高效抗菌活性,尚不完全清楚。

图1 香芹酚结构式Fig.1 Structure of carvacrol
细胞死亡包括程序性死亡(细胞凋亡)和非程序死亡(细胞坏死)。目前有关香芹酚抗菌机制的研究主要聚焦在微生物细胞坏死方面,包括香芹酚损伤微生物细胞屏障结构与功能,破坏核酸和蛋白质合成与功能,干扰细胞能量代谢等[8-9]。近年来,研究发现一些天然物质如壳聚糖、聚赖氨酸、姜黄素等可通过诱导微生物细胞凋亡发挥抗菌活性[10-11]。那么,在香芹酚对鲁氏接合酵母发挥抗菌活性的过程中,是否存在程序性死亡(细胞凋亡)尚不清楚。
本文通过测定抑菌圈直径、最小抑菌浓度和最小杀菌浓度,并采用扫描电镜观察鲁氏接合酵母细胞形态变化,明确香芹酚对鲁氏接合酵母的抗菌活性。通过检测细胞凋亡系列典型生化和形态特征以及凋亡关键调控因子转录水平变化,揭示香芹酚诱导鲁氏接合酵母凋亡的抗菌机制。研究结果旨在为充分解析香芹酚的抗菌机制提供新思路,也为新型食品防腐剂的开发应用提供理论参考。
1 材料与方法
1.1 材料、试剂与仪器
1.1.1 菌株 鲁氏接合酵母模式菌株ATCC 2623,购买于美国模式培养物集存库(ATCC),保存于-70 ℃。
1.1.2 试剂 二甲基亚砜(DMSO)、氯化钠、D-山梨醇、戊二醛、无水乙醇、磷酸二氢钾、磷酸氢二钾、葡萄糖,均为分析纯级,天津市科密化学试剂有限公司;蛋白胨、酵母浸粉、琼脂,北京奥博星生物技术有限责任公司;香芹酚(≥99.9%)、溶壁酶、两性霉素B,上海源叶生物科技有限公司;AnnexinV-FITC/PI 检测试剂盒、活性氧试剂盒、线粒体膜电位检测试剂盒、Caspase 抑制剂Z-VADFMK、一步法TUNEL 细胞凋亡检测试剂盒、Fluo-3AM 钙离子荧光探针、BeyoFastTMSYBR Green One-Step qRT-PCR Kit,碧云天生物技术有限公司;香芹酚母液(10 mg/mL):取香芹酚原液溶于DMSO 中,稀释定容至20 mL,0.22 μm 有机滤膜过滤,4 ℃保存待用。
1.1.3 仪器 Beckmancoulter-xl.mcl 流式细胞仪,美国Thermo 公司;Victor Nivo 酶标仪,芬兰PerkinElmer 公司;Phenom Pro-台式扫描电镜,飞纳科学仪器(上海)有限公司;Mygo Pro-实时荧光定量PCR,美国BioRad 公司;TGL-16B 离心机,上海安亭科学仪器厂;PL-203 电子天平,梅特勒-托利多(上海)仪器有限公司;XFH-50CA 灭菌锅,浙江新丰医疗器械有限公司;PWSIO-002 恒温培养箱,重庆试验设备厂;Vortex-2 涡旋混匀仪,上海泸析实业有限公司。
1.2 方法
1.2.1 菌种复苏 将冻存的鲁氏接合酵母ATCC 2623 从-70 ℃冰箱中取出,融化后将菌液转移至YPD 液体培养基中,28 ℃,200 r/min 培养24 h。取微量培养液接种于YPD 平板进行培养,确认无杂菌后挑单菌落接种于YPD 液体培养基,28 ℃培养24 h 后,再次转接于YPD 液体培养基,28 ℃培养至对数生长期(细胞浓度约1.0×106CFU/mL)后用于后续试验。
1.2.2 抑菌圈测定 使用牛津杯进行抑菌圈测定[12]。向平板中倒入一层YPD 半固体培养基,待其凝固后,用无菌镊子将牛津杯(d= 8 mm)垂直放在培养基表面。YPD 固体培养基降至35 ℃左右,加入酵母菌液(终浓度约2×104CFU/mL),混匀后倒入平板。待YPD 固体培养基凝固后拔出牛津杯,向牛津杯孔中加入100 μL 香芹酚溶液(10 mg/mL)。28 ℃培养48 h 后测量抑菌圈直径。
1.2.3 MIC 及MFC 测定 采用双倍稀释法测定MIC 和MFC[13]。用YPD 培养液将香芹酚母液(10 mg/mL)连续双倍稀释至不同质量浓度(10,5,2.5,1.25,0.625,0.3125,0.156,0.078 mg/mL)。向96 孔板中分别加入100 μL 不同质量浓度香芹酚溶液和100 μL 菌液(终浓度约5×105CFU/mL),香芹酚终质量浓度分别为5,2.5,1.25,0.625,0.31250.156,0.078,0.039 mg/mL。28 ℃培养48 h 后,每孔加入10 μL MTT(5 mg/mL)溶液,继续培养4 h。观察孔中溶液颜色,无颜色变化孔所对应的香芹酚最低质量浓度为香芹酚对鲁氏接合酵母的MIC 值。吸取MIC 以上质量浓度处理的菌液进行YPD 平板涂布,28 ℃培养48 h 后观察有无菌落形成,无菌落形成的最低质量浓度为MFC。
1.2.4 鲁氏接合酵母形态观察 收集对数生长期鲁氏接合酵母细胞,PBS 洗涤3 次,离心(8 000 r/min,5 min)收集细胞。不同浓度(0、MIC、MFC)香芹酚处理鲁氏接合酵母细胞4 h 后,离心收集细胞。戊二醛(2.5%)固定过夜,PBS 洗涤3 次后进行乙醇梯度脱水(30%,50%,70%,90%,100%),离心收集细胞,自然风干后扫描电镜观察。
1.2.5 鲁氏接合酵母脱壁处理 由于荧光探针不能透过酵母细胞壁进入胞内,后续细胞凋亡系列典型生化和形态特征检测前需进行酵母脱壁处理。参考蔡瑾[14]的方法进行鲁氏接合酵母脱壁处理。收集对数生长期鲁氏接合酵母细胞,PBS 洗涤3 次后重悬于PBS 中。酵母悬液加入香芹酚(终浓度分别为0、1/4 MIC、1/2 MIC、MIC),处理(28 ℃,200 r/min)4 h,离心收集细胞(8 000 r/min,5 min)。PBS 洗涤3 次后加入溶壁酶(终浓度为200 U/mL),28 ℃处理45 min 后离心收集细胞。PBS 洗涤后离心得到鲁氏接合酵母原生质体细胞。
1.2.6 胞内活性氧(ROS)水平检测 取1.2.5 节处理好的鲁氏接合酵母原生质体细胞(约1.0×106CFU),加入终浓度为10 μmol/L 的DCFH-DA 探针,涡旋混匀,28 ℃振荡孵育30 min 后离心收集细胞。PBS 洗涤并重悬鲁氏接合酵母细胞,采用流式细胞仪(激发波长488 nm,发射波长525 nm)检测DCF 荧光细胞的百分比和荧光强度。设置两性霉素B 处理组(0.1 mg/mL)为阳性对照。
1.2.7 胞内钙浓度检测 取1.2.5 节处理好的鲁氏接合酵母原生质体细胞(约1.0×106CFU),加入终浓度为5 μmol/L 的Fluo-3AM 探针,涡旋混匀,28 ℃振荡孵育60 min 后离心收集细胞。PBS 洗涤并重悬鲁氏接合酵母细胞,继续孵育30 min 以确保Fluo-3AM 在胞内完全转化成Fluo-3。采用酶标仪(激发波长488 nm,发射波长525 nm)检测荧光强度。设置两性霉素B 处理组(0.1 mg/mL)为阳性对照。
1.2.8 线粒体膜电位(MMP)检测 取1.2.5 节处理好的鲁氏接合酵母原生质体细胞(约1.0×106CFU),加入0.5 mL JC-1 染色工作液,涡旋混匀,28 ℃振荡孵育20 min 后离心收集细胞。JC-1 染色缓冲液(1×)洗涤并重悬鲁氏接合酵母细胞,流式细胞仪(激发波长488 nm,发射波长525 nm)检测线粒体膜电位水平。设置两性霉素B 处理组(0.1 mg/mL)为阳性对照。
1.2.9 半胱氨酸蛋白酶活性检测 参考蔡瑾的方法[14]进行半胱氨酸蛋白酶活性检测。采用半胱氨酸蛋白酶抑制剂(Z-VAD-FMK,终浓度20 μmol/L)预处理对数生长期鲁氏接合酵母细胞(约1.0×106CFU)1 h,PBS 洗涤后离心收集细胞。MIC 浓度香芹酚处理鲁氏接合酵母细胞4 h,PBS 洗涤3 次后将细胞重悬于生理盐水(0.9%)中,连续10 倍梯度稀释,取10 μL 不同稀释度细胞悬液点接于YPD 平板。28 ℃培养48 h,观察鲁氏接合酵母生长情况。
1.2.10 磷酯酰丝氨酸(PS)外翻检测 取1.2.5 节处理好的鲁氏接合酵母原生质体细胞(约1.0×106CFU),加入195 μL AnnexinV-FITC 结合液重悬细胞,再加入5 μL AnnexinV-FITC 工作液,最后加入10 μL 碘化丙啶(PI)工作液,涡旋混匀后室温避光孵育30 min。采用流式细胞仪检测(激发波长488 nm,发射波长525 nm)FITC 荧光细胞百分比和荧光强度。设置两性霉素B 处理组(0.1 mg/mL)为阳性对照。
1.2.11 细胞核DNA 片段化检测 取1.2.5 节处理好的鲁氏接合酵母原生质体细胞(约1.0×106CFU),将细胞用免疫染色固定液在20 ℃固定30 min,PBS 洗涤后离心收集细胞。采用免疫染色通透液重悬细胞,4 ℃孵育10 min,PBS 洗涤后离心收集细胞。加入50 μL TUNEL 检测液(5 μL TdT酶和45 μL 荧光标记物),28 ℃避光孵育60 min,PBS 洗涤并重悬细胞。采用流式细胞仪(激发波长488 nm,发射波长525 nm)检测绿色荧光细胞的百分比和荧光强度。设置两性霉素B 处理组(0.1 mg/mL)为阳性对照。
1.2.12 凋亡关键调控因子转录水平检测 取1.2.5 节处理好的鲁氏接合酵母原生质体细胞(约1.0×106CFU),按照试剂盒说明书提取总RNA,并采用BeyoFastTM SYBR Green One-Step qRTPCR Kit 进行cDNA 合成和qRT-PCR 检测。PCR体系为20 μL(10 μL PCR 缓冲液、2 μL 聚合酶混合物、2 μL 正向引物、2 μL 反向引物、2 μL 模板、2 μL 去离子水)。首先进行cDNA 合成(50 ℃,30 min),随后进行qRT-PCR 检测(95 ℃预变性2 min;40 个循环:95 ℃变性17 s,60 ℃退火30 s;72℃延长1 min)。采用2-△△Ct法计算目的基因相对转录水平。用于qRT-PCR 的引物由上海碧云天生物科技有限公司设计并合成,引物序列如表1所示。

表1 qRT-PCR 引物的序列Table 1 Sequence of primers used for qRT-PCR
1.3 数据处理
每组试验均重复3 次,数据以均值±标准差(n=3)表示。采用SPSS 软件进行方差分析,P<0.05表示差异显著(Duncan's 多重比较)。
2 结果与讨论
2.1 香芹酚对鲁氏接合酵母的抑菌活性
香芹酚对鲁氏接合酵母的抑菌圈直径为(13.67 ± 0.58)mm(图2),MIC 和MFC 分别为0.156 mg/mL 和0.3125 mg/mL,说明香芹酚对食品腐败酵母鲁氏接合酵母具有一定抑菌活性。基于该试验结果,与其它植物源活性物质如阿魏酸(MIC=17 mg/mL)、对香豆酸(MIC=1.23 mg/mL)、肉桂酸(MIC=0.35 mg/mL)、香草醛(MIC>2.28 mg/mL)、柠檬醛(MIC=0.17 mg/mL,MFC=0.34 mg/mL)、柠檬烯(MIC=0.66 mg/mL,MFC=2.64 mg/mL)以及丁香酚(MIC=0.43 mg/mL,MFC=0.86 mg/mL)等相比[15-16],香芹酚对鲁氏接合酵母具有较强的抑菌活性。团队前期研究也发现香芹酚对苹果汁(30°Brix,pH 3.5)中高污染量鲁氏接合酵母【约6.3 lg(CFU/mL)】的生长表现出比山梨酸钾、苯甲酸钠、多羟基肉桂酸等更强的抑制活性[1]。香芹酚是牛至、百里香等植物精油中的活性成分,对微生物具有高效抗菌活性,这种高效抗菌作用与香芹酚的疏水性及其结构中酚羟基的亲水性有关[6]。因此,香芹酚在高效防控食品中鲁氏接合酵母污染方面具有重要的应用价值。在后续实际应用中,以聚乳酸、聚乙烯醇等可降解材料为基材,以香芹酚为抗真菌剂,制备食品活性包装膜。通过香芹酚的缓释持续抑制鲁氏接合酵母在浓缩果汁等食品表面的生长,不仅可解决香芹酚水溶性差、易挥发等应用弊端,还可避免香芹酚无法在高黏度浓缩果汁等食品表面有效分散的问题。
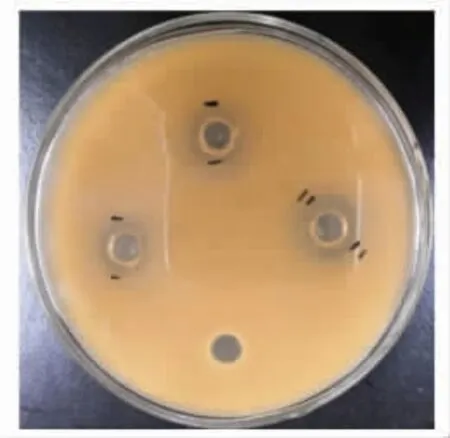
图2 香芹酚对鲁氏接合酵母生长的影响Fig.2 Effect of carvacrol on the growth of Z.rouxii
2.2 香芹酚对鲁氏接合酵母细胞形态的影响
如图3所示,空白对照组(图3a)中鲁氏接合酵母细胞形态为典型的出芽酵母,外观椭圆形、饱满、表面光滑无凹陷;MIC(图3b)或MFC(图3c)香芹酚处理后,鲁氏接合酵母细胞形态产生褶皱,表明香芹酚影响鲁氏接合酵母细胞壁和细胞膜结构,也进一步证明香芹酚对鲁氏接合酵母具有抗菌活性。此外,MFC 香芹酚处理后鲁氏接合酵母细胞完整性良好,未出现明显细胞破裂,初步推断香芹酚可能并不通过诱导鲁氏接合酵母细胞坏死发挥抗菌活性。

图3 香芹酚对鲁氏接合酵母细胞形态的影响Fig.3 Effect of carvacrol on the cell morphology of Z.rouxii
2.3 香芹酚对鲁氏接合酵母胞内ROS 含量的影响
采用荧光探针(DCFH-DA)检测胞内活性氧水平。DCFH-DA 本身没有荧光,进入细胞后被胞内酯酶水解生成DCFH,DCFH 可被胞内ROS 氧化生成DCF。DCF 具有荧光,通过流式细胞仪可对DCF 荧光细胞的百分比及荧光强度进行检测。如图4所示,空白对照及阳性对照组中DCF 荧光细胞的百分比分别为(2.68 ± 0.03)%,(63.87 ±1.89)%;经1/4MIC、1/2MIC 和MIC 香芹酚处理后,DCF 荧光细胞的百分比分别显著提高至(10.27 ± 0.48)%,(14.60 ± 0.76)%和(52.77 ±2.58)%(P<0.05);并且DCF 荧光强度随着香芹酚质量浓度升高逐渐升高(图谱逐渐右移)。上述结果表明香芹酚可通过浓度依赖的方式促进鲁氏接合酵母胞内活性氧的累积。

图4 香芹酚对鲁氏接合酵母胞内活性氧的影响Fig.4 Effect of carvacrol on the intracellular ROS in Z.rouxii
线粒体是产生ROS 等启动细胞凋亡信号分子的主要细胞器,在细胞凋亡途径中发挥重要作用。ROS,尤其是羟自由基(·OH)、过氧化氢(H2O2)和超氧阴离子(O2-),被广泛认为是真菌细胞中与许多凋亡途径相关的关键细胞死亡调节因子[11]。系统生物学和细胞调控通路分析发现大多数抗真菌药物在不同药物靶标相互作用的模式下均能触发羟自由基的形成,最终引发细胞凋亡[17]。胞内ROS 过量累积被认为是最早参与细胞凋亡的生理变化之一,其通过氧化核酸、蛋白质、脂质等生物大分子对细胞活力产生不利影响,导致一系列的凋亡反应[18]。ROS 诱导的细胞损伤已被证明是天然活性物质(槲皮素、姜黄素、壳聚糖等)对霉菌(黄曲霉、毛状角囊菌等)和酵母菌(白色念珠菌、酿酒酵母等)发挥抗菌活性过程中常见的生化现象和主要的抗菌方式[11,19-21]。本研究发现香芹酚以剂量依赖的方式诱导鲁氏接合酵母胞内ROS 水平显著增加。基于此,ROS 水平升高是否引发鲁氏接合酵母细胞氧化应激并触发凋亡尚待进一步确认。后续通过测定MMP 去极化、PS 外翻、DNA 片段化等系列典型凋亡特征,进一步探讨香芹酚对鲁氏接合酵母的抗菌机制。
2.4 香芹酚对鲁氏接合酵母胞内Ca2+浓度的影响
Fluo-3AM 是最常用的检测胞内Ca2+浓度的荧光探针之一。Fluo-3AM 进入细胞后,被细胞内酯酶裂解形成Fluo-3,与胞质Ca2+结合产生荧光,采用酶标仪检测其荧光强度即可表征胞内Ca2+浓度。如图5所示,与空白对照组相比,经1/4 MIC、1/2 MIC 和MIC 香芹酚处理后,鲁氏接合酵母细胞荧光强度随着香芹酚浓度的增加而显著升高(P< 0.05),表明香芹酚可促进鲁氏接合酵母胞内Ca2+浓度升高。

图5 香芹酚对鲁氏接合酵母胞内钙离子浓度的影响Fig.5 Effect of carvacrol on the level of intracellular calcium in Z.rouxii
胞内Ca2+在调控细胞凋亡中发挥重要作用。在正常细胞中,约80%的Ca2+储存在液泡、溶酶体、内质网等钙库中。当细胞受到外源性凋亡刺激后,Ca2+从钙库释放到细胞质中,导致胞内Ca2+水平升高。此时线粒体依赖其膜电位的变化吸收胞质Ca2+,导致线粒体Ca2+超载,继而扰乱线粒体内氧化还原反应和ATP 合成,引发MMP 去极化、线粒体通透性转换孔(MPTP)的形成与开放、线粒体细胞色素C(cyt c)释放、基因调控的信号级联反应的发生以及最终的细胞凋亡[21-22]。哺乳动物细胞内质网中Ca2+可通过兰尼碱受体(内质网Ca2+通道)泄漏,导致线粒体Ca2+超载和细胞凋亡[23]。外源性刺激构巢曲霉细胞后引发内质网应激,导致Ca2+通过钙通道从内质网腔释放到胞质中,最终造成凋亡[24]。在酵母细胞中,液泡中Ca2+储存量相对较高,液泡被认为是酵母胞内主要钙库。因此,液泡钙通道可能在调控胞质和线粒体Ca2+紊乱引发的凋亡中扮演重要角色。此外,胞内Ca2+超载也可能与ROS 增加有关。ROS 氧化脂质后,细胞膜通透性增强,引发胞外Ca2+内流[25]。目前,Ca2+在天然活性物质诱导酿酒酵母、黄曲霉、灰葡萄孢等微生物凋亡研究中受到越来越多的关注[19,24]。本研究发现香芹酚以剂量依赖的方式引发胞内Ca2+浓度升高,提示胞内Ca2+超载可能是香芹酚诱导鲁氏接合酵母凋亡的早期信号。
2.5 香芹酚对鲁氏接合酵母细胞MMP 的影响
荧光探针JC-1 被广泛用于线粒体膜电位水平的检测。对正常细胞而言,JC-1 进入细胞后聚集在线粒体基质中,形成红色荧光J-聚合物(图6流式细胞图C2 象限);当MMP 去极化引发细胞凋亡时,J-聚合物从线粒体释放到细胞质中,形成绿色荧光JC-1 单体(图6 流式细胞图C4 象限);通过检测J-聚合物与JC-1 单体荧光细胞数比值(FL2/FL1)的变化趋势可表征MMP 是否发生去极化。如图6所示,空白对照及阳性对照组MMP 去极化细胞的百分比分别为(9.37±0.71)%和(64.4±1.06)%;经1/4 MIC、1/2 MIC 和MIC 香芹酚处理后,MMP 去极化细胞百分比分别显著提高至(23.20±0.85)%,(42.17±0.82)%和(65.03±1.37)%(P<0.05);并且JC-1 单体荧光强度随着香芹酚质量浓度升高逐渐升高(图谱逐渐右移)。对FL2/FL1 进行计算,如图6f所示,空白对照及阳性对照组FL2/FL1 分别为9.58 ± 0.85 和0.49 ± 0.05;经香芹酚处理后,FL2/FL1 分别显著降低至3.25±0.12,1.36±0.05 和0.52±0.03(P<0.05)。上述结果表明香芹酚可通过质量浓度依赖的方式促进鲁氏接合酵母MMP 去极化。
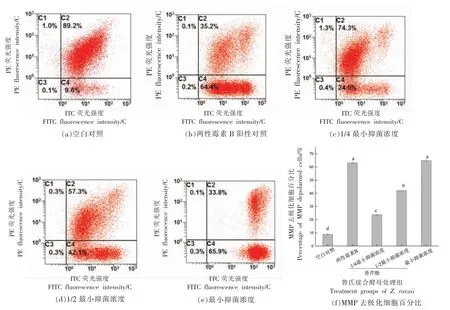
图6 香芹酚对鲁氏接合酵母线粒体膜电位的影响Fig.6 Effects of carvacrol on the MMP in Z.rouxii
MMP 通常是表征线粒体能量偶联状况的敏感指标,凋亡细胞胞内ROS 水平升高和Ca2+紊乱可触发MMP 去极化[25]。MMP 去极化表明线粒体功能出现障碍,通常伴有线粒体肿胀、线粒体脊线缺失、氧化磷酸化链解偶联、胞内ATP 合成受到抑制等[11,26]。此外,MMP 去极化促进线粒体MPTP形成和开放,引发促凋亡因子如cyt c、Aif1p(凋亡诱导因子)等释放到细胞质中,导致蛋白质、DNA等生物大分子损伤,最终造成细胞凋亡[18]。因此,MMP 去极化被认为是最早的细胞凋亡事件之一。本研究发现香芹酚通过降低MMP 引发鲁氏接合酵母线粒体不可逆去极化,这可能是由于线粒体中ROS 过度积累和线粒体Ca2+超载,启动线粒体线性过度和去能,最终导致MMP 崩溃[14]。
2.6 香芹酚对鲁氏接合酵母细胞 半胱氨酸蛋白酶活性的影响
采用泛半胱氨酸蛋白酶抑制剂Z-VAD-FMK检测半胱氨酸蛋白酶活性。Z-VAD-FMK 穿透细胞膜进入胞内后可抑制由半胱氨酸蛋白酶激活导致的细胞凋亡。结果如图7所示,与空白对照组相比,MIC 香芹酚虽可显著抑制鲁氏接合酵母生长,但Z-VAD-FMK 预处理可减弱香芹酚的抑菌活性,说明香芹酚可激活鲁氏接合酵母细胞半胱氨酸蛋白酶,也表明香芹酚可能依赖半胱氨酸蛋白酶诱导鲁氏接合酵母凋亡。
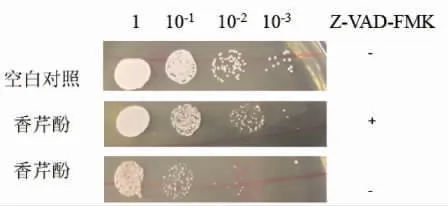
图7 香芹酚对鲁氏接合酵母半胱氨酸蛋白酶活性的影响Fig.7 Effect of carvacrol on the action of metacaspase in Z.rouxii
半胱氨酸蛋白酶是细胞质中一类结构相似的家族蛋白,其重要的共同特征是活性位点都含有半胱氨酸,因此被称为半胱氨酸蛋白酶。该酶保守的半胱氨酸侧链通过特异性裂解与天冬氨酸接触的蛋白底物驱动催化反应,一些半胱氨酸蛋白酶的活化被认为是参与哺乳动物细胞凋亡的关键过程之一[27]。虽然在真菌细胞中未发现半胱氨酸蛋白酶,但其结构同源物已被发现在真菌、原生动物和植物细胞中具有触发凋亡的作用[28]。半胱氨酸蛋白酶的激活可开启多种凋亡现象,包括凋亡蛋白酶水解信号的级联触发、细胞骨架坍塌和DNA片段化等,因此被认为是早期凋亡的典型生化标志之一[21]。通过序列比对,团队前期在鲁氏接合酵母ATCC 2623 基因组中发现一个编码序列(ZYRO0F10802g)与酿酒酵母中编码半胱氨酸蛋白酶的Yca1基因序列高度相似,提示鲁氏接合酵母中可能也存在半胱氨酸蛋白酶(未发表)。本研究发现,香芹酚影响鲁氏接合酵母线粒体稳态,导致胞内ROS 和Ca2+水平升高以及线粒体MMP 去极化。因此,推测线粒体紊乱引发线粒体cyt c 释放到细胞质中与半胱氨酸蛋白酶结合,继而激活半胱氨酸蛋白酶,开启凋亡进程,最终导致鲁氏接合酵母凋亡。
2.7 香芹酚对鲁氏接合酵母细胞PS 的影响
采用Annexin V-FITC 和PI 双染法检测PS外翻。当细胞发生早期凋亡时,细胞膜上的PS 由质膜内侧翻到外侧,可通过检测胞外PS 暴露表征早期凋亡。Annexin V-FITC 是一种用荧光基团FITC 标记的磷脂结合蛋白,对PS 具有很强的亲和力。PI 染料不能透过正常细胞的完整细胞膜,然而当细胞坏死后发生破裂,PI 进入胞内使细胞染色。采用Annexin V-FITC 和PI 对细胞进行双染,通过流式细胞仪可区分正常细胞(图8 流式细胞图B3 象限)、凋亡细胞(图8 流式细胞图B4 象限)和坏死细胞(图8 流式细胞图B2 象限)。如图8所示,空白对照及阳性对照组FITC 荧光细胞的百分比分别为(2.6±0.08)%,(78.90±0.65)%;经1/4MIC、1/2MIC 和MIC 香芹酚处理后,FITC 荧光细胞百分比分别显著提高至(16.17 ± 0.25)%,(69.17±0.74)%和(83.47±0.82)%(P<0.05),说明香芹酚可通过质量浓度依赖的方式引发鲁氏接合酵母细胞PS 外翻。此外,不同质量浓度香芹酚处理后PI 荧光细胞百分比显著低于阳性对照组(图8f),说明香芹酚主要引起鲁氏接合酵母凋亡,并未导致细胞坏死(细胞破裂)。
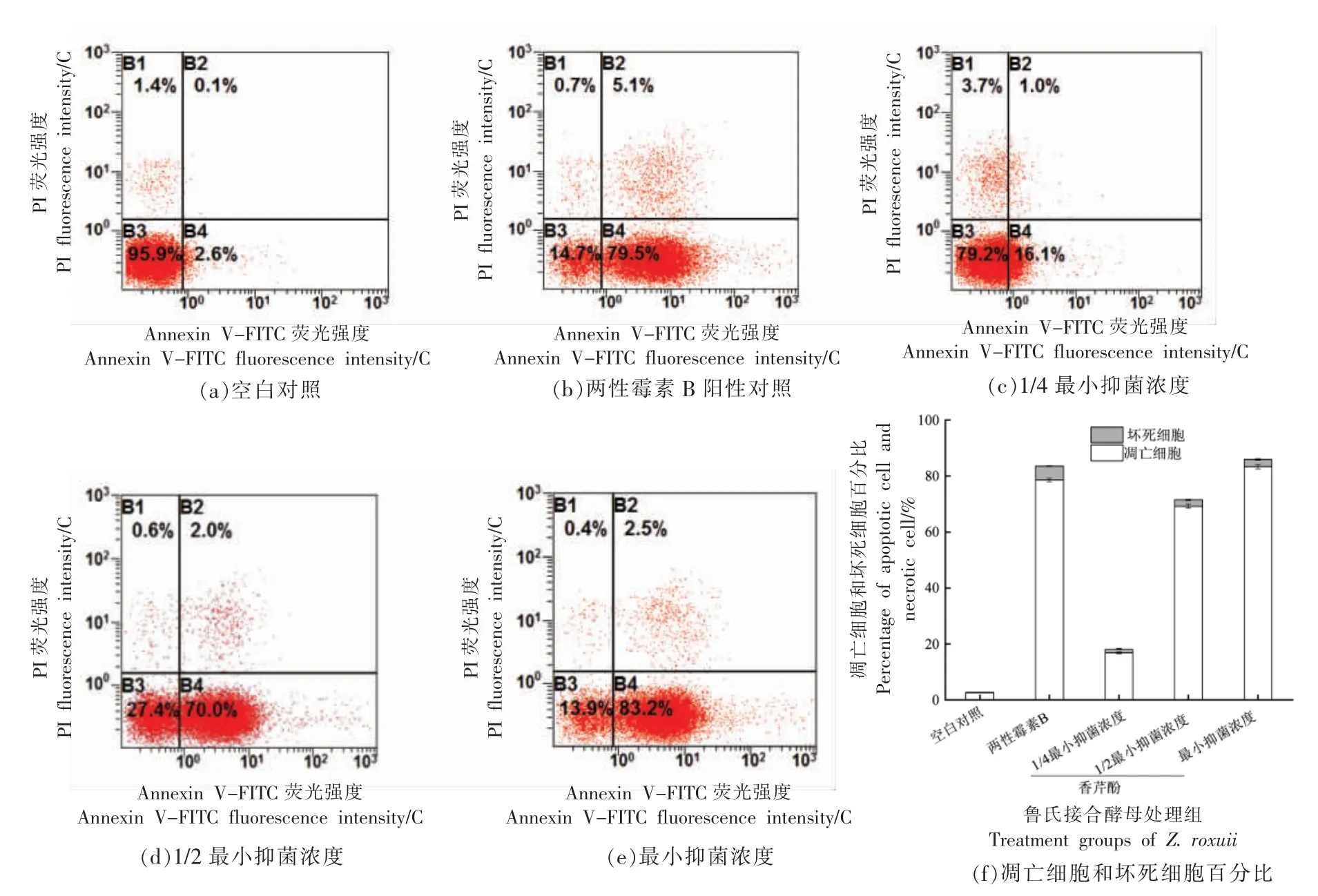
图8 香芹酚对鲁氏接合酵母磷脂酰丝氨酸的影响Fig.8 Effects of carvacrol on the PS in Z.rouxii
哺乳动物和真菌细胞早期凋亡时,细胞膜磷脂双分子层的结构会发生变化。正常生理条件下,磷脂不对称分布于细胞膜内外侧,PS 主要分布于细胞膜内侧。磷脂的不对称分布主要由细胞膜上的两种酶维持。ATP 依赖的氨基磷脂转位酶(Translocase)特异性将PS 和磷脂酰乙醇酰胺(PE)转运到细胞膜内小叶,同时ATP 依赖的转位酶(Floppase)则将PS 和磷脂酰胆碱(PC)转运到质膜外小叶,然而转位酶的转运速率比氨基磷脂转位酶慢10 倍,导致细胞膜磷脂的不对称分布[29]。由于细胞凋亡过程中氨基磷脂转位酶活性大幅下降,膜脂的不对称性被破坏,造成PS 外翻[21]。因此,PS 外翻已成为凋亡细胞的重要形态标志之一。本研究通过Annexin V-FITC 和PI 双染检测发现香芹酚诱导PS 暴露于鲁氏接合酵母细胞膜外小叶,表明香芹酚可能引发鲁氏接合酵母细胞早期凋亡。
2.8 香芹酚对鲁氏接合酵母细胞DNA 的影响
采用TUNEL(TdT-mediated dUTP Nick-End Labeling)法进行DNA 断裂检测。细胞发生凋亡时,胞内一些DNA 内切酶被激活,剪断基因组DNA,导致大量的DNA 断裂。暴露的3'-OH 在末端脱氧核糖核酸转移酶(Terminal deoxynucleotidyl transferase,TdT)的催化下加上绿色荧光探针荧光素(FITC)标记的dUTP(Fluorescein-dUTP),从而通过流式细胞仪检测发生DNA 断裂细胞的百分比。如图9所示,空白对照及阳性对照组FITC荧光细胞的百分比分别为(1.60±0.03)%和(4.26±0.07)%;经1/4 MIC、1/2 MIC 和MIC 香芹酚处理后,FITC 荧光细胞的百分比显著提高至(2.44 ±0.06)%,(5.66 ± 0.05)%和(10.44 ± 0.08)%(P<0.05),说明香芹酚通过浓度依赖的方式诱导鲁氏接合酵母细胞DNA 断裂。
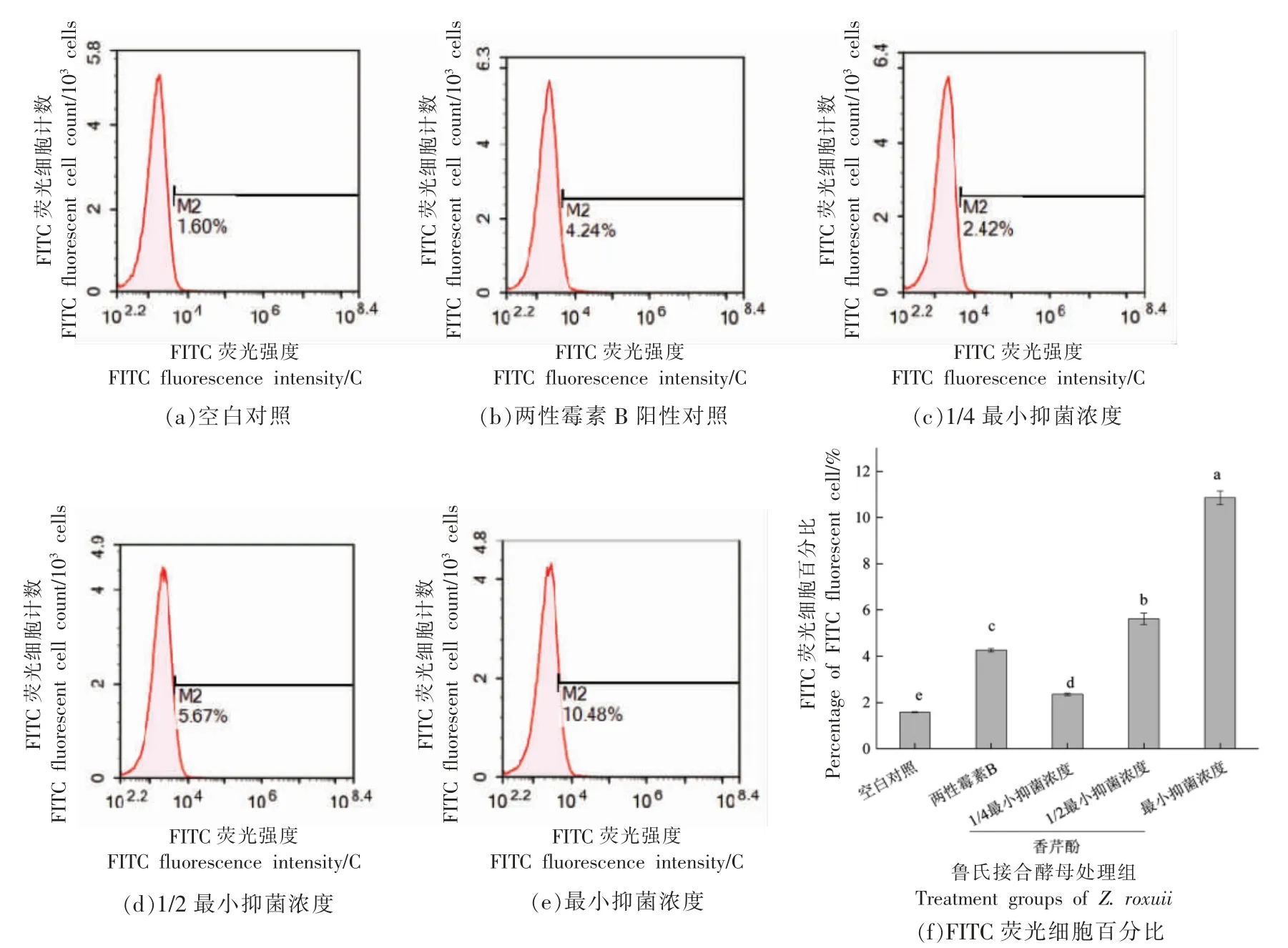
图9 香芹酚对鲁氏接合酵母DNA 的影响Fig.9 Effects of carvacrol on DNA in Z.rouxii
细胞受到凋亡诱导信号刺激时,线粒体MPTP打开并释放凋亡诱导因子Aif1p。在易位到细胞核后,Aif1p 通过其DNA 结合域直接作用于基因组DNA,与来自线粒体的另一种细胞死亡诱导因子Nuc1p 协同导致DNA 片段化[30]。在酵母细胞中,Aif1p 不仅诱导不依赖半胱氨酸蛋白酶的凋亡,而且还与半胱氨酸蛋白酶和cyt c 协同作用诱导凋亡。DNA 损伤还与胞内ROS 积累有关,ROS 通过诱导生成丙二醛损伤DNA[21]。此外,一些植物源化合物通过类似于EB 插入DNA 的方式影响DNA结构,或通过静电作用与DNA 相互作用,造成DNA 损伤[31]。DNA 损伤进一步导致凋亡小体的形成和细胞体积的减小,最终引发凋亡。因此,DNA片段化被认为是晚期细胞凋亡的细胞学标志。本研究发现香芹酚可导致鲁氏接合酵母胞内ROS水平升高、线粒体紊乱以及半胱氨酸蛋白酶激活,提示鲁氏接合酵母DNA 片段化可能是由ROS 氧化、线粒体凋亡诱导因子切割以及半胱氨酸蛋白酶激活核酸内切酶共同作用的结果。整体来看,本研究表明香芹酚在鲁氏接合酵母早期和晚期凋亡中对细胞生化和形态变化有显著影响,香芹酚通过半胱氨酸蛋白酶依赖的线粒体途径诱导鲁氏接合酵母凋亡。
2.9 香芹酚对鲁氏接合酵母凋亡关键调控因子转录的影响
以18S rDNA为内参,采用qRT-PCR 检测香芹酚对鲁氏接合酵母凋亡关键调控因子转录的影响。结果如图10所示,与空白对照相比,MIC 香芹酚处理导致促凋亡因子Yca1、Dnm1、Cyc1、Nuc1与Ndi1 相对表达量上调1~4 倍,进一步证实香芹酚可诱导鲁氏接合酵母凋亡。

图10 香芹酚对鲁氏接合酵母凋亡关键调控因子转录的影响Fig.10 Effects of carvacrol on the transcription level of key regulators of apoptosis in Z.rouxii
酵母细胞凋亡不仅表现出与哺乳动物细胞相似的形态和生化特征,而且具有相似的关键调控因子。YOR197W 蛋白Yca1p 被认为是酿酒酵母中哺乳动物半胱氨酸蛋白酶的同源蛋白,在诱导细胞凋亡中发挥关键作用[32]。AMID 是一种位于哺乳动物细胞线粒体外膜的凋亡诱导蛋白,可在细胞核周围聚集并引发染色体收缩。位于线粒体膜内的NADH 脱氢酶Ndi1p 是AMID 的酵母同源物,具有促进酵母凋亡的功能[33]。EndoG 是哺乳动物细胞编码核基因的一种DNA 酶,参与线粒体DNA 复制。凋亡刺激时,EndoG 从线粒体转移到细胞核,导致DNA 片段化。Nuc1p 是EndoG 的酵母同源物,是位于线粒体上的细胞死亡诱导因子。与EndoG 类似,在凋亡过程中,Nuc1p 转移到细胞核中切割DNA,引起DNA 断裂[34]。线粒体分裂是哺乳动物细胞凋亡的原因之一,受线粒体分裂蛋白Drp1p 的调控。在不同死亡因素的刺激下,Drp1的酵母同源物Dnm1 在线粒体破裂和降解之前可诱导凋亡[14]。在本研究中,MIC 香芹酚处理导致Yca1、Dnm1、Nuc1、Ndi1 和Cyc1 转录上调,进一步证实香芹酚通过半胱氨酸蛋白酶依赖的线粒体途径诱导鲁氏接合酵母凋亡。
3 结论
本文系统研究了植物源活性物质香芹酚对食品腐败酵母鲁氏接合酵母的抗菌活性,并首次从细胞凋亡的角度深入解析了其潜在的抗菌机制。结果表明,香芹酚可能通过半胱氨酸蛋白酶依赖的线粒体途径诱导鲁氏接合酵母凋亡(图11),从而发挥高效抗菌活性:香芹酚诱导鲁氏接合酵母胞内ROS 和Ca2+水平升高,是鲁氏接合酵母细胞凋亡的早期信号;香芹酚诱导胞内ROS 和Ca2+水平升高可能直接影响线粒体稳态并损伤DNA,导致MMP 去极化;MMP 去极化可能促进线粒体cyt c 释放到细胞质中,导致半胱氨酸蛋白酶激活,从而触发细胞凋亡进程,包括PS 外翻和DNA 片段化等。本研究表明香芹酚在食品防腐保鲜方面具有重要的应用价值。

图11 香芹酚诱导鲁氏接合酵母凋亡的潜在机制Fig.11 The potential mechanism of carvacrol-induced apoptosis in Z.rouxii
