油莎豆基因组大小、倍性和系统发育分析
2023-03-22王会伟朱世新张新友杨铁钢张向歌王树峰李春鑫
王会伟,朱世新,张新友,王 艳,杨铁钢,张向歌,王树峰,李春鑫
(1.河南省农业科学院 经济作物研究所,河南 郑州 450002;2.郑州大学 生命科学院,河南 郑州 450001)
我国是世界上植物油第一生产国和消费国,受限于国内产量,植物油供给对外依存度较高,已成为我国食用油供给安全的重大隐患。油莎豆(Cyperus esculentusL.)单产高、营养价值丰富、绿色健康、耐涝节水[1-2],是助力植物油自主供给、发展健康饮食的理想作物[3]。目前,油莎豆已被科技部和农业农村部作为重要的新兴油源作物进行推广,2021年,农业农村部将其正式列入“十四五”全国种植业发展规划。
油莎豆属于莎草科(Cyperaceae Juss.)、莎草属(CyperusL.),该属全世界约有600 种,分布于温带、亚热带和热带地区,我国有60 多种[4]。油莎豆自20世纪50年代引入我国种植以来,由于种源多采用块茎营养繁殖,未经过现代育种技术改良,退化严重。目前,完善的油莎豆良种繁育技术和优异种质资源非常匮乏[5]。这主要是因为油莎豆研究基础薄弱,种质资源的遗传背景不明。因此,对油莎豆基因组大小、倍性和系统发育进行分析是油莎豆遗传改良和育种的基础。但是,目前此方面的研究非常少[6]。ZONNEVELD[6]在2019 年利用流式细胞仪分析了荷兰油莎豆,发现其基因组约为0.669 Gb,并推测其为二倍体。通过测序来评估物种基因组大小和特性,是一种高效的方法。该方法已在研究基础薄弱的动植物遗传背景分析中得到广泛应用[7-8],但目前尚没有利用该技术对油莎豆基因组进行研究的报道。为此,通过流式细胞仪和基因组Survey 分析对黄淮地区油莎豆主栽品种和特色种质资源的基因组大小、倍性进行研究,并进行了系统发育分析,为明确我国油莎豆种质的遗传背景奠定基础。
1 材料和方法
1.1 试验材料
供试油莎豆为豫油莎1 号(C.esculentusL.‘Yuyousha 1’,中圆粒)、豫油莎2 号(C.esculentusL.‘Yuyousha 2’,中圆粒)、豫油莎3 号(C.esculentusL.‘Yuyousha 3’,中长粒)、豫油莎5 号(C.esculentusL.‘Yuyousha 5’,中圆粒)、中油莎1 号(C.esculentusL.‘Zhongyousha 1’,中圆粒)、YYS-4(C.esculentusL.‘YYS-4’,大粒),均由河南省农业科学院经济作物研究所油莎豆育种研究室提供。其中,豫油莎1号、豫油莎2 号、豫油莎5 号和中油莎1号为主栽品种,豫油莎3号和YYS-4为特色种质资源。
1.2 基因组大小、倍性分析
1.2.1 流式细胞仪分析 取6~8 叶期的6 个油莎豆材料的新鲜叶片20 mg 放在塑料培养皿的中心,添加1 mL 预冷的细胞核裂解液(45 mmol/L MgCl2·6H2O、20 mmol/L MOPS、30 mmol/L 柠檬酸钠、10 mmol/L Na2EDTA、20 mL/L β-巯基乙醇、2% PVP-40、0.5% Triton X-100、0.1% Tween 20,pH 值7.0,-20 ℃下保存,解冻后4 ℃保存)到培养皿中,用刀片将叶片切碎,整个过程在冰袋上操作且保证叶片始终浸没在裂解液中,上下混合匀浆数次,将匀浆过滤到标记样品管中,加入DNA 荧光铬的储备溶液,轻轻摇动。分析前在冰上孵育样品,偶尔摇晃。用流式细胞仪(美国BD Accuri C6)测量染色核的相对荧光。每个样品重复测定3次,变异系数控制在5%以内,以小麦(基因组为17 Gb)为参照。测定所得图像和数据由流式细胞仪自带软件进行处理分析。基因组大小=(样品荧光强度/参照荧光强度)×参照基因组大小。
1.2.2 Survey分析
1.2.2.1 文库构建及测序 取6~8 叶期3 种粒型油莎豆材料[豫油莎2 号(中圆粒)、豫油莎3 号(中长粒)和YYS-4(大粒)]的叶片,用改良的CTAB 方法提取基因组DNA[9]。用Nano Drop 2000 分光光度计(Nano DropTechnologies,Wilmington,DE,USA)、Qubit 3.0 荧光计(Life Technologies,Carlsbad,CA,USA)和0.8%琼脂糖凝胶电泳来检测其浓度和质量。然后3 个材料各取1 μg DNA 采用MGI DNA 文库通用试剂盒(诺唯赞,南京)构建文库,对每个样本添加index。文库构建完成后,使用Qubit 3.0荧光计 和Bioanalyzer 2100 系 统(Agilent Technologies,CA,USA)测定文库中样品的浓度和片段大小分布,以确定合适的上机pooling 方案。文库检测合格后,在MGI-SEQ 2000 平台上进行测序,具体测序服务由武汉菲沙基因信息有限公司提供。
1.2.2.2 Survey 分析 在二代测序数据下机后,利用HTQC(v1.92.310)软件对原始数据进行过滤,过滤标准如下:去除接头序列和PCR 扩增等原因引起的冗余序列;去除单端测序读长中的一端含有的N含量占比超过10%的测序片段;去除测序片段中的一端含有的低质量碱基数(≤5)占比超过50%的片段,得到高质量测序数据。参照LIU 等[10]的方法,通过GCE(Genome characteristics estimation)软 件 的K-mer预估油莎豆的基因组大小、杂合率、重复序列占比及基因组倍性等,分析时采用K=17[11]。
1.2.3 花粉活力测定 挑选6个油莎豆材料即将散粉的单株,将其整个花器剪下,取少许花粉于载玻片上,滴加2~3 滴醋酸洋红溶液,覆盖载玻片,放在体视镜(50×)下观察花粉粒的染色情况。
1.3 系统发育分析
用DNA 提取试剂盒[宝生物工程(大连)有限公司]提取6个油莎豆材料的总DNA,然后进行核糖体DNA 的内转录间隔区(Internal transcribed spacer,ITS)(ITS1-5.8S rDNA-ITS2)和 外 转 录 间 隔 区(External transcribed spacer,ETS)序列扩增,其中,ITS序列的引物为SE17(5′-ACGAATTCATGGTCCGGTGAAGTGTTC-3′)和SE26(5′-TAGAATTCCCCGGTTCGCTCGCCGTTAC-3′)[12],ETS 序列的引物为ETS-F(5′-CTGTGGCGTCGCATGAGTTG-3′)和18S-R(5′-AGACAAGCATATGACTACTGGCAGG-3′)[13]。PCR 扩增体系:12.5 μL 的2×TaqPCR Master Mix[生工生物工程(上海)股份有限公司],11.2 μL ddH2O,正、反向引物各0.5 μL(10 μmol/L),0.3 μL模板DNA,总体积为25 μL。扩增程序:94 ℃预变性5 min;94 ℃变性30 s,58 ℃退火1 min,72 ℃延伸2 min,共30 个循环;最后72 ℃延伸10 min。扩增产物交河南尚亚生物技术有限公司进行一代测序。
从GenBank中获取长尖莎草(C.cuspidatusH.B.K.)、异型莎草(C.difformisL.)、油莎豆(C.esculentusL.)、褐穗莎草(C.fuscusL.)、头状穗莎草(C.glomeratusL.)、畦畔莎草(C.haspanL.)、碎米莎草(C.iriaL.)、香附子(C.rotundusL.)、白毛羊胡子草(Eriophorum vaginatumL.)的ITS 和ETS 基因(表1),与6 个油莎豆材料的ITS 和ETS 基因用MAFFT[14]进行多序列比对,然后将比对后的序列联合用于构建系统进化树。以白毛羊胡子草作为外类群,采用最大似然法(Maximum likelihood,ML)和 贝 叶 斯 推 论 法(Bayesian inference,BI)在Cyberinfrastructure for Phylogenetic Research(CIPRES)Science Gateway(https://www.phylo.org/)构建系统发育树。采用RAxML(Randomized axelerated maximum likelihood)-HPC2 构建ML 树[15],采用MrBayes Restart on XSEDE(3.2.x)构建BI 树[16],参数设置参考WEI 等[17]的方法。在ML 树中BS(自展支持率)≥70%结果可靠[17],在BI 树中PP(后验概率)≥0.95 结果可靠[16],最终结果保留BS≥70%或PP≥0.95 的节点数值。最后用TreeGraph 2[18]查看、注解系统发育树。

表1 油莎豆近源类群ITS和ETS序列的GenBank登录号Tab.1 Accession numbers of ITS and ETS of closely related species ofC.esculentusL.from GenBank
2 结果与分析
2.1 油莎豆基因组大小分析
2.1.1 基于流式细胞仪的基因组大小评估 流式细胞仪分析结果表明,6 个油莎豆材料的荧光峰对应的基因组大小为0.808 6~0.858 5 Gb(图1、表2),均值为0.826 0 Gb。其中,大粒材料(YYS-4)基因组最大,为0.858 5 Gb,中长粒材料(豫油莎3 号)为0.831 1 Gb,豫油莎1 号、豫油莎2 号、豫油莎5 号和中油莎1 号等4 个中圆粒材料基因组均值为0.817 2 Gb。综上,6 个油莎豆材料的基因组大小差异不明显。

表2 基于流式细胞仪的6个油莎豆材料基因组大小评估Tab.2 Evaluation of genome size of sixC.esculentusL.materials by flow cytometry

图1 6个油莎豆材料的流式细胞仪测定结果Fig.1 The determination results of sixC.esculentusL.materials by flow cytometry
2.1.2 基于Survey 分析的基因组大小评估 为进一步准确评估油莎豆基因组大小,对3 种粒型油莎豆材料(豫油莎2 号:中圆粒;豫油莎3 号:中长粒;YYS-4:大粒)进行基因组Survey分析。测序数据经过质控筛选,获得测序数据量分别为豫油莎2 号58.70 Gb、豫油莎3 号52.60 Gb、YYS-4 64.36 Gb,测序深度分别为豫油莎2 号82×、豫油莎3 号66×、YYS-4 79×,Q20 均在95%以上,Q30 均在90%以上(表3),符合后续分析质控要求。

表3 3种粒型油莎豆材料高质量测序数据结果Tab.3 Results of high quality sequence data of three tuber types ofC.esculentusL.
以过滤后的高质量数据为基础,利用软件GCE基于K-mer(K=17)的方法估计基因组大小和杂合率及重复序列信息。结果(表4)显示,3种粒型油莎豆材料豫油莎2 号、豫油莎3 号、YYS-4 基因组分别为0.697 9、0.778 7、0.790 6 Gb。3 种粒型油莎豆材料的杂合率均较低,其中,豫油莎2 号杂合率最高,为0.28%,豫油莎3 号杂合率仅为0.08%;重复序列占比在材料间基本相似,最高的豫油莎3 号为84.45%,最低的豫油莎2 号为81.02%;豫油莎3 号GC 含量最高为36.4%,豫油莎2 号和YYS-4 的GC含量非常接近,分别为34.7%和34.9%。

表4 3种粒型油莎豆材料的基因组特征信息Tab.4 Genome survey on three tuber types ofC.esculentusL.
2.2 油莎豆基因组倍性分析
对基因组K-mer深度分布(K=17)情况(图2)进行分析,发现 3个油莎豆材料均出现了 3个峰,且主峰与后面2个峰大约呈整数倍(1∶2∶3)关系,由此推测3个材料的倍性相同,可能均为三倍体。
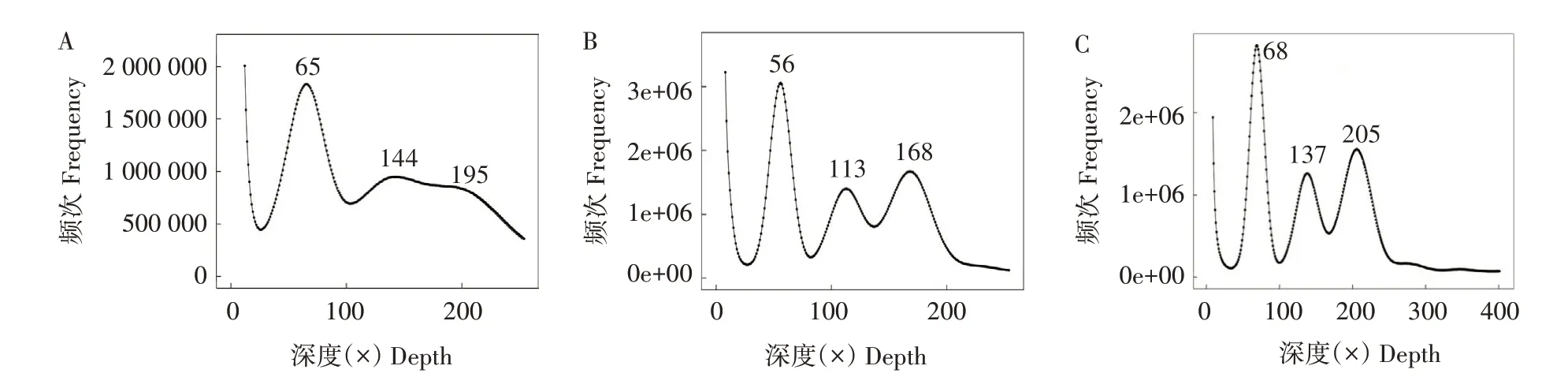
图2 3种粒型油莎豆材料K-mer深度分布Fig.2 The K-mer depth distribution of three tuber types ofC.esculentusL.
为了进一步验证油莎豆基因组倍性结果,利用醋酸洋红对6 个油莎豆材料的花粉进行染色,结果显示,6个材料的花粉中深红色花粉粒占比均不超过2%,且部分材料中大量出现了不规则状败育花粉粒(图3),说明6 个材料的花粉粒均高度不育,从侧面支持了基因组K-mer分析对油莎豆倍性的推断。

图3 6个油莎豆材料花粉粒醋酸洋红染色结果Fig.3 Staining results of pollen grains of sixC.esculentusL.materials with magenta acetate
2.3 油莎豆系统发育分析
基于ITS 和ETS 联合序列构建系统发育树(图4),发现6 个油莎豆材料(豫油莎1 号、豫油莎2号、豫油莎3 号、豫油莎5 号、YYS-4 和中油莎1 号)和从GenBank 下载的油莎豆聚为一支,称为油莎豆分支(BS=100%,PP=1)。在油莎豆分支中,豫油莎1号、豫油莎2 号和豫油莎5 号构成一个高支持率的小分支(BS=99%,PP=1),与中油莎1 号形成姐妹群,然后它们共同与豫油莎3号构成姐妹群。另外,油莎豆分支与香附子(C.rotundusL.)和头状穗莎草(C.glomeratusL.)构成的分支(BS=100%,PP=1)形成亲缘关系较近的姐妹群。

图4 基于ITS和ETS联合序列构建的油莎豆与近缘类群的系统进化树Fig.4 Phylogenetic tree ofC.esculentusL.and closely related species based on ITS and ETS concatenate sequences
油莎豆与头状穗莎草、香附子、碎米莎草(C.iriaL.)、长尖莎草(C.cuspidatusH.B.K.)等物种均为C4植物,共同构成C4分支(BS=100%,PP=1);而C3植物异型莎草(C.difformisL.)和褐穗莎草(C.fuscusL.)形成一支(BS=100%,PP=1),与C4分支构成姐妹群;畦畔莎草(C.haspanL.)位于莎草属基部。
3 结论与讨论
本研究中基因组Survey 分析结果表明,3 种代表粒型油莎豆材料中,YYS-4 基因组最大,其次是豫油莎3 号、豫油莎2 号,这与流式细胞仪分析结果的趋势相符,但具体数值小于流式细胞仪检测结果,大于ZONNEVELD[6]的结果。另外,根据K-mer分析结果,推测油莎豆为三倍体,油莎豆花粉粒高度败育的观察结果验证了该推测,但考虑到莎草科物种细胞学事件活跃,这一推论需要更多直接试验数据进行验证。
分子系统发育学是根据生物大分子包含的遗传信息建立系统发育树,推断生物有机体间的遗传与进化关系,进而明确属间或属下各分类群之间的关系[19]。本研究结果显示,6 个油莎豆材料间亲缘关系较近,互为姐妹类群。其中,豫油莎1 号、2 号亲缘关系最近,与豫油莎5 号、中油莎1 号稍远,再次为豫油莎3 号,YYS-4 与以上5 个材料的亲缘关系最远。另外,油莎豆与香附子和头状穗莎草的亲缘关系较近,这与LARRIDON 等[20]的研究结果一致。REN 等[21]基于叶绿体全基因组对13 个物种构建系统发育树,结果显示,在莎草属分支中,栽培种油莎豆和香附子聚为一小支且有很高的支持率,褐穗莎草、头状穗莎草和异型莎草聚为一小支且有很高的支持率,两小支形成姐妹群,并获得很高的支持率。在本研究结果中,6 个油莎豆材料聚为具有高支持率的一支,香附子与头状穗莎草聚为一小支,且有很高的支持率,并与油莎豆形成姐妹群,获得很高的支持率;但褐穗莎草和异型莎草聚为一小支且有很高的支持率,与油莎豆亲缘关系较远。本研究结果与REN 等[21]的结果有所差异,可能的原因有两点。首先,所选类群有差异。REN 等[21]选用的莎草属物种仅有5 个,而本研究选取了河南省主栽油莎豆品种4 个、特色种质2 个及莎草属的其他物种7 个。其次,用于构建系统发育树的序列不同。REN 等[21]选用的是叶绿体全基因组,而本研究选用的是核基因片段(ETS 和ITS)。叶绿体基因组进化速率适中,且为单亲遗传;而核基因能够提供更多的信息位点,且为双亲遗传,有助于发现进化过程中的杂交和多倍化事件。然而,核基因序列为多拷贝,且存在致同进化不完全现象,导致不同拷贝间的序列有差异,限制了其在系统发育研究中的应用。因此,不同的基因有不同的特点,结合多基因构建系统发育树会获得更全面准确的结果。另外,莎草属物种进化历史复杂,进化过程中发生了多倍化、基因渐渗等现象[22]。因此,结合多种手段的分析结果才能真实地反映油莎豆与近缘野生种的系统发育关系。
