痰标本分枝杆菌培养阳性患者血双因子(IFN-γ和IL-2)检测结果的分析
2023-03-22李月水于桥爱唐柳生廖家吉李世立
李月水,于桥爱,唐柳生,廖家吉,李世立★
(1.广西壮族自治区胸科医院,广西 柳州 545005 ;2.柳州市妇幼保健院,广西 柳州 545001)
目前,结核病的确诊主要依赖于病原学和分子生物学检测,分枝杆菌培养阳性可作为诊断结核分枝杆菌(MTB)感染和非结核分枝杆菌(NTM)感染的重要依据。有研究指出,在我国有部分肺结核患者得不到病原学诊断,只能根据临床症状被认定为疑诊对象,这对于控制结核病的传播是一大阻碍[1]。当人体感染结核分枝杆菌后,体内会出现特异性效应T 淋巴细胞。致敏的T 淋巴细胞在体外再次受到结核分枝杆菌特异抗原的刺激时,会分泌并释放IFN-γ。本文对2022年1 月—6 月到我院就诊且痰标本分枝杆菌培养阳性患者检测的血液双因子(IFN-γ 和IL-2)结果进行回顾性分析,现报道如下。
1 资料与方法
1.1 一般资料
收集2022 年1 月—6 月到我院就诊且痰标本经分枝杆菌培养分离出结核分枝杆菌的患者456 例(MTB 组)和非结核分枝杆菌感染患者75 例(NTM 组)为研究对象。MTB 组:男338 例,女118 例;年龄13 ~91 岁,平均54.8 岁。NTM 组:男46 例,女29例;年龄18 ~88 岁,平均60.9 岁。
1.2 仪器与试剂
双因子(IFN-γ 和IL-2)检测试剂盒由广州迪澳医疗科技有限公司提供,罗氏培养基、抗酸染液和鉴定培养基(TCH 和PNB)由珠海贝索公司提供,pH 6.8的磷酸盐缓冲液和 6% 的 NaOH 消化液等相关试剂均为本室按《结核病诊断细菌学检验规程》配制[2],培养箱由上海智诚有限公司提供。
1.3 方法
1.3.1 血液前处理 1)采集4 ~6mL 的肝素抗凝全血,稀释于4mL 1640 培养基中,再倾斜45°缓缓加入提前准备的4mL 的淋巴分离液离心管中,1000g 离心20 分钟。2)离心分离出PBMC 细胞如云雾状,随后吸取云雾状细胞层到另一支重新准备的15mL 离心管中,并提前加入1640 培养基至8mL,随后混匀。离心机600g 离心7 分钟。3)弃上清液并混匀沉淀,加1640 培养基至6mL 混匀,350g 离心7 分钟。4)弃上清液并加500μL AIM-V 培养基配置适宜浓度的细胞悬液。5)每一例标本设置3 孔分别为:阴性对照孔N,刺激蛋白孔T,阳性对照孔P;提前:N 孔加50μL AIM-V,T 孔加50μL 刺激蛋白,P 孔加50μL 阳性刺激物;每个孔加入100μL 细胞悬液,以37°及适宜湿度的5% 二氧化碳培养箱孵育16 ~20 小时。
1.3.2 ELASA 酶联免疫实验 取出培养好的样本,吸取上清液利用双抗夹心法进行ELISA 检测,得到原始OD 值,再将数据导入该试剂盒的判读软件中进行判读。IFN-γ 的T-N(刺激蛋白的刺激值减去阴性对照的差值)≥7pg/mL 为阳性;IL-2 的T-N ≥20为阳性;IFN-γ 的T-N <7pg/mL,P-N( 阳性刺激物的刺激值减去阴性对照的差值) ≥35pg/mL 为阴性;IL-2 的T-N <20,P-N ≥130pg/mL 为阴性。
1.3.3 分枝杆菌培养 先用消化液将患者痰液进行消化15min 后加缓冲液中和,3000r/min 离心30min 后取沉淀0.2mL 接种于罗氏培养基中, 斜放 24 小时后置于 37℃的孵育箱中进行培养,阳性后经萋尼氏染色确定为抗酸杆菌再用鉴定培养基(TCH 和PNB)进行初步菌种鉴定,TCH 培养基有菌生长或无菌生长而PNB 培养基无菌生长判断为结核分枝杆菌,TCH培养基和PNB 培养基均有菌生长判断为非结核分枝杆菌。质控标准菌株为H37RV。
1.4 统计学处理
采用SPSS19.0 统计软件进行统计分析。计数资料以率表示,组间比较采用χ² 检验;以P<0.05为差异有统计学意义。不同方法检测结果的一致性用kappa 检验判别,kappa ≥0.75 表示具有高度一致性,kappa ≥0.4 且<0.75 表示具有较好一致性,kappa <0.4 表示具有较差一致性。
2 结果
MTB 组 中 检 测 出IFN-γ+、IL-2+ 双 阳 性234例、IFN-γ+、IL-2- 单阳性160 例、IFN-γ-、IL-2+单阳性5 例、IFN-γ-、IL-2- 双阴性57 例,阳性占比87.5%(399/456);NTM 组中检测出IFN-γ+、IL-2+ 双阳性22 例、IFN-γ+、IL-2- 单阳性15 例、IFN-γ-、IL-2+ 单阳性1 例、IFN-γ-、IL-2- 双阴性37 例,阳性占比50.7%(38/75)。双因子(IFN-γ和IL-2)检测结果与分枝杆菌培养结果的一致率为81.3%(436/531)。MTB 组与NTM 组间的差异有统计学意义(χ²=59.98,P<0.01)。详见附表。
256 例IFN-γ+、IL-2+ 双阳性患者中,有结核分枝杆菌感染234 例,占90.6% ;175 例IFN-γ+、IL-2- 单阳性患者中,有结核分枝杆菌感染160 例,占91.3% ;6 例IFN-γ-、IL-2+ 单阳性患者中,有结核分枝杆菌感染5 例,占83.3% ;94 例IFN-γ-、IL-2- 双阴性患者中,有结核分枝杆菌感染57 例,占60.6%(399/437)。以分枝杆菌培养法为金标准,双因子(IFN-γ 和IL-2)检测法诊断结核分枝杆菌感染的特异度为50.7%, 敏感度为87.5%,阳性预期值为91.3%,阴性预期值为39.4%;kappa 检验,K=0.33,两者具有较差一致性。详见附表。
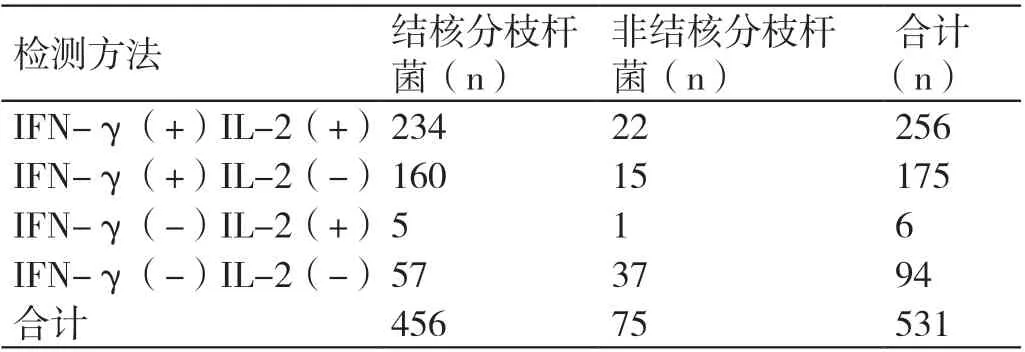
附表双因子(IFN-γ 和IL-2)检测与痰标本分枝杆菌培养阳性结果的比较
3 讨论
肺结核是结核分枝杆菌感染肺部引起的疾病。大多数结核分枝杆菌存在于肺部病灶坏死组织中,患者痰液中含有一定量的结核分枝杆菌,通过痰液分枝杆菌培养可以诊断患者是否患有结核病。当结核分枝杆菌感染人体后,人体主要依靠细胞免疫清除结核分枝杆菌,机体CD4+辅助性T1 淋巴细胞(Thl 细胞) 与CD8+细胞毒性T 淋巴细胞(CTL 细胞)是主要的效应细胞。由CD4+Thl 细胞产生的Thl 细胞因子是抗结核感染的重要因子,其中γ-干扰素(IFN-γ)与白细胞介素(IL)-2 是两种典型的Thl 细胞因子,在结核分枝杆菌感染后这两种细胞因子的水平会有所变化[3-5]。本研究显示双因子(IFN-γ 和IL-2)检测诊断结核分枝杆菌感染的阳性预期值为91.3%,敏感度为87.5%,说明大多数情况下通过IL-2 与IFN-γ 的检测可以反映由结核分枝杆菌致敏后的Thl 细胞分泌的细胞因子水平,从而辅助诊断肺结核。
IFN-γ 是重要的细胞免疫因子, 可增强宿主抵御结核分枝杆菌感染的能力, 具有促进T 淋巴细胞增殖、激活单核巨噬细胞、改善细胞免疫功能等作用[6-7]。IL-2 则是免疫调节因子,可以促进T 细胞增殖、促进B 细胞分泌抗体等,其免疫调节作用属于免疫细胞增殖与应答调节的中心环节[8]。但单个因子IFN-γ 或IL-2 检测,无法区分活动性结核和潜伏感染,其阳性结果对临床诊断结核病的帮助不大,更多的意义在于阴性排除,但其特异度有限,在排查过程中,也易出现假阳性情况,临床需要更好的免疫手段来进行结核病的辅助诊断。本研究显示双因子(IFN-γ 和IL-2)检测的相关特异度仅为50.7%, 这印证了此观点。双因子(IFN-γ 和IL-2)检测技术是将人外周血单个核细胞与融合蛋白SAT6-CFP10-Rv1985c 在细胞培养板上共培养,结核病患者体内的结核特异性 T 细胞由于记忆反应而分泌IFN-γ 和IL-2 因子,再利用酶联免疫吸附法,检测培养上清中的IFN-γ 和IL-2 的浓度,来判断其是否存在结核分枝杆菌特异性的细胞免疫反应。如果双阳性:IFN-γ+、IL-2+,表明样本中存在针对结核分枝杆菌的特异性细胞免疫反应,警示可能存在活动性结核病。如果单阳性:IFN-γ+、IL-2-/IL-2+、IFN-γ-,表明样本中存在针对结核分枝杆菌的特异性细胞免疫反应,提示结核感染。本研究MTB 组中检测出IFN-γ+、IL-2+ 双阳性234 例、IFN-γ+、IL-2- 单阳性160 例、IFN-γ-、IL-2+ 单阳性5 例,说明在456 例分枝杆菌培养结果为结核分枝杆菌阳性的患者中,有51.3%(234/456)的患者通过双因子(IFN-γ 和IL-2)检测结果得到活动性结核病警示,有87.5%(399/456)的患者得到结核感染提示。
当样本被污染、实验操作不当或堪萨斯分枝杆菌、海氏分枝杆菌和苏尔加分枝杆菌等存在交叉反应时,检验结果可能出现假阳性。文中75 例分枝杆菌培养结果为NTM 的患者中,有50.7% 的患者出现双因子(IFN-γ 和IL-2)检测阳性〔其中IFN-γ+、IL-2+ 双阳性22 例、IFN-γ+、IL-2- 单阳性15 例、IFN-γ-、IL-2+ 单阳性1 例〕,相关阴性预期值仅为39.4%。有资料报道,宫颈病变、肿瘤与IFN-γ 和IL-2也呈一定的相关性[9-12]。因此,当双因子(IFN-γ 和IL-2)检测阳性结果与临床诊断不符时,应参照分枝杆菌培养结果进行鉴别诊断,不能将双因子(IFN-γ和IL-2)检测作为治疗或其他临床管理的唯一依据,应结合患者的临床症状/ 体征、病史、其他实验室检查结果及治疗反应等情况综合考虑[13-15]。
文中456 例分枝杆菌培养结果为结核分枝杆菌阳性的患者中,有12.5%(57/456)的患者出现双因子(IFN-γ 和IL-2)检测阴性。原因可能是检测者为陈旧性肺结核患者[16]、淋巴细胞功能异常[16]、实验操作不当、免疫功能受损或者发生 Hook 效应等,是否属实,需要进一步的研究和探讨。
通过双因子(IFN-γ 和IL-2)检测,解决了临床过去存在的一些难以解决的难题,根据相关研究,特异性T 淋巴细胞分泌的IL-2 与IFN-γ 可以区分结核感染的不同阶段,IL-2 能够作为一种合适的生物标记物用来区分结核感染患者的不同临床阶段[1,17]。“双阳”结果能够高度警示“活动性结核”,提高活动性结核和菌阴结核病的检出率,提高非结核人群中的鉴别诊断特异性,有助于预测结核菌被激活为活动性病变的风险,但双因子(IFN-γ 和IL-2)检测容易出现假阴或假阳性结果,通过 kappa 检验,kappa值仅为0.33, 一致性较差。经分析,kappa 值较低的主要原因是NTM 样本检测结果与临床诊断不相符,本研究中将NTM 作为对照组,而双因子检测中对感染堪萨斯分枝杆菌(M.kansasii),苏尔加分枝杆菌(M.szulgai),海氏分枝杆菌 (M.marinum) ,戈登分枝杆菌(M.gordonae) 时,可能存在交叉影响,直接导致部分NTM 的检测结果不准确。
综上,双因子(IFN-γ 和IL-2)检测结果阳性不能作为结核病确诊证据,应进一步进行结核病的医学及诊断评估(如细菌抗酸染色涂片及培养、胸部X光等)。但双因子(IFN-γ 和IL-2)检测结果,一方面能够很好地用于结核感染的排除,另外一方面,通过单阳向双阳的变化,可以在一定程度上预测结核菌活动性病变的风险,还能为患者的治疗过程提供监控依据。
