还原谷胱甘肽对成纤维滑膜细胞中内脂素的影响
2023-03-22郝文婷任义乐
尚 辰,郝文婷,任义乐
(徐州市第一人民医院,江苏 徐州 221000)
类风湿关节炎(Rheumatoid arthritis,RA)是一种典型的慢性自身免疫性疾病,其特征是关节呈进行性对称性破坏并伴有全身炎症反应[1]。该病与几种代谢性疾病和心血管疾病等共病高度相关[2]。值得注意的是,先天性危险因素(如遗传、性别和年龄)和获得性危险因素(如肥胖、吸烟和创伤)与RA 的分解代谢及炎症过程有关[3-5]。几种脂肪来源的细胞因子,如瘦素、脂联素和内脂素在局部或全身水平的紊乱,对RA 的炎症和分解代谢改变起着重要作用[3]。其中内脂素是一种新型的脂肪因子,已有研究发现其是炎症和代谢过程中的关键调控因子。内脂素也被称为烟酰胺磷酸核糖基转移酶(NAMPT),是哺乳动物中烟酰胺腺嘌呤二核苷酸(NAD+)生物合成补救途径中的限速酶。NAD+ 是一种普遍存在的参与氧化还原反应的辅酶,在氧化应激条件下,需要增加NAD+ 的再生,因此,内脂素作为NAD+ 代谢的调节因子在基本细胞过程中占有关键地位[6]。谷胱甘肽(GSH)是人体内最重要的抗氧化物质,前期研究[7]已证明GSH可能通过降低成纤维滑膜细胞中的活性氧(ROS)水平进一步抑制炎症因子的释放,本试验进一步研究其对脂肪因子中内脂素的影响。
1 材料与方法
1.1 实验对象
MH7A 细胞系(购自上海观道生物科技有限公司);健康清洁级雌性DBA/1J 小鼠14 只(购自常州卡文斯实验动物有限公司),7 ~8 周龄。
1.2 试剂与仪器
GSH(北京索莱宝科技有限公司);牛Ⅱ型胶原(Chondrex 公司,货号:2002-2);弗氏完全佐剂(含卡介苗,CFA,Chondrex 公司);弗氏不完全佐剂(不含卡介苗,IFA,Chondrex 公司);1640 培养基(SH30265.01,美国Hyclone);低糖DMEM 培养基(SH30021.01B,美国Hyclone);胎牛血清(FBS,10100147,美国Gibco);青- 链霉素溶液(15140,美国Gibco);内脂素ELISA 试剂盒(eBioscience 公司);逆转录试剂盒(日本Takara Bio Inc.);荧光定量PCR 仪(ABI7500)。
1.3 胶原诱导关节炎(CIA)模型制备
将14 只雌性DBA/1J 小鼠随机分为CIA+PBS 组、CIA+GSH 组。将牛Ⅱ型胶原与CFA 等体积混合乳化制成混悬乳剂,在无菌条件下以每只0.1 mg 的剂量在小鼠尾根部皮下注射,首免当日记为1 d。在21 d将牛Ⅱ型胶原与IFA 等体积混合乳化,再次注射于小鼠尾根部皮下,剂量同前。CIA+GSH 组自第1 d 至第50 d 通过灌胃给予500 mg/kg GSH,CIA+PBS 组同时每日给予等量PBS 灌胃处理。所有小鼠均正常饲养于无特定病原体(SPF)环境。
1.4 小鼠骨髓来源单核巨噬细胞(Bonemarrowderivedmacrophages,BMDM)分离培养
首免50 d 后处死两组小鼠,取出后肢股骨及胫骨,剥离骨表面肌肉和软组织,去除股骨和胫骨骨骺端,将骨髓从骨髓腔中冲出,制成细胞悬液。以1640 完全培养基(1640 培养基+10% FBS+1% 青-链霉素溶液+10% L929 细胞培养上清)重悬细胞后种于6 孔板中。细胞贴壁后直至其长满,每3 d 换液1 次,此时的贴壁细胞为BMDM。
1.5 转录组学测序
将BMDM 细胞送往广州基迪奥生物科技有限公司进行转录组学测序,提取总RNA,并质检合格,建立文库。获得原始测序短序列,经过滤得到短序列Clean Reads 为有效数据。采用DESeq2 软件进行差异表达分析(P<0.05),筛选出两组间差异表达基因(Differentially expressed genes,DEGs),进行基因本体(Gene ontology,GO)功能显著性富集分析。
1.6 MH7A 细胞分组
将MH7A 细胞分为PBS 组、GSH 组(GSH 100 μg/mL)、LPS(100 ng/mL)组、GSH+LPS 组,处理24 h 后收集细胞以及细胞上清。
1.7 收集MH7A 细胞,按照Trizol 试剂的说明书从中提取总RNA
测定RNA 浓度后每个样本取1 μg 进行反转录。反转录体系和试验方法参照说明书。根据SYBR说明书进行后续的实时定量PCR(qPCR)检测内脂素、瘦素、脂联素。内脂素上、下游引物序列分别为5’-CGACTCCTACAAGGTTACTCACTATAAAC-3’和 5’-CTTCTCAAGAATGTAGTTCCATCCC-3’,瘦 素 上、 下 游 引 物 序 列 分 别 为5’-TGGTTTCATTTCTACTGTGACTGATG-3’ 和5’-TCCTAAGCAATTGCAGAAGATAAG-3’, 脂 联素上、下游引物序列分别为5’-CCCCAACATGC-3’和5’-TACACCTGGAGCCAGACTTGG-3’。得到CT值,以GAPDH 为内参,用2-ΔΔCt 计算分析mRNA相对表达量。
1.8 ELISA 检测细胞上清中内脂素的表达情况
根据eBioscience 公司生产的ELISA 检测试剂盒说明书检测细胞上清内脂素的表达情况。
2 结果
2.1 GSH 干预对LPS 诱导的MH7A 成纤维滑膜细胞中内脂素、瘦素、脂联素、抵抗素mRNA 表达的影响
我们采用RT-PCR 检测细胞内脂素、瘦素、脂联素、抵抗素mRNA 表达,结果显示与LPS 组相比,LPS+GSH 组细胞中内脂素、瘦素、脂联素、抵抗素mRNA 水平均显著下降(P<0.05)。见图1。
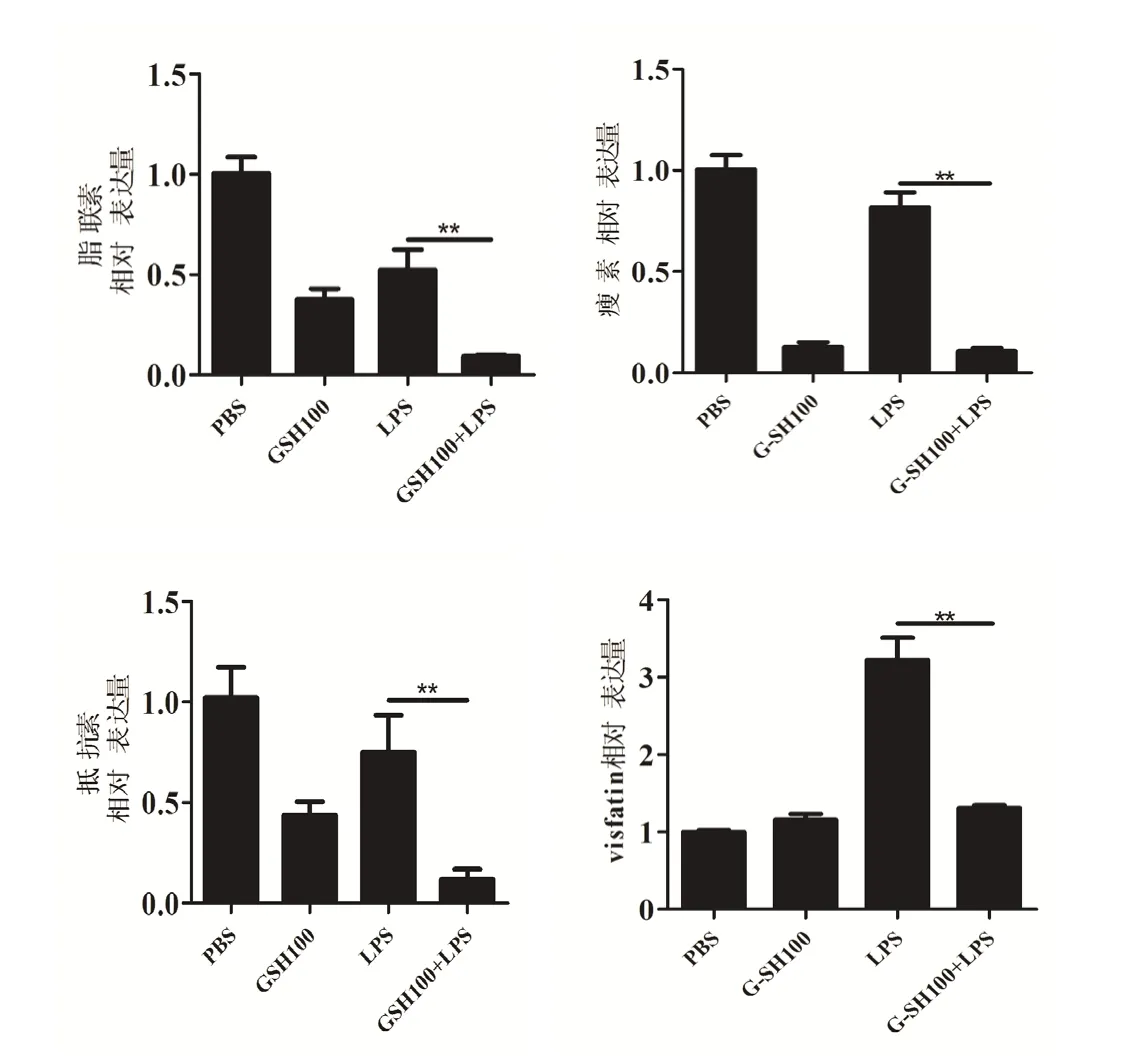
图1 GSH 干预对LPS 诱导的MH7A 成纤维滑膜细胞中内脂素、瘦素、脂联素、抵抗素mRNA 表达的影响
2.2 GSH 干预对MH7A 成纤维滑膜细胞上清内脂素蛋白表达的影响
与LPS 组相比,LPS+GSH 组的细胞上清内脂素蛋白水平显著降低。见图2。

图2 GSH 干预对MH7A 成纤维滑膜细胞上清内脂素蛋白表达水平的影响
2.3 GSH 干预对CIA 鼠BMDM 内脂素mRNA表达的影响
GSH 干预对CIA 鼠BMDM 内脂素mRNA 表达的影响见表1。

表1 CIA+GSH vs CIA+PBS 差异基因
3 讨论
在过去的几年中,有研究表明代谢因素特别是脂肪组织和脂肪细胞产生的大量脂肪因子,参与了RA的炎症过程。脂肪因子相互作用,部分相互诱导,形成脂肪因子网络,对滑膜炎症以及软骨、骨侵蚀起到一定的促进作用[8]。本研究发现,相比于正常对照组,LPS 刺激MH7A 细胞后多种脂肪因子表达升高,如内脂素、瘦素、脂联素、抵抗素,这与既往的研究结果相一致。给予GSH 干预后可显著下调脂肪因子的表达。GSH 能够改变脂肪因子表达的原因可能是基于其生物学特性。GSH 是由谷氨酸、半胱氨酸和甘氨酸组成的一种三肽,含有巯基(-SH),它是甘油醛磷酸脱氢酶的辅基,又是乙二醛酶及丙糖脱氢酶的辅酶,参与体内三羧酸循环及糖代谢。GSH 广泛分布于机体各器官内,它是多种酶的辅酶,能激活多种酶,影响糖、脂肪、蛋白质的代谢,为维持细胞的生理功能提供能量[9]。本研究中我们进一步研究了GSH 干预对内脂素表达的影响。内脂素是一种新型的脂肪因子,是炎症和代谢过程的关键调控因子[4]。它又被称为NAMPT,是细胞质中NAD+ 前体的催化物,也是哺乳动物特异性NAD+ 挽救途径中的限速酶。内脂素的催化活性促使烟酰胺(NA)在细胞质中合成烟酰胺单核苷酸(NMN)。NMN 随后被转运到线粒体,通过NMN 腺苷转移酶(NMA)转化为NAD+。NAD+及其磷酸化形式NADP 被认为是其作为普遍信号传导和能量分子的生命必需品。内脂素对NAD+ 的调控意味着任何NAD+ 依赖的基本过程,如细胞氧化还原电位、氧化应激、聚合酶、环化酶和蛋白表达、细胞黏附或衰老都可以通过内脂素调控。
有一项荟萃分析研究[10]和几项独立研究[11-18]表明RA 患者血清以及外周血中单个核细胞可表达更高的内脂素,内脂素基础水平与抗环瓜氨酸肽抗体和RA 放射学进展呈正相关。此外,在初治RA 患者中还观察到血清内脂素水平与疾病活动性相关。有学者在RA 动物模型中研究了内脂素抑制剂FK866 的作用,发现通过药理抑制消耗内脂素可以降低RA 的严重程度和炎症因子的分泌[19]。本研究中我们发现与对照组相比,LPS 组的MH7A 细胞中内脂素mRNA 水平以及细胞上清内脂素蛋白水平均升高,而通过GSH干预可明显下调细胞中内脂素mRNA 以及细胞上清的内脂素蛋白水平。NAD(P)+/NAD(P)H 和GSH/GSSG 是人体重要氧化还原对,炎症激活期间产生的ROS 可诱导细胞中的DNA 损伤,导致NAD+ 池的消耗,NAD+ 维持糖酵解通量和炎症功能需要通过激活NAMPT 进行补救[20]。而我们给予GSH 干预,提高了细胞的抗氧化能力,降低了ROS 水平,从而下调了NAMPT 的表达。我们在CIA 大鼠模型中的实验结果也验证了经GSH 干预,巨噬细胞中的内脂素明显下降。结合我们此前的研究结果——GSH 可下调MH7A细胞中白细胞介素-6(IL-6)、肿瘤坏死因子-α(TNF-α)、基质金属蛋白酶-3(MMMP-3)等的表达,我们推测GSH 可能部分通过降低内脂素的表达从而调控炎症。但其机制需要进一步研究,深入探讨GSH参与RA 发生的详细机制,有望为新型靶点药物的研发提供新视角。
