冠突散囊菌对酒曲糖化能力的影响及其机制研究
2023-03-22杨凤英秦洋
杨凤英,秦洋*
1(邵阳学院 食品与化学工程学院,湖南 邵阳,422000) 2(生态酿酒新技术与应用湖南省高校重点实验室(邵阳学院),湖南 邵阳,422000)
高粱、糯米、小麦、大米、玉米作为五粮型白酒酿造的主要原料,高含量的支链淀粉直接影响白酒的产量[1]。所以提高出酒率、糖化效率是酿酒工作的重点[2],对白酒生产具有重要意义。
酒曲微生物区系分为霉菌(糖化)、细菌(产香)和酵母菌(发酵),其中根霉属为起到糖化作用的主要微生物[3]。通过适宜的方式提高酒曲糖化能力,是当前研究热点之一。研究显示,冠突散囊菌(Eurotiumcritatum)能够分泌淀粉酶,将淀粉分解为小分子糖,供自身生长,且生长条件与霉菌相似[4]。这一生物学性质为E.critatum与根霉属的协同糖化提供了重要的理论依据。此外,E.critatum作为一种益生菌,具有抑菌、降血糖、抗氧化等功效[5-6]。然而,在食品发酵领域,主要应用于茶叶、谷类等发酵[5,7],在白酒酿造领域的研究鲜有报道。因此,利用E.critatum与根霉协同糖化并研究其影响机制,具有重要的意义及创新性。
糖化的本质是淀粉的水解[8]。因此,淀粉分子的一系列变化,包括直链淀粉比例、分子聚合度、晶体结构、微观形态等均能够直观地反映出糖化的效率[9-10]。随着现代分析手段的不断发展,从淀粉分子的系列变化分析糖化效率发生改变的作用机制,已成为不可或缺的分析手段。
本实验中,采用E.critatum与根霉协同糖化,通过添加E.critatum、酵母菌、根霉(以甜酒曲作为载体)和无菌水培养的酒曲,在相同条件下对粮醅进行糖化发酵。通过分析粮醅还原糖含量分析E.critatum对酒曲糖化能力的影响,并得出最佳的糖化工艺。同时,通过分析酒曲淀粉分子的系列变化分析E.critatum对酒曲糖化能力的影响机理,为E.critatum在白酒糖化发酵领域的应用奠定理论基础。
1 材料与方法
1.1 材料与试剂
原料:五粮,市售;制曲原料(小麦、稻壳等),湖南湘窖酒业股份有限公司。
菌种:E.critatum,北京北纳创联生物技术研究院;酿酒酵母,本实验室保存;甜酒曲(根霉菌约为1×106CFU/mL),安琪酵母股份有限公司。
96%直链淀粉、87.2%支链淀粉、聚甲基丙烯酸甲酯(polymethyl methacrylate, PMMA),北京中科质检生物技术有限公司;C6H12O6、NaOH、HCl,均为分析纯,上海康朗生物科技有限公司;DMSO试剂(色谱纯),南京化学试剂股份有限公司;察氏琼脂培养基,YPD培养基,杭州西顿生物科技有限公司。
1.2 仪器与设备
HR-T16M台式高速冷冻离心机,湖南赫西仪器装备有限公司;XD-3型X射线衍射仪、Tescan Mi-ra3扫描电子显微镜,上海永傲精密仪器有限公司;Epoch全波长酶标仪、1525型凝胶渗透色谱仪、2414检测器、Agilent PLgel 5 μm MIXED-C色谱柱,美国沃特世有限公司。
1.3 实验方法
1.3.1 实验室进行粮食预处理
选择无霉变的粮食,将玉米粉碎至20目,按照经典五粮配方[11],每份样品50 g粮食(干重),3组平行,进行温水润粮12 h,用纱布过滤水分,放入蒸锅中蒸2.5 h,将蒸好的粮食摊凉至35 ℃,装罐。
1.3.2 菌悬液的准备
将E.critatum在察氏琼脂培养基上活化,酵母菌在YPD培养基上活化,选取长势较好的单菌落,在液体培养基上扩培。分别在恒温振荡器上28 ℃、150 r/min培养5 d,30 ℃、150 r/min培养12 h得到实验菌种,最终E.critatum浓度约为(1×105CFU/mL),酵母菌浓度约为(1×106CFU/mL)。
1.3.3E.critatum与甜酒曲对粮醅糖化效率的影响
将30份100 g糯米浸泡12 h,用纱布过滤水分,蒸30 min,冷却至35 ℃装罐,分别加入5、10、15、20、25 mLE.critatum菌液,甜酒曲为0.4 g/100 g,3组平行,搅拌均匀,密封放置于培养箱,32 ℃培养糖化5 d,测定粮醅还原糖含量。
分别加入0.2、0.4、0.6、0.8、1.0 g/100 g甜酒曲,E.critatum菌液20 mL/100 g,方法同上进行糖化。
1.3.4 单因素试验
1.3.4.1E.critatum菌液添加量的确定
100 g空白曲中分别加入0、5、10、15、20、25 mLE.critatum菌液,酵母菌6 mL/100 g,甜酒曲2 g/100 g,水分含量44%,制成不同浓度的E.critatum的酒曲在曲房进行培养,分别取10 g曲粉到1.3.1粮食样品中,进行实验室酿酒实验,32 ℃发酵7 d,根据粮醅还原糖含量优选3个较好的E.critatum添加量进行后续响应面优化实验。
1.3.4.2 酵母菌液添加量的确定
酵母菌在白酒酿造过程中不可缺失,是白酒酿造微生物中重要的菌群之一。方法同上,分别加入0、2、4、6、8、10 mL/100 g酵母菌菌液,E.critatum15 mL/100 g,甜酒曲2 g/100 g,水分含量44%,根据粮醅还原糖含量优选3个较好的酵母菌液添加量进行后续响应面优化实验。
1.3.4.3 甜酒曲添加量的确定
传统酒曲中主要是根霉起到糖化作用,为了区分根霉的添加是否会影响E.critatum对酒曲的糖化能力。方法同上,分别加入0、0.5、1.0、1.5、2.0、2.5 g/100 g甜酒曲,E.critatum15 mL/100 g,水分含量44%,酵母菌菌液6 mL/100 g,根据粮醅还原糖含量优选3个较好的甜酒曲添加量进行后续响应面优化实验。
1.3.4.4 酒曲水分含量的确定
为了区分是菌种对酒曲本身还是水分含量的作用,方法同上,水分含量分别控制在26%、32%、38%、44%、50%、56%,E.critatum15 mL/100 g,甜酒曲2 g/100 g,酵母菌菌液6 mL/100 g,根据粮醅还原糖含量优选3个较好的水分含量进行后续响应面优化实验。
1.3.5 响应面分析实验
按表1制成不同的酒曲,方法同1.3.4,采用 Box-Behnken设计原理进行响应面分析实验。

表1 响应面实验因素水平表Table 1 Factors and levels of response surface experiment
1.3.6 粮醅还原糖含量和酸度测定方法
参照DB34/T 2264—2014《固态发酵酒醅分析方法》。
1.3.7 酒曲淀粉提取
酒曲浸泡2 h后打浆,浆液过80目筛,静置倒出上清液,沉淀用0.2%(质量分数)NaOH溶液[12]浸提搅拌4 h(料液比1∶5,g∶mL),倒出上清液,用纯水洗至清澈,4 000 r/min离心10 min,刮掉上层黄色物,洗涤沉淀重复离心3次,将淀粉沉淀在40 ℃下烘干24 h,过200目筛保存。
1.3.8 酒曲支/直链淀粉含量测定方法
参照焦梦悦等[13]的双标单波长法测支链淀粉含量,以吸光度为纵坐标,支链淀粉含量为横坐标,绘制标准曲线。标准曲线方程为y=-0.007 3x+0.795 7,R2=0.997 4。直链淀粉含量按公式(1)计算:
直链淀粉含量=100%-支链淀粉含量
(1)
1.3.9 酒曲淀粉分子质量分布测量
依次将分子质量为0、2%、4%、6%、8%、10%、12%、14%、16%、18%的PMMA标准品过柱并记录各自的保留时间。以分子质量(Da)为纵坐标,保留时间(min)为横坐标绘制标准曲线,标准曲线方程为y=-0.586 4x+13.059,R2=0.998 4,之后将待测淀粉样品溶解过柱,根据其保留时间按照标准曲线方程计算其分子质量分布。
凝胶渗透色谱(gel permeation chromatography, GPC)前处理方法:8 mg样品溶于4 mL DMSO试剂,溶解6 h,用0.45 μm滤膜过滤后上机测试。检测条件:Waters 2414示差检测器,色谱柱Agilent PLgel 5 μm MIXED-C,流动相为DMSO试剂,流速1 mL/min,2 mg/mL,进样50 μL,检测柱温35 ℃,检测35 min[14]。
1.3.10 酒曲淀粉微观结构
参照陈青[15]的方法进行测定。
1.3.11 酒曲淀粉结晶度
前处理方法:直接上机。操作条件为:起始角2θ为10°,终止角2θ为80°,扫描速度8 °/min,参照SUN等[16]的方法进行实验。
1.4 数据处理
运用SPSS Statistics 22软件进行数据处理分析,且每组实验重复3次(结果均以平均值±标准差表示)并进行相关性分析,应用Origin 2019画图。
2 结果与分析
2.1 E.critatum与甜酒曲对粮醅糖化效率的影响
如图1-a和图1-b所示,当甜酒曲添加量低于0.6 g/100 g时,E.critatum低于15 mL/100 g时,粮醅还原糖含量逐渐上升,由此可知,甜酒曲中的根霉与E.critatum具有良好的协同糖化作用,甜酒曲高于0.6 g/100 g时,E.critatum高于15 mL/100 g时,这种趋势不再明显,可能原因是E.critatum与根霉数量增加,在有限的O2和碳源条件下,不再进行糖化作用。所以,适宜的E.critatum与甜酒曲添加量在合适的条件下具有良好的协同糖化作用。

a-甜酒曲;b-E.critatum菌液图1 甜酒曲、E.critatum菌液对粮醅 还原糖含量的影响Fig.1 Effects on the reducing sugar content of fermented grains by Jiuqu and E.critatum
2.2 E.critatum对酒曲糖化能力的影响
图2-a结果显示,当E.critatum菌液添加量低于10 mL/100 g时,粮醅还原糖含量随E.critatum的增加而增加。可见在一定范围内,E.critatum有利于酒曲的协同糖化作用。当E.critatum添加量高于10 mL/100 g时,这种趋势不再明显。可能的原因是大量的菌液在培曲过程中需要足够的碳源,与细菌、酵母有一定的竞争关系[17],反而不利于E.critatum的生长繁殖[18]。糖化是在微酸性条件下进行,酸度过高不利于粮醅糖化,因此,较为理想的E.critatum添加量为10 mL/100 g。
2.3 酵母菌对酒曲糖化能力的影响
图2-b结果显示,当酵母菌液添加量低于4 mL/100 g时,酒曲在培养过程中,合适的酵母菌菌液增加与霉菌的生长与代谢保持较高的协同性,酒曲具有良好的糖化能力,还原糖含量增加。当酵母菌液添加量高于4 mL/100 g时,这种趋势不再明显,可能的原因是过量的酵母菌在酒曲培养过程中将小分子糖发酵为酒精[19],抑制酒曲中糖化作用的微生物生长,发酵的粮醅酸度缓慢上升,还原糖逐渐下降[20]。所以适当添加酵母有利于酒曲培养过程中酵母、根霉的相互适应及良好生长。因此,较为理想的酵母液添加量为4 mL/100 g。
2.4 甜酒曲对酒曲糖化能力的影响
如图2-c所示,当甜酒曲添加量低于1.0 g/100 g时,粮醅还原糖含量随甜酒曲的增加而增加。可见在一定范围内,根霉菌有利于酒曲的协同糖化作用。当甜酒曲添加量高于1.0 g/100 g时,这种趋势不再明显,粮醅酸度随着甜酒曲的增加而增加。可能的原因是酸度过高不利于E.critatum与根霉菌的糖化,粮醅还原糖含量缓慢降低[21]。因此,较为理想的甜酒曲添加量为1.0 g/100 g。

a-E.critatum菌液;b-酵母菌液;c-甜酒曲;d-酒曲水分含量图2 E.critatum菌液、酵母菌液、甜酒曲、水分含量对粮醅还原糖含量和酸度的影响Fig.2 Effects of E.critatum liquid, yeast liquid, Jiuqu and water content on the reducing sugar content and acidity of fermented grains
2.5 水分对酒曲糖化能力的影响
图2-d结果显示,当水分含量低于38%时,粮醅还原糖含量随水分含量的增加而增加。可见在一定范围内,水分有利于酒曲中糖化作用微生物生长,有利于酒曲的协同糖化作用。当水分含量高于38%时,这种趋势不再明显。可能的原因是水分含量过高时,微生物生长缓慢。水分含量过低时曲坯中水分散失过快,不利于微生物的生长代谢活动[22]。粮醅酸度变化与还原糖含量变化趋势一样,因此,较为理想的水分含量为38%。
2.6 响应面分析结果
2.6.1 响应面结果
由响应面优化设计得出最佳还原糖含量的计算如公式(2)所示:
还原糖含量=6.54-0.21A+0.46B+0.41C-0.48D+0.092AB-0.62AC+0.47AD+0.22BC+0.24BD-0.40CD-1.81A2-0.80B2-0.90C2-1.00D2
(2)
2.6.2 方差及可信度分析
由表2可知,模型差异极显著;失拟项差异不显著。4个因素均对响应指标粮醅还原糖含量具有显著影响,对粮醅还原糖含量的影响程度大小为D>B>C>A。Pred R2与Adj R2差值小于0.2。F值越大,说明两两交互作用越好,AC两两交互作用最佳,其次为AD。图3结果与响应面二次模型方差分析结果一致。坡度相对陡峭,表明响应值对于处理条件的改变非常敏感。
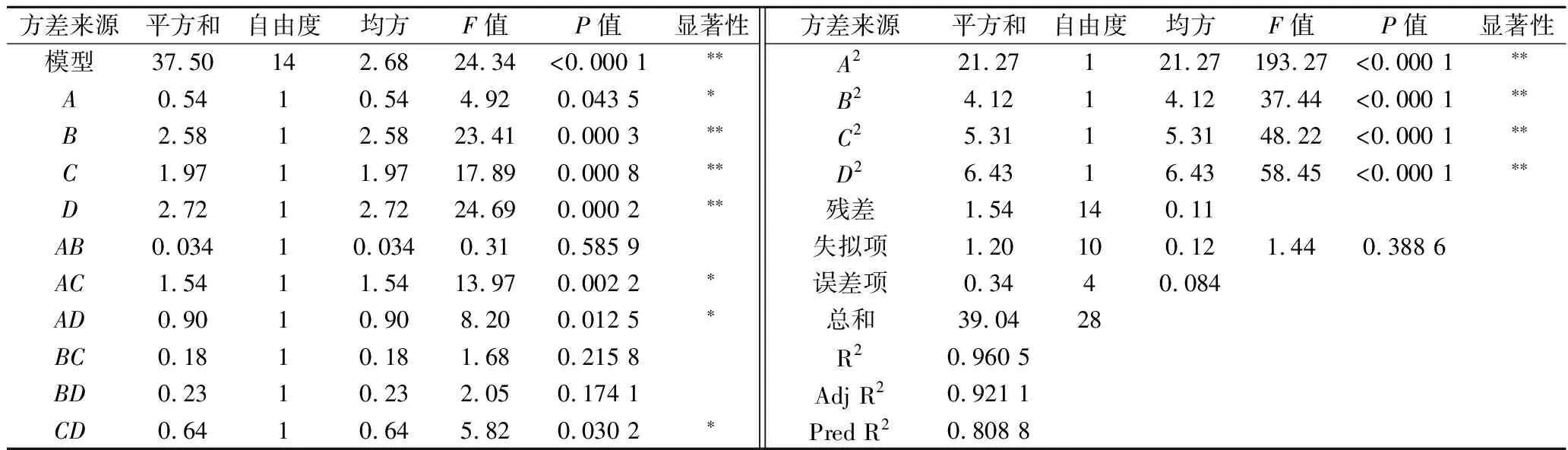
表2 回归模型的方差分析及显著性结果Table 2 Analysis of variance and significance results of regression model

图3 AC和AD因素交互作用对还原糖含量 影响的响应曲面Fig.3 Response surface of the interaction of AC and AD factors on reducing sugar content
2.6.3 验证实验
通过Design-Expert 10软件进行数据分析,得到酒曲的最优条件:考虑实际生产条件,最佳发酵条件调整添加量为酵母菌为3.68 mL/100 g,E.critatum为11.43 mL/100 g,甜酒曲为1.692 g/100 g,水分为36.08%。进行3次验证实验,实验粮醅还原糖含量为(6.95±0.25) g/100 g,与模型预测值差异不大。
因此,由上述实验结果可知:E.critatum有助于酒曲的协同糖化,提高了粮醅糖化效率。
2.7 E.critatum对酒曲直链淀粉含量的影响
通过研究优化组酒曲淀粉(样品A)与传统酒曲淀粉(样品B)的系列变化分析E.critatum对酒曲糖化能力的作用机制。
由1.3.8计算出样品A、样品B和制曲原料小麦支链淀粉含量分别为(57.26±1.49)%、(60.49±1.44)%、(67.74±1.54)%;直链淀粉含量分别为(42.74±1.11)%、(39.51±1.39)%、(32.26±1.24)%;支直比分别为1.34∶1、1.53∶1、2.10∶1。
在E.critatum对酒曲直链淀粉含量的影响下。样品A的支链淀粉含量相对于小麦降低了10.48%,比样品B降低了3.23%,样品A直链淀粉含量相对于小麦增加了,比样品B高。支链淀粉被酶水解为直链淀粉,淀粉的支直比越低,表明支链淀粉含量水解程度越高[23]即冠突散囊菌促进了淀粉分子的水解作用。酒曲作为投粮产生作用,可以提高粮食利用率[24]。可见,E.critatum有利于酒曲的协同糖化作用。
2.8 E.critatum对酒曲淀粉分子质量分布的影响
由表3可知,样品A淀粉分子质量0.2×105~1.0×105Da的占比为64%,B占比为59%;淀粉分子质量20 000 Da以下样品A占比为25%,B占比为30%。说明样品A淀粉分子质量分布越小,越集中。B平均分子质量为96 930 Da,A为94 325 Da,平均分子质量比B小,表明小分子淀粉含量增加。由2.7可知,样品A的直链淀粉含量比B高,可以推测经过E.critatum对酒曲的协同糖化作用后,部分大分子淀粉被水解而导致淀粉平均分子质量降低[25],说明实验组酒曲将淀粉大分子水解的能力比传统酒曲强。
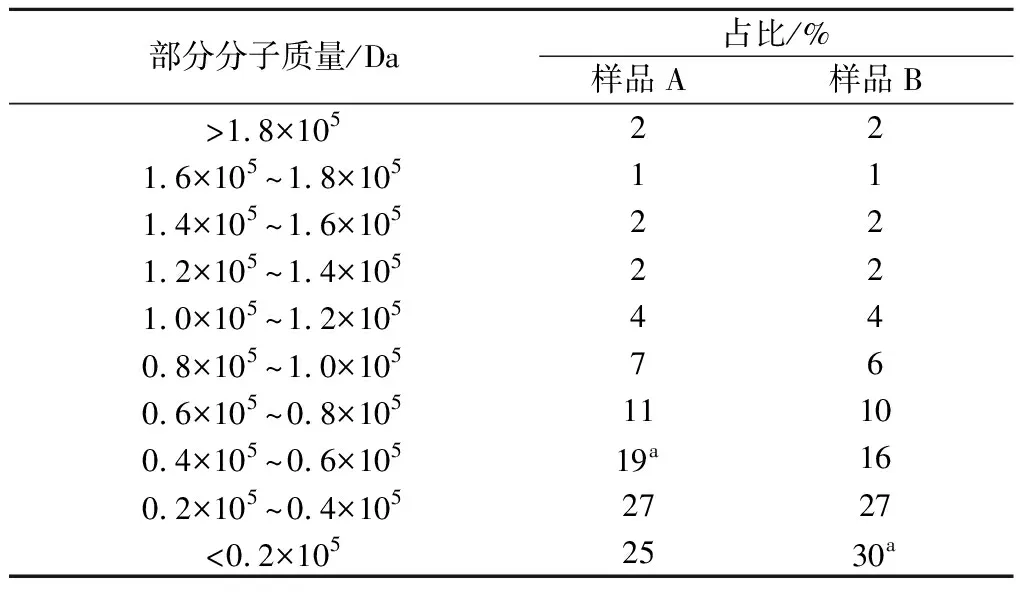
表3 实验组酒曲(样品A)与传统酒曲(样品B)的 淀粉GPC结果Table 3 GPC results of experimental group Jiuqu starch (sample A) and traditional Jiuqu starch (sample B)
2.9 E.critatum对酒曲淀粉微观结构的影响
由图4可知,两者淀粉分子呈扁圆形、不规则形态,直径在20 μm左右,小于10 μm淀粉颗粒表面比较光滑。样品A大多数淀粉上有裂纹,裂纹处有大凹痕和小孔,样品B淀粉上有少许凹痕,相对于A,淀粉B比较圆润,小颗粒淀粉占比多于A,由GPC数据得出,样品A淀粉分子质量分布小于B,比B集中,与扫描电镜结果符合。从2.7得知,样品B直链淀粉含量比A低[26],直链淀粉处于淀粉颗粒内部,支链淀粉分布在外层,A淀粉表面支链淀粉被分解为小分子淀粉,说明E.critatum对酒曲的协同糖化会对淀粉颗粒有分解作用。

a-实验组酒曲;b-传统酒曲图4 酒曲的淀粉扫描电镜图Fig.4 SEM photographs of Jiuqu starches
2.10 E.critatum对酒曲淀粉结晶度的影响
如图5所示,样品A和B淀粉的X-射线衍射均在2θ为15°、17°、18°、20°、23°、27°出现峰值,A在2θ为27°峰比较明显,有研究发现小麦粉的淀粉在2θ为15°、17°、18°、23°出现峰值,小麦淀粉结晶度是20%~23%[27]。样品A淀粉的结晶度为17.96%,B淀粉的结晶度为18.92%,相对于小麦淀粉结晶度有所降低,可能原因是B小颗粒淀粉占比多于A,A直链淀粉含量高,造成结晶度低,所以E.critatum对酒曲的协同糖化可以促进支链淀粉的水解,使直链淀粉增加,淀粉结晶度与直链淀粉含量相关[28],淀粉颗粒上的裂纹导致A淀粉结晶度减弱,减少了结晶面积[29]。
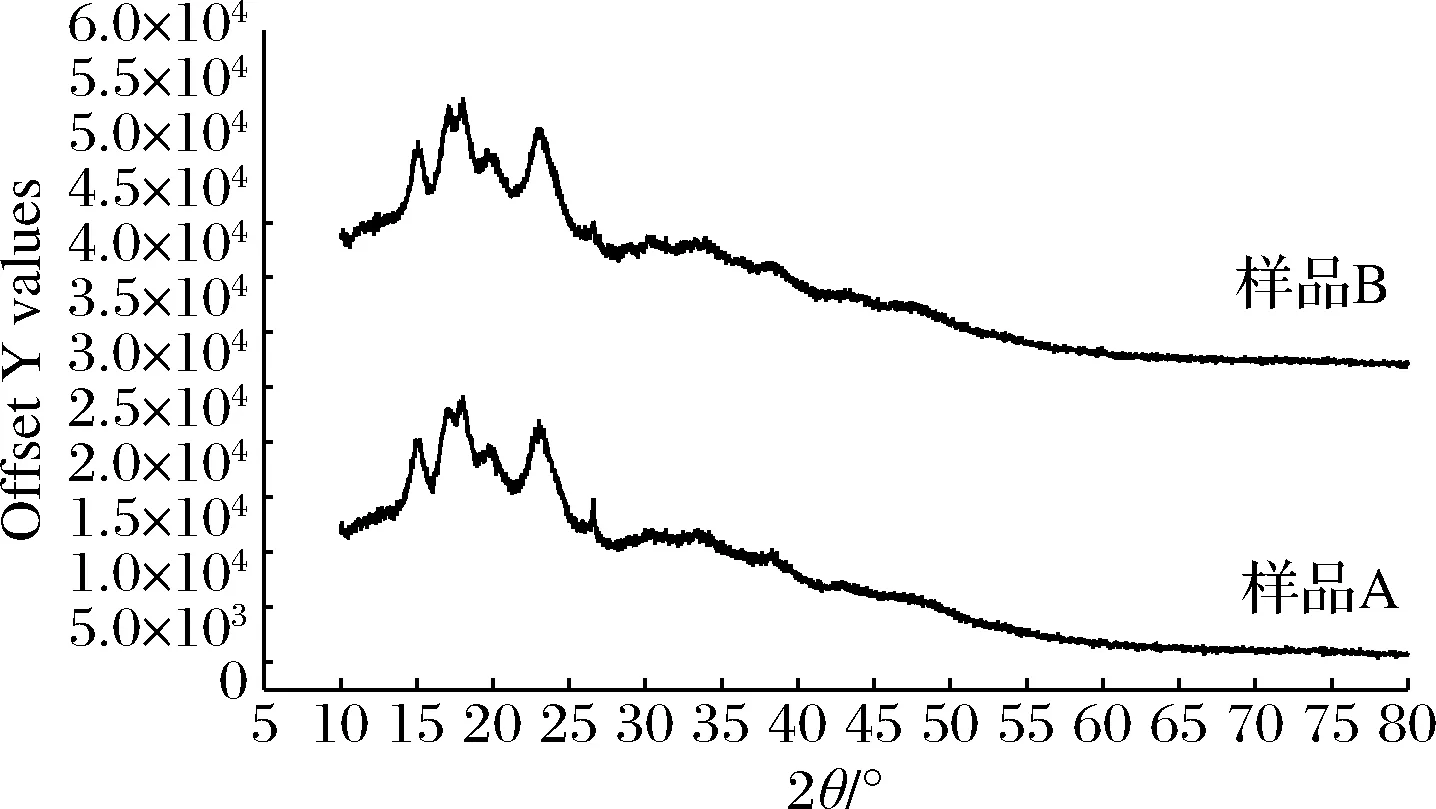
图5 酒曲淀粉X-衍射图Fig.5 XRD curves of Jiuqu starches
综上,实验组A的直链淀粉含量增加,淀粉平均分子质量减少,扫描电镜图显示高含量的直链淀粉和淀粉颗粒上的裂纹造成了A淀粉结晶度比B结晶度低,E.critatum对酒曲的协同糖化作用明显比传统酒曲水解支链淀粉能力增强,糖化作用增强。
3 结论
本研究结果显示,E.critatum可以提高粮醅的还原糖含量,提高酒曲的糖化效率,最佳条件为酵母菌添加量为3.68 mL/100 g,E.critatum添加量为11.43 mL/100 g,甜酒曲添加量为1.692 g/100 g,酒曲水分含量为36.08%;添加有E.critatum的实验组酒曲直链淀粉含量增加,GPC显示淀粉分子质量降低,扫描电镜图淀粉结构变化明显,X-衍射结晶度降低,晶体结构明显,这些现象表明淀粉分子表达了E.critatum与根霉协同糖化下的作用机理。
本实验培曲条件有限,培曲的量与实际培曲有差别,采用的是实验室酿酒实验,没有进行工业化,但是得到的结果比较明显,后续可基于E.critatum的糖化机理,作用于其他酒曲和白酒工业化生产,以提高酒曲糖化能力,并提高粮食利用率和出酒率。