pH-DO组合调控策略提高小白链霉菌ε-聚赖氨酸的生物合成
2023-03-22吴梦萍王靓张建华张宏建陈旭升
吴梦萍,王靓,张建华,张宏建,陈旭升*
1(江南大学,生物工程学院,江苏 无锡,214122)2(工业生物技术教育部重点实验室(江南大学),江苏 无锡,214122)
ε-聚赖氨酸(ε-poly-L-lysine,ε-PL)是一种天然均聚氨基酸,由25~35个L-赖氨酸(L-lysine,L-lys)单体通过α-COOH和ε-NH2脱水缩合而成[1]。作为一种广谱的阳离子抗菌肽,ε-PL可以破坏革兰氏阳性/阴性细菌、酵母菌等真菌的细胞包膜结构,从而抑制微生物的生长。目前,ε-PL已被日本、韩国、美国和中国等国家批准作为食品防腐剂。此外,ε-PL具有良好的水溶性、对环境与人类无公害以及可生物降解性等极具商业价值的特性,因此被广泛应用于食疗剂、干扰剂、酶保护剂、药物载体等领域[2]。然而,作为一种主要由链霉菌生产的次级代谢产物,ε-PL产量较低,限制了其工业化生产及商业应用。
pH和溶解氧(dissolved oxygen, DO)是影响ε-PL发酵最主要的限制因素。一般来说,pH可以通过改变细胞膜的表面电荷来影响营养物质的有效性和酶活性,从而影响细胞活力[3]。KAHAR等[4]发现ε-PL产生的最适pH为4.0,而pH>5对细菌菌丝生长更有利。基于此,该团队建立了两阶段pH调控策略,将产量从5.7 g/L提高到48.3 g/L,提高了7.47倍。REN等[5]发现短时的酸性pH冲击可以促进菌体快速地生长及ε-PL的大量合成,随后建立了pH冲击工艺,将ε-PL产量提高了52.5%,达到54.70 g/L。此外,由于ε-PL发酵为好氧发酵且发酵液的黏度较高,限制了DO在扩大发酵时的传递效率。为了解决这个问题,XU等[6]在补料分批发酵过程中,外源添加了氧载体(0.5%正十二烷),提高了发酵液中DO浓度,将产量提高了31.6%。随后,该团队通过过表达透明颤菌的血红蛋白基因(vgb),提高了StreptomycesalbulusPD-1发酵的氧气摄取能力,将ε-PL提高至34.2 g/L,增加了50%[7]。然而,以往研究主要集中在ε-PL发酵前期(前36 h)对pH和DO的单独优化,很少有策略对pH与DO进行同时优化。
在前期的工作中,本团队经过多轮诱变与核糖体工程选育,筛选出一株高产菌StreptomycesalbulusWG-608,其摇瓶ε-PL产量较出发菌提高了42.3%[8]。该菌株在发酵进入稳定期后,出现了葡萄糖消耗速度大幅下降、菌体生长受到明显抑制的现象,进而影响了ε-PL的单位菌体合成能力。基于此,本研究开发了一种新的pH-DO组合调控策略,分阶段对pH和DO进行系统优化,显著提高了WG-608的单位菌体合成能力与ε-PL产量。随后,研究了WG-608的细胞生理变化,包括关键酶活性、呼吸链活性和胞内核苷酸水平,以阐明pH-DO组合调控策略对细胞代谢的影响。
1 材料与方法
1.1 实验材料
1.1.1 菌种
StreptomycesalbulusWG-608由出发菌S.albulusM-Z18经多轮诱变及核糖体工程获得,并由本实验室保藏[9]。
1.1.2 培养基与溶液
种子发酵培养基(g/L):葡萄糖40,酵母粉8,(NH4)2SO45,K2HPO42,MgSO4·7H2O 0.5,FeSO4·7H2O 0.03,ZnSO4·7H2O 0.04,用NaOH调pH至7.2。
发酵培养基(g/L):葡萄糖60,酵母粉8,(NH4)2SO45,K2HPO42,MgSO4·7H2O 0.5,FeSO4·7H2O 0.03,ZnSO4·7H2O 0.04,消泡剂0.2,pH 6.8。
流加培养基(g/L):葡萄糖750,氨水12.5%(体积分数,下同),(NH4)2SO4375,消泡剂100。
100 mmol/L Tris-HCl:2.4228 g Tris和0.0308 g二硫苏糖醇(dithiothreitol, DTT, 1 mmol/L)溶于20%甘油并定容至200 mL,再用浓HCl调pH至7.5。
1.1.3 主要试剂与仪器
葡萄糖(优级纯),山东西王药业有限公司;酵母粉,Oxoid公司;其他试剂,均为分析纯,国药化学试剂有限公司;ATP、NAD(P)H试剂盒,上海碧云天生物技术有限公司;碘硝基氯化四氮唑蓝(iodonitrotetrazolium chloride, INT),上海源叶生物科技有限公司;BCA蛋白测定试剂盒,宝日医生物技术(北京)有限公司。
5 L发酵罐,上海保兴生物设备有限公司;UV-2100分光光度计,优尼科仪器有限公司;AB204-N分析天平,瑞士梅特勒公司;GNP-9160恒温培养箱,上海光都仪器设备有限公司;3K15高速冷冻离心机,德国Sigma公司;HYL-C组合式摇床,太仓市强乐设备有限公司;SW-CJ-1FD超净工作台,苏州安泰空气技术有限公司;SM-650D超声破碎仪,南京舜玛仪器设备有限公司;Biotek多功能酶标仪,美国伯腾仪器有限公司。
1.2 实验方法
1.2.1 培养条件
一级种子液培养,取孢子接种于种子培养基,置于30 ℃,200 r/min摇床培养24 h。
二级种子液培养,将6.4 mL种子液接入含80 mL种子培养基的500 mL锥形瓶中,30 ℃,200 r/min培养24 h。
5 L发酵罐ε-PL恒定pH补料分批发酵,在5 L罐中装入3.2 L发酵培养基灭菌,设置发酵罐温度30 ℃,初始转速200 r/min,曝气率1.14 vvm,pH 6.8,共发酵240 h。接种240 mL种子液入发酵罐,随着发酵的进行,发酵pH自然下降,当pH降至4.0时,补加12.5%的氨水溶液将pH控制在4.0,直至发酵结束。通过调整转速和通气量,使DO尽量维持在30%,当发酵液葡萄糖浓度<10 g/L时,根据葡萄糖的消耗速率设定补料速率,补加的葡萄糖溶液质量浓度为750 g/L。当罐内的NH4+-N质量浓度低于0.2 g/L时,补加375 g/L的(NH4)2SO4溶液,使其维持在0.1~0.5 g/L,直至发酵结束。
1.2.2 分析方法
1.2.2.1 发酵过程参数测定方法
葡萄糖浓度测定方法:将发酵液样品离心后取一定量的上清液,使用生物传感分析仪(biosensor analyzer,SBA)缓冲液稀释100倍,充分混匀后进行检测并读数;NH4+-N浓度测定方法:取发酵液离心后的上清液,稀释一定比例后,通过靛酚蓝反应法测定[9]。发酵液的ε-PL浓度由甲基橙比色法测定[10];菌体干重(dry cell weight, DCW)由滤纸差量法测定[11]。
1.2.2.2 生理参数测量
粗酶液的制备参照王靓[12]的方法加以改进:取发酵液1 000×g离心5 min,弃上清液;0.2 g/L KCl溶液洗涤3次,弃上清液重悬于100 mmol/L Tris-HCl(pH 7.5)缓冲液;超声破碎仪在60%功率下破碎细胞20 min(工作2 s,停2 s),12 000×g离心20 min,上清液即为粗酶液,蛋白浓度测定参照BCA蛋白测定试剂盒。
酶活力测定方法:(1)葡萄糖-6-磷酸脱氢酶(glucose-6-phosphate dehydrogenase, G6PDH)活性测定参照TANG等[13]的方法并加以改进,100 mmol/L Tris-HCl缓冲液350 μL,0.4 mmol/L NADP+18 μL,5 mmol/L葡萄糖-6-磷酸7 μL,粗酶液50 μL;定义1U为30 ℃条件下每分钟1 μmol/L NADP+转化为NADPH所需的酶量。(2)磷酸烯醇式丙酮酸羧化酶(phosphoenolpyruvate carboxylase, PEPC)活性测定参照BRAMWELL等[14]的方法并加以改进,100 mmol/L Tris-HCl缓冲液235 μL,1 mmol/L乙酰CoA 25 μL,40 mmol/L MnSO450 μL,100 mmol/L NaHCO350 μL,1.5 mmol/L NADH 50 μL,20 mmol/L磷酸烯醇式丙酮酸20 μL,500 U/mL苹果酸脱氢酶10 μL,粗酶液10 μL,定义30 ℃条件下反应1 min催化生成1 μmol NAD+所需的酶量为1个酶活力单位;(3)柠檬酸合酶(citrate synthase, CS)活力参照MURAKAMI等[15]的方法, 100 mmol/L Tris-HCl缓冲液235 μL,6.7 mmol/L 5,5′-二硫代双(2-硝基苯甲酸)[5,5′-dithiobis-(2-nitrobenzoic acid), DTNB] 10 μL,200 mmol/L草酰乙酸二钠5 μL,1 mmol/L乙酰CoA 25 μL,定义30 ℃条件下反应1 min催化生成1 μmol柠檬酸-CoA所需的酶量为1个酶活力单位;(4)天冬氨酸激酶(aspartokinase, AK)活力参照曾昕[17]的方法,3 mol/L pH 7.0盐酸羟胺-KOH 50 μL,100 mmol/L ATP 50 μL,100 mmol/L MgSO450 μL,3 mol/L (NH4)2SO4100 μL,50 mmol/L天冬氨酸-KOH 40 μL,粗酶液50 μL。定义30 ℃条件下反应1 min催化生成1 μmol天冬氨酰-β-羟肟所需的酶量为1个酶活单位;(5)PLS活性参考YAMANAKA等[16]的方法,100 mmol/L Tris-HCl(pH 8.0)400 μL,100 mmol/LL-lys 100 μL,50 mmol/L ATP 100 μL,50 mmol/L MgCl2溶液100 μL,50 mmol/L DTT 100 μL,粗酶液200 μL,酶活定义为30 ℃条件下1 s催化减少1 pmolL-lys所需的酶量。
电子传递链的测量方法参照曾昕[17]的方法,在30 ℃条件下反应,100 mmol/L pH 7.5 Tris-HCl缓冲液60 μL,0.835 mmol/L NADH 15 μL,0.24 mmol/L NADPH 15 μL,0.133 mol/L丁二酸钠 30 μL,1 g/L曲拉通30 μL,4 mmol/L INT 30 μL,粗酶液50 μL,测定490 nm处吸光度。细胞电子传递活性按公式(1)计算:
(1)
式中:φ,细胞电子传递链活性,μL O2/(h·g蛋白);系数60可将反应时间分钟换算成小时;ΔA490,反应时间内的吸光度变化值;V总,反应体系总体积,μL;1.42,INT接受O2电子比例;Δt,反应时间,min;V酶,酶液加入量,μL;H液,反应体系的光径,nm。
ATP和辅因子测量:分别按照ATP检测试剂盒、NADPH检测试剂盒和NADH检测试剂盒进行检测。
1.2.3 数据分析
实验重复2~3次,结果表示为平均值±标准差。采用GraphPad prism 8.0对实验数据进行统计学分析,数据间的比较分析采用无交互作用的双因数方差分析(Two-way ANOVA)中的Bonferroni’s检验,显著性水平设定为0.05;作图采用OriginPro 9.1软件。
2 结果与讨论
2.1 S.albulus WG-608在恒定pH策略下的5 L罐发酵
在之前的研究中,经多级诱变、基因组改组及核糖体工程育种获得1株WG-608,其摇瓶的产量达到3.7 g/L,较出发菌M-Z18提高了48%[18]。在5 L罐中对WG-608进行了恒定pH 4.0补料-分批发酵,并研究其发酵特性。
如图1-a,pH在发酵10 h后快速下降,在24 h前降至pH 4.0,并维持至发酵结束。接种后DO快速下降,当其降至30%左右,通过调节转速和通气量将其维持在30%左右。
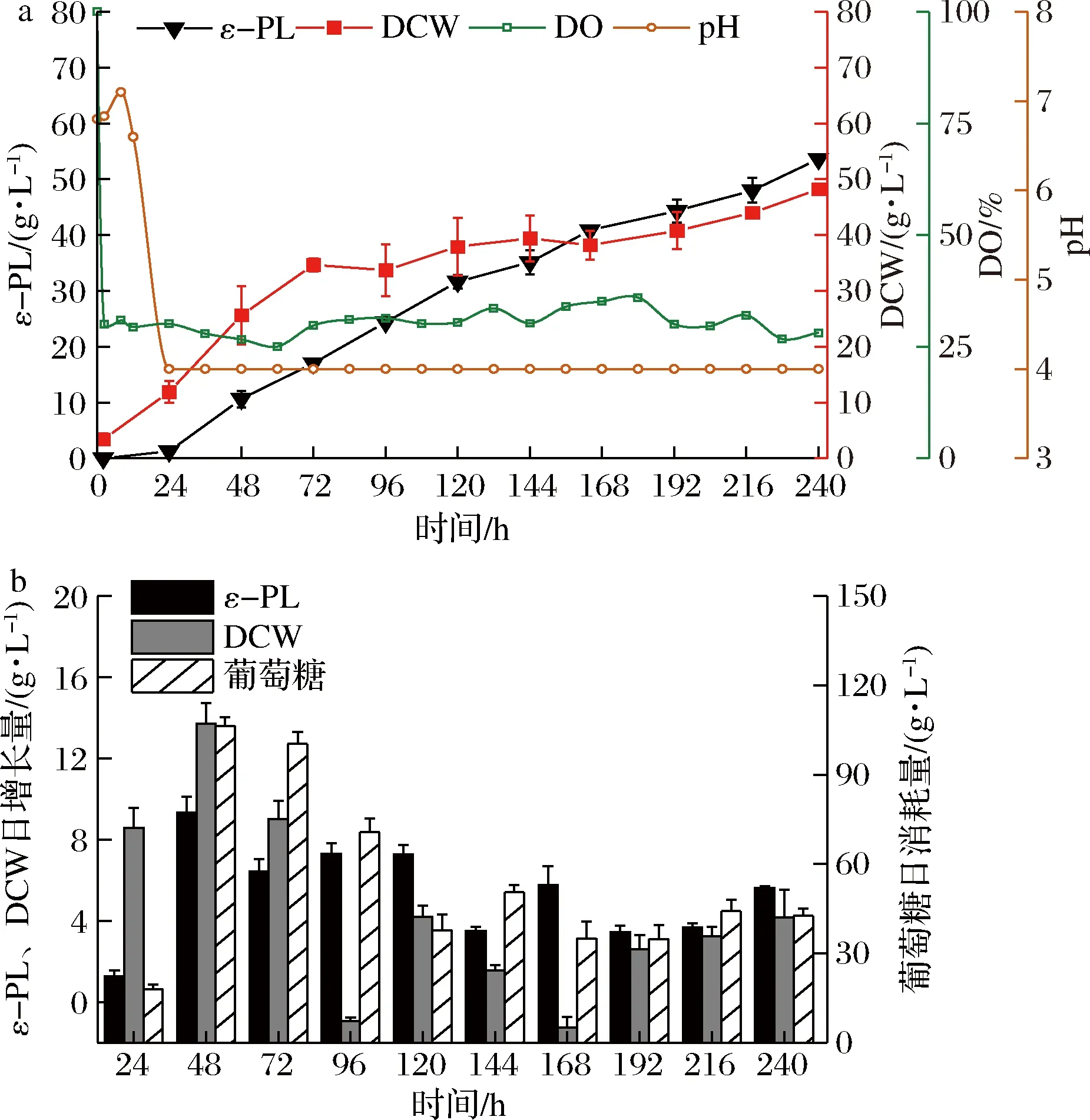
a-ε-PL发酵过程情况;b-ε-PL日增长量、 菌体日增长量和葡萄糖日消耗量图1 恒定pH补料-分批发酵Fig.1 Constant pH fed-batch fermentation
在整个发酵过程中,葡萄糖的质量浓度维持在1~10 g/L,以避免底物抑制。观察到葡萄糖的消耗速度在0~72 h快速增加,而72 h后开始显著下降。与之对应,菌体干重在前72 h内达到了39.57 g/L,而在72~240 h之间仅增长了9.59 g/L(图1-b)。ε-PL在整个发酵过程中持续快速积累,这意味着ε-PL属于生长半耦联型产物,其产量既受菌体的生长影响,还与菌体质量浓度相关。经240 h的补料分批发酵,ε-PL达到(53.63±0.78) g/L。
以上结果表明,发酵后期(72 h后)WG-608的底物葡萄糖消耗与菌株生长均受到了强烈抑制。发现ε-PL的合成受pH 和DO的影响十分显著,故将发酵过程划分为2个阶段,即菌体生长期(0~72 h)和产物合成期(72~240 h)。通过对pH和DO的系统优化,探索每个发酵阶段最适合的发酵条件,以期进一步提高WG-608的ε-PL合成能力。
2.2 pH对S.albulus WG-608发酵ε-PL的影响
研究表明,ε-PL仅在酸性培养条件下大量积累[16],但pH过低会抑制菌体的生长[19]。为了确定pH对高产菌WG-608生产ε-PL的影响,将pH分别控制在3.7、4.0、4.3和4.6,于5 L发酵罐内进行了72 h的补料分批发酵。如表1所示,pH值对菌体干重和ε-PL产量有显著影响。随着pH值的增加,菌体量逐渐增加,与KAHAR等[4]的结果类似。当pH为4.0时,ε-PL的产量达到最大值16.65 g/L,分别比pH 3.7,4.3和4.6提高了11.1%、10.9%、33.4%。此外,较低(3.7)或较高的pH(4.6)均不利于ε-PL的生产。这可能是由于当pH维持在3.7发酵时,细胞生长受到抑制(平均比生长速率最低),进而限制了ε-PL的合成。pH 4.6时,底物的消耗主要用于菌体的快速积累,此时ε-PL的产量和单位菌体合成能力最低,分别为12.48 g/L和0.57 g/g。

表1 不同pH条件下WG-608生产ε-PL的情况Table 1 Comparison of ε-PL production by S.albulus WG-608 under different pH levels
在ε-PL发酵中,pH 4.0有利于胞内大量积累ATP,进而激活ε-PL合成酶的表达及调节其催化功能[16, 20]。然而,长时间的酸性环境导致ATP被大量消耗用以维持细胞稳态,不利于菌丝体的生长,继而影响ε-PL的合成[4, 21]。本研究发现虽然WG-608在pH 4.0时ε-PL浓度达到最大值,但其实pH 4.0与4.3条件下的菌体量、产量和单位菌体合成能力相差不大(表1)。鉴于pH 4.3时菌株表现出更强的菌体生长能力,因此选择在72 h后(发酵稳定期)将pH维持在4.3,以缓解酸性环境对菌体生长和ε-PL合成造成的不利影响[12]
2.3 DO对ε-PL补料分批发酵的影响
小白链霉菌发酵生产ε-PL属于好氧发酵,发酵罐内的DO水平对菌体生长和产量都有显著影响[6]。一般来说,发酵液中较高的DO条件有利于增强碳源的利用效率,增大碳代谢通量,从而提高发酵生产效率[22]。然而过量的DO水平也可能会导致胞内活性氧的过量积累,从而引起细胞氧化应激作用,最终导致细胞提早衰亡[23]。对于生物发酵过程,其不同阶段的最适DO存在差异,因此在不同的发酵阶段按需供氧显得十分必要[24]。
根据2.1中WG-608的恒定pH发酵特征,将240 h发酵过程中的DO分为2个阶段进行优化,即菌体生长期(0~72 h)和产物合成期(72~240 h)。
2.3.1 DO对菌体生长期ε-PL发酵的影响
在pH 4.0的条件下,将发酵罐内DO分别控制在20%、30%、40%,于5 L罐内进行72 h的分批-补料发酵。结果表明,DO维持在40%时,产量和DCW均达到最高,分别为19.30和39.77 g/L(表2)。说明该阶段ε-PL合成的最适DO为40%。因此,选择40%的DO水平作为菌体生长期的最适DO。

表2 菌体生长期DO对WG-608 ε-PL 产量的影响Table 2 Effect of dissolved oxygen on ε-PL production by S.albulus WG-608 during the growth period
2.3.2 DO对产物合成期ε-PL发酵的影响
基于2.3.1的实验结果,将0~72 h的DO控制在40%,将72 h后的DO分别维持在10%、20%、30%,以探索发酵后期DO对ε-PL发酵的影响。图2表明,将发酵后期的DO控制于20%,菌体量和产量均达到最高,分别达到57.13 和66.24 g/L。因此在产物合成期确定DO控制于20%更有利于小白链霉菌生产ε-PL。

a-菌体干重(DCW);b-ε-PL产量图2 不同DO条件下WG-608产物合成期生产ε-PLFig.2 ε-PL production by S.albulus WG-608 under different dissolved during the production synthesis period
2.4 pH-DO组合调控策略的建立
综合上述结果,建立了pH-DO组合调控策略。整个策略分为2个阶段,第一阶段(0~72 h),pH从6.8自然下降并维持在4.0,同时DO从初始的100%下降并维持在40%;第二阶段(72~240 h),DO控制在20%,pH控制于4.3。图3-a显示,经pH-DO组合策略调控,WG-608的DCW在72 h经短暂的停滞后,持续增长,这与原始策略显然有很大的不同(图1)。随着菌体生长速率的增加,ε-PL的产量积累明显高于对照策略。最终经240 h的发酵,ε-PL产量与平均比合成速率分别可达(68.77±2.53) g/L和(2.33±0.08) d-1,较原始策略分别提升了28.23%和12.02%(表3)。

表3 不同策略对WG-608生产ε-PL的影响Table 3 Effect of ε-PL production by S.albulus WG-608 under different fermentation strategy

a-ε-PL发酵过程情况;b-菌体比生长速率;c-ε-PL比合成速率;d-葡萄糖消耗量图3 pH-DO组合策略生产ε-PLFig.3 The ε-PL production by pH-DO combination strategy注:图中相同时段恒定pH和pH-DO组合调控策略之间的差异,以*表示0.01 图3-b显示,在0~72 h,pH-DO组合调控策略的日平均比生长速率显著高于对照策略,而72 h后2种策略之间无显著差异。而对于日平均比合成速率而言,pH-DO组合调控策略则在72 h后(除168 h)显现出了明显优势。此外,对2种策略下2个阶段葡萄糖的消耗总量进行统计(图3-d),结果发现在发酵第一阶段(0~72 h)的2种策略下的葡萄糖消耗总量无显著差异,而第二阶段(72~240 h),pH-DO组合调控策略的糖耗较原始策略显著提高,由315.5 g/L增长到528.8 g/L,增加了67.6%,葡萄糖转化率也提高了6.7%。以上结果说明,pH-DO组合调控策略主要通过前期增加单位菌体的合成速率,而后期增加对葡萄糖的消耗和单位菌体合成能力,最终提高了WG-608的ε-PL产量。 HUANG等[3]探究了菌体生长和产物合成的pH和DO差异的分析,发现菌体生长和产物合成的最佳pH和DO存在差异,因此建立了2阶段pH和DO控制策略,将菌体的生长和产物的合成分为2个阶段进行调控,最终使MortierellaalpinaCCFM698的总脂肪酸和二十碳五烯酸的产量提高了10.7%和26.6%,与本文研究结果相似。尽管如此,pH-DO组合调控提高ε-PL产量的原因仍不清楚。 2.5.1 pH-DO组合策略对ε-PL合成途径的关键酶活性的影响 2.4中分析了2种策略的基本发酵参数的差异,发现经pH-DO组合调控策略,WG-608对底物消耗显著增加,推测该策略可能通过影响ε-PL的合成代谢,提高了对底物的摄取和利用。L-lys是ε-PL合成途径中的唯一前体,据报道,用于L-赖氨酸合成的碳骨架主要通过糖酵解途径、回补反应、磷酸戊糖(pentose phosphate, PP)途径和三羧酸(tricarboxylic acid,TCA)循环提供。因此,对不同发酵时期的4种关键酶,PEPC、G6PDH、CS、AK的活性进行检测和分析,以进一步了解pH-DO组合调节对ε-PL合成和细胞生长的影响。 G6PDH是糖酵解途径进入磷酸戊糖途径(PP途径)的关键限速酶,其活性决定了PP途径代谢通量的大小。由图4-a可知G6PDH的活性在48 h显著提高,在其余时段也相对更高,这与2.4中在DO 40%期间比生长速率显著提高一致。说明在pH-DO调控策略下,流入PP途径的碳通量明显增加,为WG608菌体的生长与L-lys的合成提供了更多的戊糖和NADPH。对胞内NADPH水平的检测也印证了这一推测(图5-a)。由于在pH-DO组合调控策略下细胞生长更好,PP途径的增强似乎是一种对细胞生长需求的响应。 a-G6PDH;b- PEPC;c-CS;d- AK;e-PLS图4 pH-DO组合策略与恒定pH策略下关键酶活性的比较Fig.4 Comparison of key enzyme activities of metabolic pathways with pH-DO strategy and constant pH strategy TCA循环是能量代谢的中枢,也是细胞提供ATP和FADH2的主要途径。CS是草酰乙酸进入TCA循环的第一个酶。图4-c可知,随发酵的进行,2种策略中的CS的变化趋势基本一致。96 h后pH-DO策略中的CS活性显著提高,这可能驱动TCA循环产生更多的 NADH 和 FADH2,并通过呼吸链和氧化磷酸化途径合成更多的ATP。此外,增强的TCA循环可以为L-lys的生物合成提供更多的前体草酰乙酸(oxaloacetic acid, OAA)。TCA循环的许多其他中间代谢物,如柠檬酸和α-酮戊二酸,也是碳水化合物、脂质或氨基酸生物合成的重要前体。总之,pH-DO策略增强了TCA循环的代谢通量,为快速合成ε-PL和菌体量补充了足够的能量和前体。 回补反应是PPC(PEP+CO2+ADP→OAA)补充OAA消耗的另一个重要途径。从图4-b可以看出,pH-DO组合调控策略中,PPC的活性高于对照组,可以为L-lys的合成回补更多的OAA前体。AK是L-赖氨酸生物合成中的关键酶。96 h后pH-DO策略中的AK活性也明显更高(图4-d),表明pH-DO的组合调节明显增强了L-赖氨酸合成途径的代谢通量,从而促进了L-lys和ε-PL的合成。 PLS在2种发酵工艺中的变化趋势较为一致,在96 h前逐渐升高至最大值,随后开始降低。然而,pH-DO组合调控策略的发酵后期酶活力仍保持着相对较高的活力,这与2.4中产物比合成速率的趋势较为一致,PLS在后期保持着较高水平的酶活力,这可能是pH-DO策略下发酵后期的比合成速率更高的原因。以上结果表明,经过pH-DO组合调控策略通过增强WG-608在整个发酵过程中的代谢活力和碳代谢通量,促进细胞摄取了更多的底物,以提高ε-PL的产量。 2.5.2 pH-DO组合策略对胞内辅因子的影响 大量研究证明,NAD(P)H是胞内氧化还原反应的重要辅因子,有利于胞内氧化还原的平衡,促进细胞的生长和NAD(P)H依赖性产物的合成,而1分子的L-lys的合成就需要消耗4当量的NADPH[25]。此外,PLS在利用前体L-lys合成ε-PL的过程中需要消耗大量ATP,且高浓度的ATP可以激活PLS的活性[16]。因此,胞内辅因子的浓度对L-lys与ε-PL的合成具有很大影响。在2.5.1的结果中,通过检测代谢途径的关键酶活性,推测pH-DO组合策略可能增大了碳代谢通量,但其对胞内辅因子带来的影响,还需进一步评估。 大多数胞内ATP是通过呼吸链和氧化磷酸化产生的。由图5-a的电子传递链强度检测结果可以发现,pH-DO组合调控策略的电子传递能力更高,基本达到极显著水平(P<0.01),电子传递过程耦合了ATP的形成,表明ATP的合成能力在pH-DO策略中也被增强了。由图5-b中可知,pH-DO组合调控策略中的胞内ATP浓度在整个发酵过程中呈下降的趋势。而在恒定发酵过程中,ATP在前96 h下降,但96 h后却开始积累。同时,96 h后,pH-DO组合调控策略中的胞内ATP浓度显著低于对照组,这与预期截然相反。结合PLS活性在96 h 后仍保持着较高水平的情况,推测由于PLS的活性增强,大量合成的ε-PL增加了胞内ATP的消耗,以致最终胞内ATP浓度较低。 a-电子呼吸链;b-ATP;c-NADH;d-NAD+/NADH;e-NADPH;f-NADP+/NADPH图5 发酵过程中生理参数比较Fig.5 Comparison of Physiological Parameters in Fermentation Processes 如图5-c和图5-d所示,2种策略中的胞内NADH水平呈波动变化,且pH-DO组合调控策略中的NADH水平基本高于对照。类似,NAD+/NADH的比值略微高于对照,说明pH-DO策略提高了NADH的利用率。pH-DO组合调控策略中NADPH水平在48和96 h时高于对照组,而在168和240 h低于对照,而NADPH的利用率(NADP+/NADPH)与上述结果恰恰相反。结合2.4的结果,推测虽然pH-DO调控策略增强了NADPH的供应量,但由于发酵后期NADPH被大量用于L-lys的合成,导致胞内实际NADPH水平下降。 综合上述结果,可以发现pH-DO组合调控策略在提高胞内ATP、NADH和NADPH合成代谢的同时,也增强了其分解代谢。总的来说,经pH-DO调控,胞内总体代谢活力更强,为ε-PL和菌体的合成提供了更多的前体或中间代谢物。 本研究表明,根据ε-PL高产菌S.albulusWG-608对发酵条件的需求,在发酵的不同阶段对pH和DO进行不同控制,可以显著提高S.albulusWG-608的ε-PL合成能力。采用新建立的pH-DO组合调控策略进行240 h的补料分批发酵后,WG-608的ε-PL产量和平均比合成速率达到68.77 g/L和2.33 d-1,比对照组(48.19 g/L和2.08 d-1)分别提高了28.33%和12.02%。进一步探究表明,该策略通过增强中心碳代谢途径、L-lys与ε-PL合成途径关键酶活性,增强WG-608对底物的摄取能力以及底物朝向ε-PL的代谢通量,最终提高了ε-PL的产量与比合成速率。胞内辅因子NADH、ATP与NADPH的合成增强,为L-lys与ε-PL的合成提供了足够的还原力和能量。本研究所获得的结果有助于ε-PL的大规模工业化生产。此外,由于pH-DO组合调控策略下ε-PL大量合成,促使游离胞内辅因子(ATP和NADPH)的含量大幅降低,有可能出现供不应求的状态。因此,后期可以考虑利用代谢工程手段提高胞内辅因子的供应量和利用率,以期进一步提高小白链霉菌ε-PL的生产效率。2.5 pH-DO组合调控发酵提高产量机制初探


3 结论