QuEChERS前处理-高效液相色谱法测定MS培养基中6-苄氨基嘌呤、萘乙酸与吲哚丁酸的含量
2023-03-21马海昊刘哲铭周小毛
杨 斌,周 勇,刘 佳,马海昊,刘哲铭,周小毛
(湖南省农业生物技术研究所,长沙 410125)
植物生长调节剂是一类人工合成的用于调节植物生长发育的化合物,与植物激素具有相似的生理、生物学效应,广泛用于农业生产和植物组织培养试验。植物生长调节剂在低浓度水平(10-6mg·kg-1级别)下即可产生明显的调节作用,超过适用范围可能产生非预期作用。在植物组织培养中,尤其在试验阶段,需要制备含一定浓度水平植物生长调节剂的培养基。在配制过程中,水分蒸发、高温灭菌等因素均有可能影响植物生长调节剂的含量。为精确控制试验过程,有必要测定培养基中植物生长调节剂的含量。
植物生长调节剂的检测方法主要有气相色谱-质谱法[1-2]、高效液相色谱法[3]、超高效液相色谱-串联质谱法[4]、离子色谱法[5]等。其中,高效液相色谱法具有普及率高、成本低、操作简单等优点,采用的前处理方法通常有溶剂提取法、固相萃取法、Qu ECh ERS等[6-10]。但是,关于凝胶状培养基中植物生长调节剂检测的报道较少。鉴于此,本工作参考文献[11-13],以MS(MURASHIGE 和SKOOG的缩写)培养基为基体,以乙腈作提取剂,以氯化钠和无水硫酸钠盐析,以高效液相色谱法测定MS培养基中6-苄氨基嘌呤(6-BA)、萘乙酸(NAA)、吲哚丁酸(IBA)等3种常见植物生长调节剂的含量,可为培养基中植物生长调节剂的含量控制提供参考。
1 试验部分
1.1 仪器与试剂
LC-20AT 型高效液相色谱仪,配二极管阵列检测器和四元低压单泵;ME 55型电子天平。
单标准储备溶液:取适量6-BA、NAA 和IBA标准品,用甲醇溶解和稀释,配制成100 mg·L-1的单标准储备溶液。
混合标准溶液系列:取适量单标准储备溶液,用甲醇逐 级稀释,配制成0.05,0.50,4.00,20.00,28.00 mg·L-1的混合标准溶液系列,过0.22μm滤膜后备用。
6-BA、NAA 和IBA 标准品纯度分别为99.9%,99.5%,98.1%;甲醇、乙腈(流动相用)为色谱纯;乙腈(常规试验使用)、氯化钠、无水硫酸钠、磷酸二氢铵、磷酸均为分析纯;试验用水为超纯水。
市售MS培养基,临用新配。
1.2 仪器工作条件
InertSustain C18色谱柱(150 mm×4.6 mm,5μm);柱温30℃;流动相A 为磷酸盐缓冲溶液(用磷酸将0.01 mol·L-1磷酸二氢铵溶液的酸度调节至pH 3.5),B 为乙腈;进样量10μL;6-BA、NAA和IBA 的检测波长分别为272,221,223 nm。梯度洗脱程序:0~1 min时,B 为30%;1~6 min时,B由30%升至70%,保持2 min;8~9 min 时,B 由70%升至80%,保持1 min。
1.3 试验方法
将样品捣碎、混匀,取10 g置于50 mL 离心管中,加入乙腈10 mL,以2 500 r·min-1转速振荡20 min。加入氯化钠1.14 g、无水硫酸钠2.24 g,继续以2 500 r·min-1转速振荡20 min,以5 000 r·min-1转速离心5 min。取适量上清液过0.22μm滤膜,滤液按照仪器工作条件测定。
2 结果与讨论
2.1 盐组成及用量的选择
鉴于盐组成和用量对3种目标物的准确测定有较大影响,试验分别采用不同组成及用量盐的组合对加标样品(加标量7.5 mg·kg-1)进行盐析,各目标物的回收率见表1。
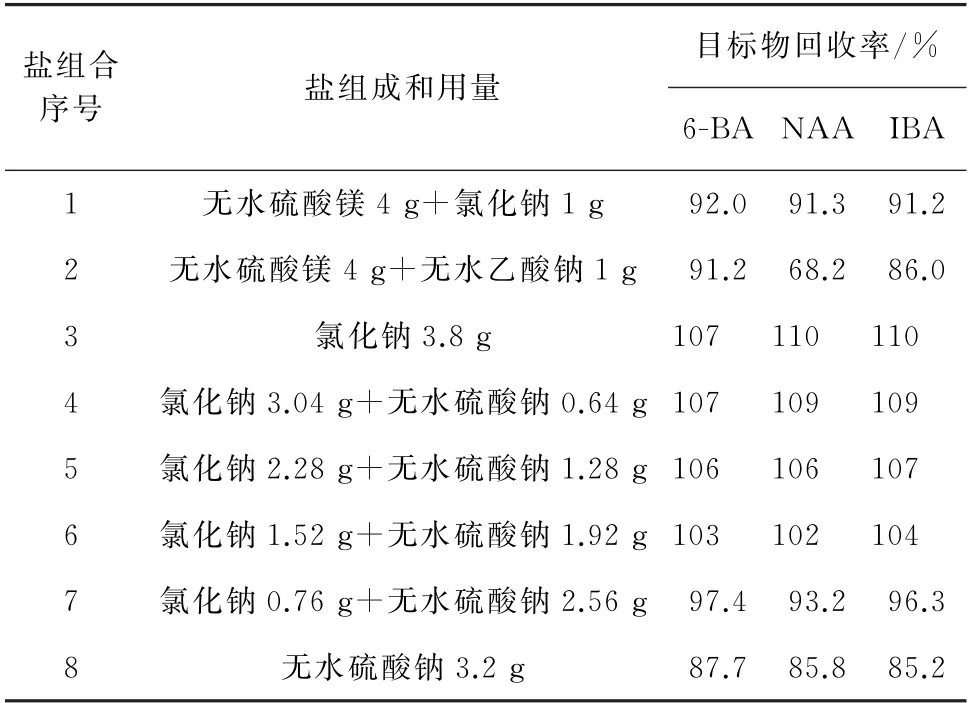
表1 不同盐组合下目标物的回收率Tab.1 Recoveries of targets under different salt combinations
由表1可知:当组合为无水硫酸镁+氯化钠和无水硫酸镁+无水乙酸钠时,目标物的回收率略差;当组合为氯化钠、无水硫酸钠或氯化钠+无水硫酸钠时,回收率随着氯化钠用量降低、无水硫酸钠用量的增加而减小。考虑到组合6和组合7的回收率较优,以2个组合中氯化钠和无水硫酸钠用量的平均值作为二者的最优用量。因此,试验选择的盐组合为氯化钠1.14 g+无水硫酸钠2.24 g。
2.2 水相的选择
在水相中添加一定量的弱酸或盐可以一定程度地改善目标物色谱峰的峰形。试验对比了水相分别为0.1%甲酸(体积分数,下同)溶液和磷酸盐缓冲溶液(pH 3.5)时对3种目标物色谱行为的影响,结果见图1。
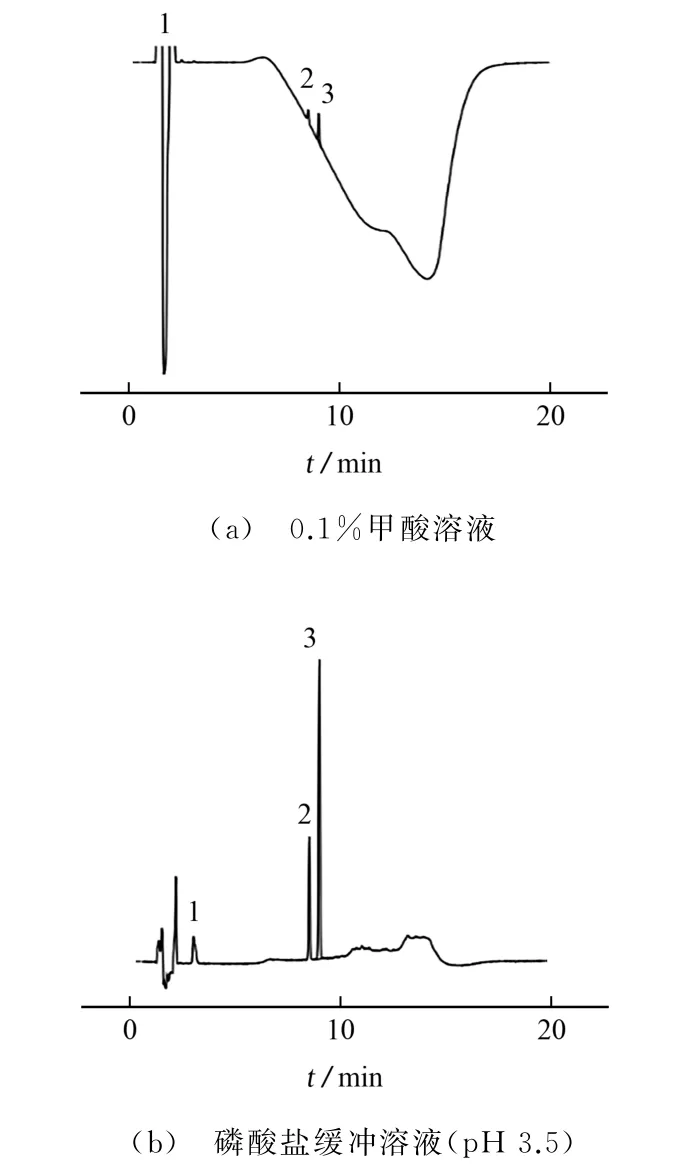
图1 不同水相下目标物的色谱图Fig.1 Chromatograms of targets with different aqueous phases
由图1可知:以0.1%甲酸溶液作水相时,基线会随流动相比例的改变出现大幅度起伏,不利于色谱峰积分;以磷酸盐缓冲溶液(pH 3.5)作水相时,不仅基线比较平稳,而且3种目标物峰形对称、尖锐,均实现了良好分离。因此,试验选择的水相为磷酸盐缓冲溶液(pH 3.5)。
在优化的试验条件下,实际样品的色谱图见图2。

图2 实际样品的色谱图Fig.2 Chromatograms of actual samples
由图2可知,3种目标物的分离效果较好,且受样品基体的干扰较小。
2.3 标准曲线、检出限和测定下限
按照仪器工作条件测定混合标准溶液系列,以6-BA、NAA、IBA 的质量浓度为横坐标,其对应的峰面积为纵坐标绘制标准曲线。结果显示,3种目标物标准曲线的线性范围均为0.05~28.00 mg·L-1,其他线性参数见表2。
以空白样品加标的方法确定检出限和测定下限,以3,10 倍信噪比(S/N)对应的加标量计算检出限(3S/N)和测定下限(10S/N),所得结果见表2。
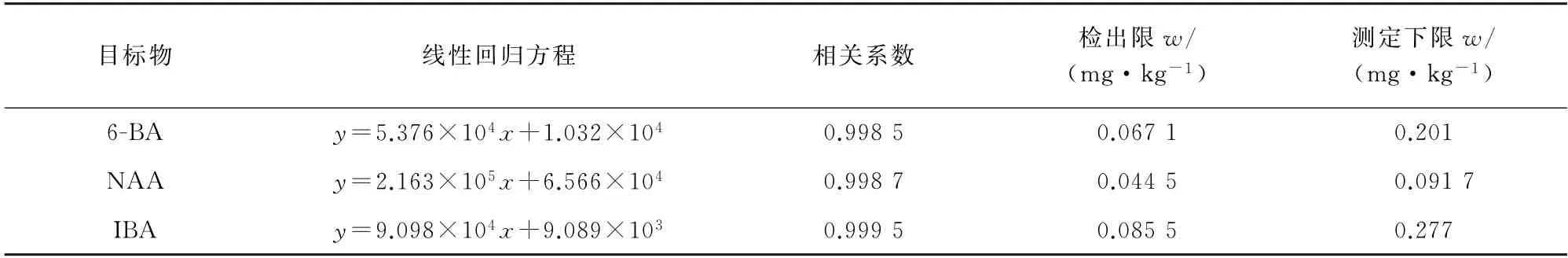
表2 线性参数、检出限和测定下限Tab.2 Linearity parameters,detection limits and lower limits of determination
2.4 精密度与回收试验
按照试验方法对空白样品进行3个浓度水平的加标回收试验,每个浓度水平平行测定5次,计算回收率和测定值的相对标准偏差(RSD),结果见表3。
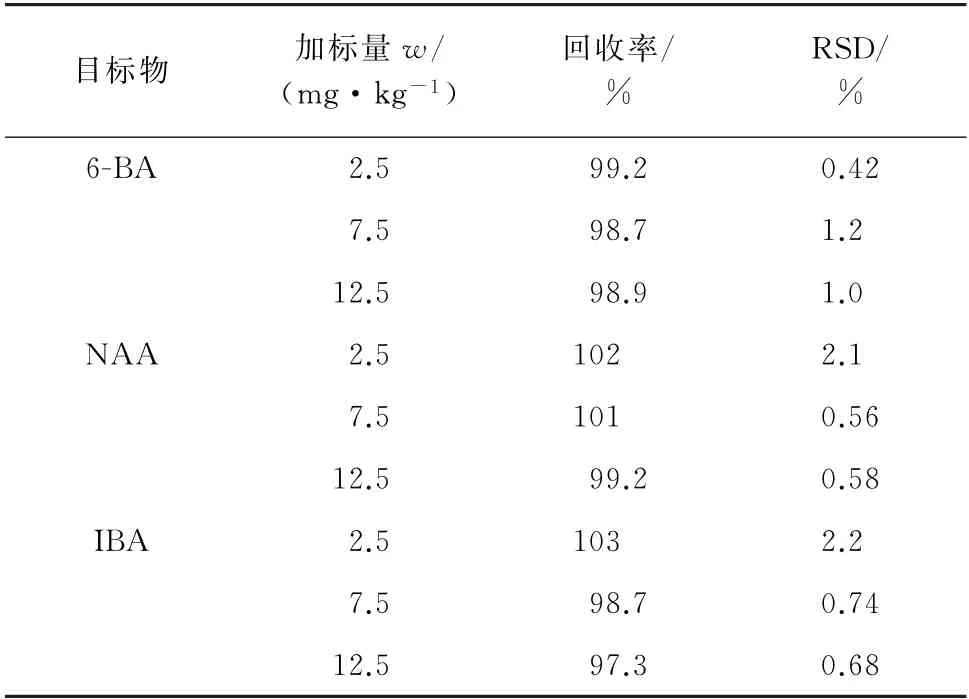
表3 精密度和回收试验结果(n=5)Tab.3 Results of tests for precision and recovery(n=5)
由表3可知:6-BA 的回收率为98.7%~99.2%,测定值的RSD 为0.42%~1.2%;NAA 的回收率为99.2%~102%,测定值 的RSD 为0.56%~2.1%;IBA 的回收率为97.3%~103%,测定值的RSD 为0.68%~2.2%。
2.5 热稳定性试验
为考察阳性培养基的热稳定性,配制目标物加标量为0.5,1.0,2.0,4.0,6.0,8.0 mg·kg-1的阳性MS培养基,每个浓度水平均制作两份培养基,一份不灭菌,直接按照试验方法测定;另一份置于锥形瓶中,用透气膜封口后用121 ℃蒸汽灭菌20 min,冷却后按照试验方法测定。由于灭菌过程会导致培养基质量损失,故需要按照公式(1)先将灭菌后的样品量(m2′)折算为灭菌前的样品量(m1′)后再计算灭菌后3种目标物的检出量,所得结果见图3。
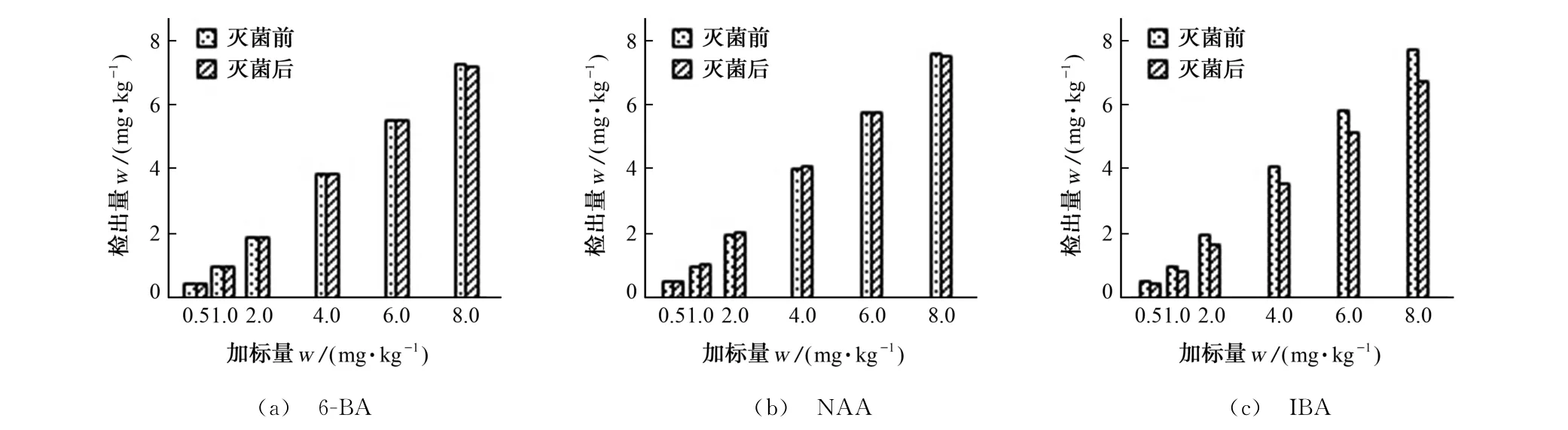
图3 灭菌前后目标物检出量的对比Fig.3 Comparison of detection amounts of targets before and after sterilization
式中:m1、m2分别为灭菌前后培养基和烧杯的总质量;m0为烧杯的质量。
由图3可知,灭菌前后,6-BA、NAA 的检出量几乎没有变化,IBA 的检出量显著下降,且加标量越高,下降的越多。
以灭菌前的检出量为横坐标,灭菌前后的检出量的差值作纵坐标进行线性回归,所得线性回归方程为y=0.119 9x+0.045 90,相关系数为0.999 7,说明灭菌后IBA 的检出量的减少量与其灭菌前的检出量呈线性正相关。
本工作通过对盐组成和用量以及水相的优化,提出了以高效液相色谱法测定MS培养基中3种植物生长调节剂6-BA、NAA、IBA 含量的方法,该方法操作简便,准确度、精密度较好,可以满足植物组织培养试验中植物生长调节剂的检测需要,前处理方法可为其他凝胶状样品的检测提供参考。
