紫花苜蓿种子吸胀期胚根线粒体AsA-GSH 循环对低温胁迫的响应
2023-03-21孙守江唐艺涵马馼李曼莉毛培胜
孙守江,唐艺涵,马馼,李曼莉,毛培胜
(中国农业大学草业科学与技术学院,草业科学北京市重点实验室,北京 100193)
种子萌发是植物发育的重要阶段,也是决定植物生产力的重要因素[1]。种子萌发中温度是一个关键的因子,会对大部分生理生化反应造成影响[2],适宜的温度可以使种子中各种酶的活性维持在较高的水平,进而保证萌发的正常进行[3]。低温会使种子萌发受到抑制,破坏种子体内活性氧(reactive oxygen species,ROS)的平衡,使ROS不正常累积,加剧膜脂过氧化程度[4]。在遭受低温胁迫时,种子也会通过自身的防御机制来响应这些胁迫的伤害。低温胁迫会引起种子发芽率降低,出苗不整齐等情况。有学者在对低温胁迫下蒺藜苜蓿(Medicago truncatula)[5]、羊草(Leymus chinensis)[6]和玉米(Zea mays)[7]种子的发芽率、发芽指数及幼苗生长等方面进行探究发现,在低温胁迫下种子发芽率、发芽指数均有降低,并出现幼苗主根变短,侧根数量减少等现象。植物抗氧化系统清除ROS 的能力与其对低温胁迫的耐受性密切相关。在对水稻(Oryza sativa)[8]和玉米[9]等植物种子的研究中,抗氧化酶活性和抗氧化物的含量都随着低温胁迫呈先升高后下降的趋势,在品种比较试验中发现,冷敏感的品种在低温胁迫下抗氧化酶活性低于耐冷性强的品种。缬草(Valeriana officinalis)种子[10]在受到低温胁迫时,抗氧化酶与抗氧化物通过共同协调作用,可减轻低温对缬草造成的不利影响。种子生理代谢正常时,超氧化物歧化酶(superoxide dismutase,SOD)活性与ROS 含量呈正比,随着胁迫加重O2·-的衍生物反而会抑制SOD 活性,SOD的失活程度与H2O2含量成正比[11]。过氧化氢酶(catalase,CAT)也会因为O2·-与CAT 反应形成复合物,导致CAT 钝化进而抑制其活力[12]。研究表明SOD、CAT 和过氧化物酶(peroxidase,POD)这3 种酶的活性随着低温胁迫呈先升高后下降的趋势,说明低温胁迫下抗氧化酶活性上升以清除ROS,但随着胁迫加重,抗氧化系统受到损伤,从而导致活性氧产生与清除之间的动态平衡被破坏,加剧了膜脂过氧化作用[13]。SOD 和CAT 对于低温胁迫的响应比POD 更为敏感,POD 活性在低温胁迫下变化较小[14]。田宏等[15]在扁穗雀麦(Bromus cartharticus)种子萌发温度研究中发现,抗坏血酸过氧化物酶(ascorbate peroxidase,APX)对低温极其敏感,APX 的活性伴随着H2O2含量的升降而升降,谷胱甘肽还原酶(glutathione reductase,GR)活性在低温胁迫下显著高于常温处理,并且随着低温胁迫的进行会逐渐升高,但在低温胁迫24 h 后,GR 活性有轻微下降。张尚雄等[16]研究发现,低温胁迫下老芒麦(Elymus sibiricus)种子抗坏血酸(ascorbic acid,AsA)和谷胱甘肽(glutathione,GSH)含量均表现出上升的趋势。
紫花苜蓿(Medicago sativa)是豆科苜蓿属多年生草本植物,是世界范围内栽培历史最悠久,种植面积最广泛的豆科牧草。其在我国北方地区集中种植,但冬季和早春温度很低,容易发生冻害,严重影响了紫花苜蓿的越冬和早播,进而影响其产量。因此,了解紫花苜蓿种子在低温条件下的响应机制,对有效提高其耐寒性意义重大。紫花苜蓿对低温胁迫的响应研究主要集中在幼苗和植株,并证明低温胁迫会造成ROS 的过量累积。已有报道指出,线粒体是种子中ROS 产生的主要位点,因此探索低温条件下紫花苜蓿种子线粒体的相关生理变化规律,对于掌握种子萌发机制具有积极意义。基于此,以紫花苜蓿种子为试验材料,测定不同温度下种子的发芽特性以及种子吸胀过程中胚根线粒体内AsA-GSH 循环中的抗氧化酶活性、抗氧化物含量以及H2O2含量变化,以揭示低温条件对紫花苜蓿种子吸胀过程中线粒体抗氧化系统的影响,并为提高种子抗寒能力相关研究提供依据。
1 材料与方法
1.1 试验材料
试验材料为中苜1 号紫花苜蓿,种子初始发芽率为100%,筛选大小均一的种子,保存在4 ℃冰箱备用。本试验于2021年12 月-2022年3 月在中国农业大学草业科学与技术学院以及牧草种子检测中心实验室进行。
1.2 试验方法
1.2.1 发芽试验 参照国际种子检验协会(International Seed Testing Association,ISTA)的种子检验规程[17]规定的发芽条件,分别选取大小均匀一致的100 粒紫花苜蓿种子,放置于培养皿(11.5 cm×11.5 cm)中,放置3 张滤纸用10 mL 蒸馏水润湿,再放于光照培养箱中在20 和10 ℃,黑暗条件下培养,每个处理设4 次重复。培养期间每隔24 h 统计胚根突破种皮2 mm 的种子数,用于测定平均发芽时间(mean germination time,MGT)和发芽指数(germination index,GI)。在第4 天初次计数和第10 天末次计数时统计正常种苗个数。
用发芽终期全部正常种苗数计算种子发芽率(germination percentage,GP),GP=(G10/N)×100%,式中:G10为末次计数时的正常种苗数,N为试验种子总数。
用初次计数的正常种苗数计算种子发芽势(germination energy,GE),GE=(G5/N)×100%,式中:G5为初次计数时的正常种苗数,N为试验种子总数。
平均发芽时间(MGT)=Σ(nt)/Σn,式中:t是发芽天数,n是第t天胚根突破2 mm 的种子数,Σn是总发芽数。
发芽指数(GI)=Σn/t,式中:t是发芽天数,n是第t天的发芽数。
1.2.2 种子吸胀曲线制作 采用纸上发芽法,挑选饱满度均匀的紫花苜蓿种子,分别在10 和20 ℃下吸胀不同时间(0、4、8、12、16、20、24、28、32 和36 h),每个吸胀时间点设4 个生物学重复,每个重复100 粒种子。分别在天平上准确称重后均匀摆置于铺有3 层滤纸的培养皿(11.5 cm×11.5 cm)中,每个培养皿中的滤纸用10 mL 蒸馏水浸润,立即置于10 和20 ℃培养箱,吸胀对应时间后取出,立即用滤纸吸干种子表面的水分,如有发霉种子立刻取出,情况严重者重换培养皿,确保试验顺利进行,准确称重并统计,最后计算种子吸水率、吸水速率。
1.2.3 不同吸胀阶段苜蓿种胚线粒体提取 参照Lyu 等[18]的方法提取线粒体,将0.8 g 紫花苜蓿种子分别在20 和10 ℃条件下吸胀6、12 和24 h 后取下胚根,加入约50 mL 预冷的提取缓冲液[0.3 mol·L-1蔗糖,25 mmol·L-1焦磷酸 四 钠,2 mmol·L-1EDTA,10 mmol·L-1KH2PO4,1%(w/v)PVP-40,1%(w/v)牛血清白 蛋 白(bovine serum albumin,BSA),6 mmol·L-1抗坏血酸钠和5 mmol·L-1L-半胱氨酸,pH 7.5]。在4 ℃条件下充分研磨后,用4 层纱布过滤。滤液在2700 r·min-1离心8 min 后,上清液转至新的离心管,并在19000 r·min-1下离心20 min。离心后的沉淀加入线粒体洗涤缓冲液,成分为:0.3 mol·L-1蔗糖,10 mmol·L-1N-三羟甲基甲基-2-氨基乙磺酸[N-Tris(hydroxymethyl)-methyl-2-aminoethanesulfonic acid,TES],0.1%(w/v)BSA,pH 7.5,用画笔轻轻刷起线粒体沉淀并匀浆;将匀浆在2700 r·min-1下离心8 min 后,上清液再次转入干净的离心管中,在19000 r·min-1下离心20 min。离心后的沉淀加入少量的线粒体洗涤缓冲液,再次用笔刷轻轻地刷起线粒体沉淀并匀浆。此匀浆液即为线粒体悬浮液。将线粒体悬浮液轻轻铺在连续密度梯度液上,在42500 r·min-1下离心40 min,在离心管底部可见不透明浅黄色线粒体。小心收集离心管底部线粒体,加入不含BSA 的线粒体洗涤缓冲液(0.3 mol·L-1蔗糖,10 mmol·L-1TES,pH 7.5),33000 r·min-1离心15 min,洗涤2 次,得到线粒体提取液,立即保存于-80 ℃冰箱用于抗氧化酶活性以及抗氧化剂含量测定。上述所有步骤均在4 ℃条件下进行。
1.3 测定指标与方法
1.3.1 抗氧化酶活性以及抗氧化剂含量测定 CAT 活性测定参照Cakmak 等[19]的方法。单脱氢抗坏血酸还原酶(monodehydroascorbate reductase, MDHAR)活性测定参考Pu 等[20]的方法。GR 活性测定参考Woo 等[21]的方法。GSH 含量的测定采用Baker 等[22]的方法。AsA 含量测定采用Turcsanyi[23]的方法。
1.3.2 H2O2含量测定 采用苏州科铭公司的H2O2测定试剂盒测定H2O2含量。H2O2与硫酸钛生成黄色的过氧化钛复合物,在415 nm 处有特征吸收峰。取0.2 mL 线粒体提取液,参照试剂盒说明书测定415 nm 处吸光度A。△A=A测定-A对照,标准条件下的方程为:y=0.7488x+0.0006(x为标准品浓度,μmol·mL-1;y为吸光度值),根据下式计算H2O2含量:
式中:V样为加入样本体积(mL);Cpr 为样本蛋白质浓度(mg·mL-1)。
1.4 数据统计和分析
利用Excel 2019 和SPSS 23.0 软件进行数据整理和显著性统计分析。所有数据均为4 个重复的平均值±标准误,用单因素方差分析(ANOVA)和邓肯检验(Duncan test)比较不同处理的平均值(P<0.05),用Graphpad Prism 8.0 软件进行作图,指标相关性聚类分析用“corrplot”和“pheatmap”R 包。
2 结果与分析
2.1 不同温度下苜蓿种子吸胀曲线
将紫花苜蓿种子在不同温度下进行吸胀处理,20 ℃处理下0~8 h 为快速吸水阶段,8~24 h 为迟滞阶段,24 h 种子逐渐露白,进入发芽阶段。10 ℃吸胀曲线变化趋势与20 ℃不同,0~8 h 为快速吸水阶段,8~36 h 为迟滞阶段,36 h 逐渐露白,进入发芽阶段(图1)。综合不同温度处理下种子吸胀变化规律,确定取样时间为吸胀6、12 和24 h。
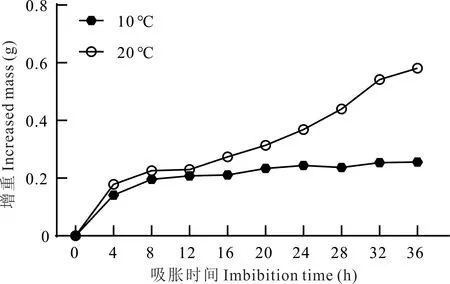
图1 不同温度条件下紫花苜蓿种子吸胀过程Fig.1 Imbibition of alfalfa seeds under different temperature
2.2 低温胁迫对紫花苜蓿种子发芽特性的影响
由图2 可知,紫花苜蓿种子在10 ℃下发芽与20 ℃相比,发芽率无显著差异。10 ℃下发芽势和发芽指数与20 ℃差异显著(P<0.05),均显著降低,平均发芽时间显著(P<0.05)增加。

图2 不同温度下紫花苜蓿种子发芽特性变化Fig.2 Changes of germination characteristics of alfalfa seeds under different temperature*表示不同温度处理之间差异显著(P<0.05)。* indicate significant differences under different temperature at the 0.05 level.
2.3 低温胁迫对紫花苜蓿种子吸胀期间胚根线粒体内H2O2含量的影响
不同温度处理下胚根线粒体H2O2含量在吸胀期间呈现不同的变化规律,20 ℃处理下胚根线粒体H2O2含量在吸胀24 h 期间总体呈上升趋势,但变化幅度较小,吸胀24 h 后含量最高;10 ℃处理下胚根线粒体H2O2含量总体呈先上升后下降的趋势,吸胀12 h 后含量最高。10 和20 ℃分别吸胀6 和12 h 后相比,胚根线粒体H2O2含量差异显著(P<0.05)。吸胀12 和24 h 后,10 ℃处理的胚根线粒体H2O2含量高于20 ℃处理(图3)。
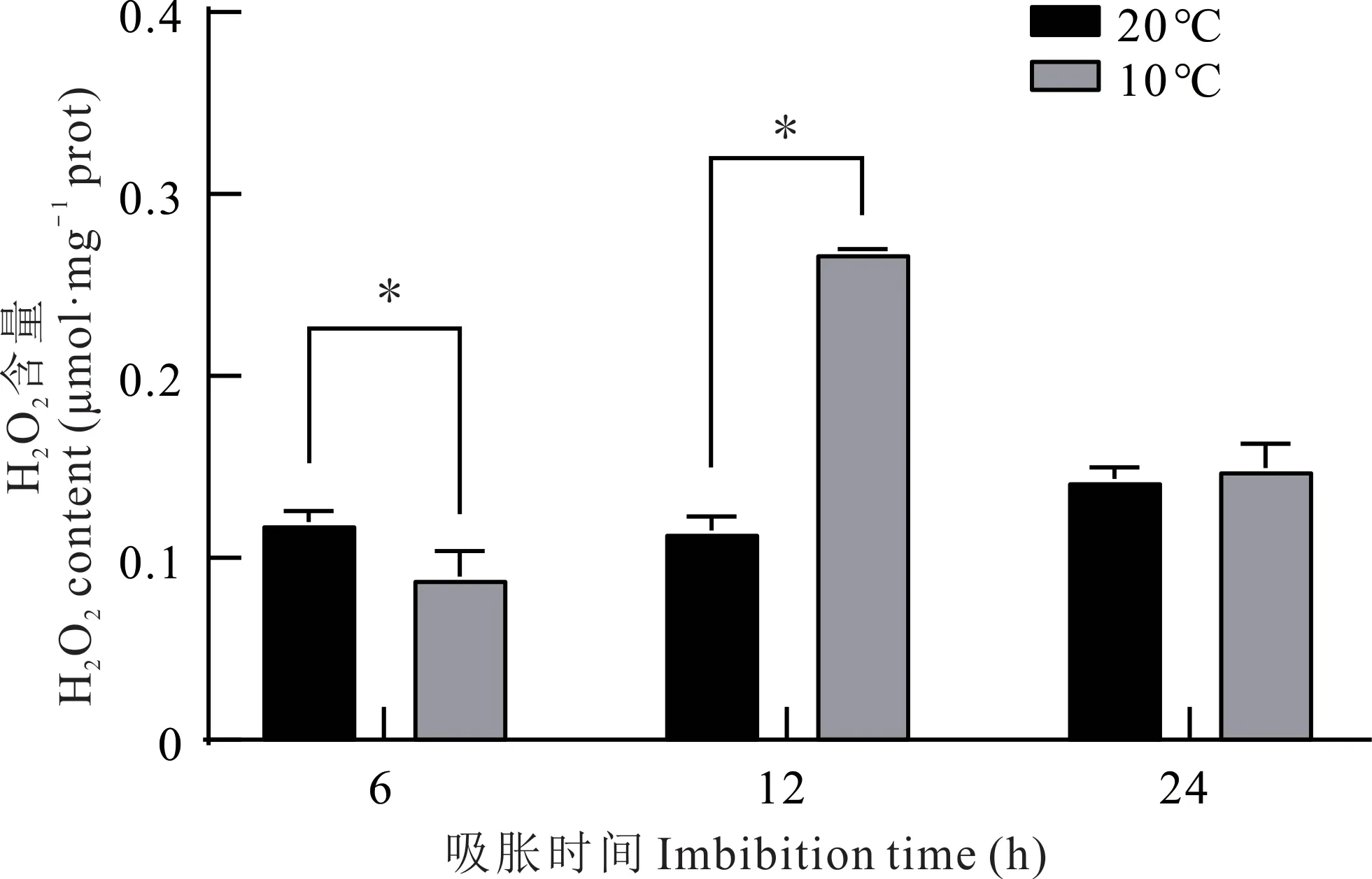
图3 紫花苜蓿种子吸胀期间胚根线粒体内H2O2含量的变化Fig. 3 Changes of H2O2 content in radicle mitochondrial of alfalfa seeds during imbibition*表示同一吸胀时间不同温度处理之间差异显著(P<0.05),下同。* indicate significant differences under different temperature at the 0.05 level.The same below.
2.4 低温胁迫对紫花苜蓿种子吸胀期间胚根线粒体内抗氧化酶活性的影响
由图4 可知,吸胀6、12 和24 h 后,10 ℃处理的胚根线粒体GR 活性低于20 ℃处理。不同温度处理下胚根线粒体GR 活性在吸胀期间呈不同的变化规律,20和10 ℃处理下胚根线粒体GR 活性在吸胀6、12 和24 h 后均呈先上升后下降的趋势,在吸胀12 h 后活性最高。20 和10 ℃吸胀6 h 相比,胚根线粒体GR 活性无显著性差异;20 和10 ℃吸胀12 h 相比,胚根线粒体GR活性差异显著(P<0.05);20 和10 ℃吸胀24 h 后相比,活性无显著性差异。
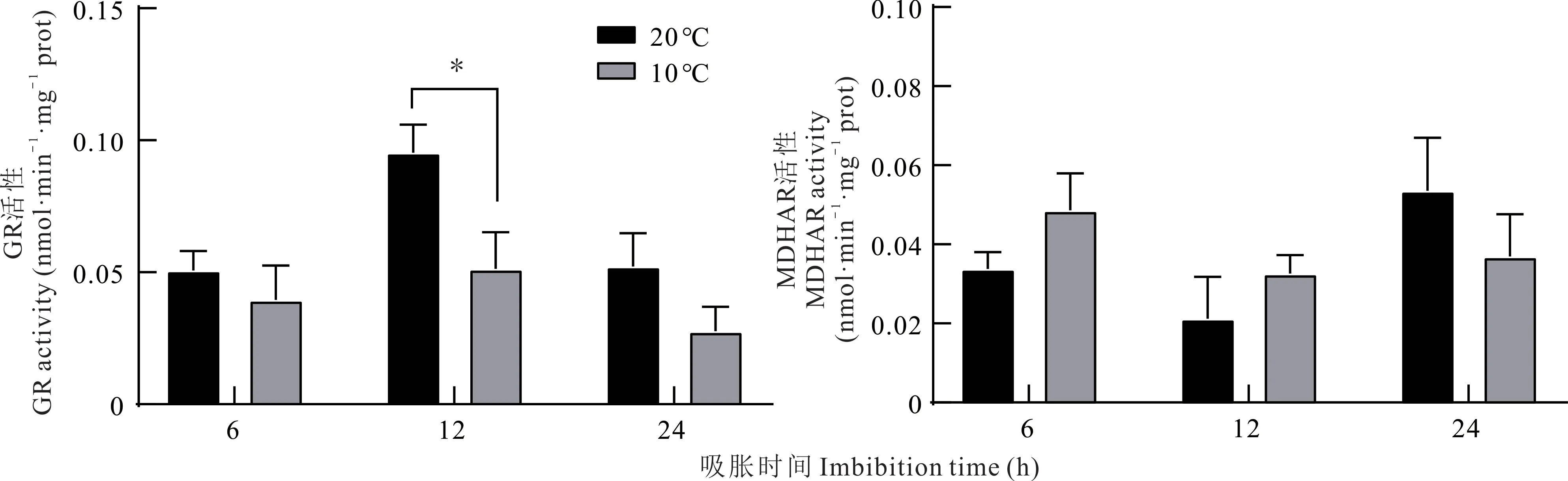
图4 紫花苜蓿种子吸胀期间胚根线粒体内GR 和MDHAR 活性的变化Fig.4 Changes of GR and MDHAR activity in radicle mitochondrial of alfalfa seeds during imbibition
20 ℃处理下胚根线粒体MDHAR 活性在吸胀24 h 期间呈先下降后上升的趋势,吸胀24 h 后活性达到最大值(图4)。10 ℃处理下胚根线粒体MDHAR 活性在吸胀24 h 期间呈下降趋势,吸胀24 h 后,10 ℃处理的胚根线粒体MDHAR 活性低于20 ℃处理。各吸胀时间不同温度处理之间MDHAR 活性差异均不显著。
20 ℃处理下胚根线粒体POD 活性在吸胀24 h 期间总体呈先下降后上升的趋势,吸胀6 h 后活性最高,吸胀12 h 后活性最低。与其不同的是,10 ℃处理下胚根线粒体POD 活性呈上升的趋势,吸胀6 h 后活性最小,吸胀24 h 后活性最大,10 和20 ℃吸胀6 h 后相比,胚根线粒体POD 活性差异显著(P<0.05);10 和20 ℃分别吸胀12 和24 h 后相比,胚根线粒体POD 活性无显著差异(图5)。
20 ℃处理下胚根线粒体CAT 活性在吸胀24 h 期间总体呈先下降后上升的趋势,吸胀6 h 后胚根线粒体CAT活性达到最大值,10 ℃处理下胚根线粒体CAT 活性呈上升的趋势,吸胀24 h 后活性最大。20 与10 ℃吸胀6 h 后相比,胚根线粒体CAT 活性差异显著(P<0.05);20 与10 ℃分别吸胀12 和24 h 后相比,胚根线粒体CAT 活性无显著差异(图5)。
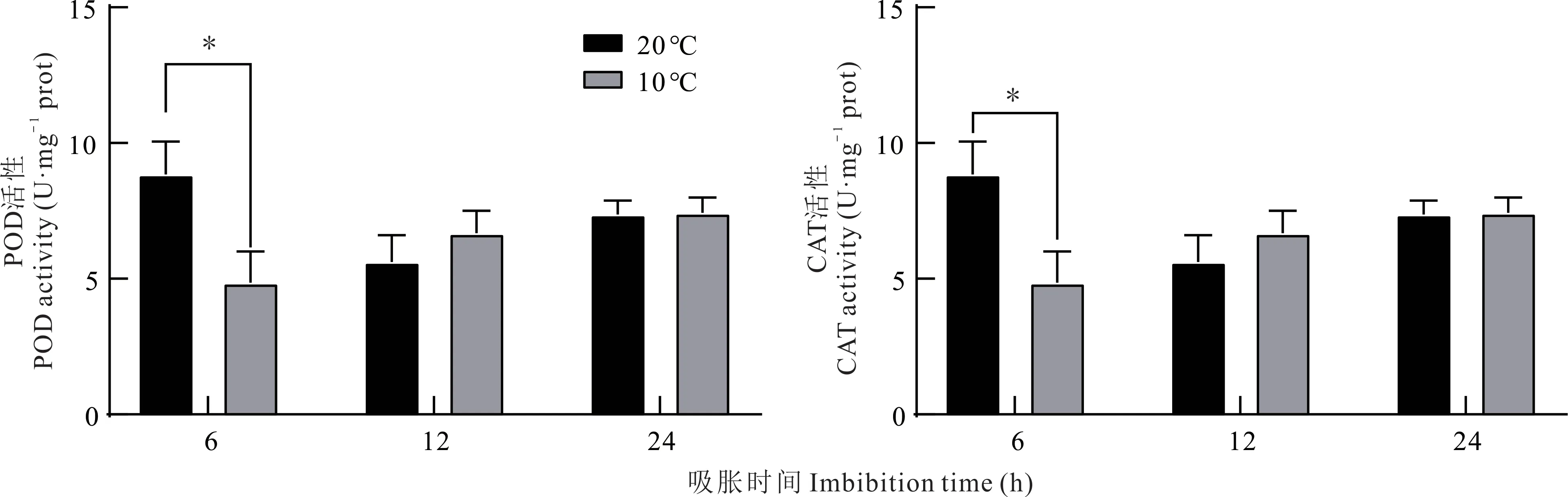
图5 紫花苜蓿种子吸胀期间胚根线粒体内CAT 和POD 活性的变化Fig.5 Changes of CAT and POD activity in mitochondrial radicle of alfalfa seeds during imbibition
2.5 低温胁迫对紫花苜蓿种子吸胀期间胚根线粒体内抗氧化剂含量的影响
20 ℃处理下胚根线粒体AsA 的含量总体呈逐渐上升的趋势,吸胀24 h 后含量最高。10 ℃处理下胚根线粒体AsA 的含量随着吸胀时间的延长保持不变。20 与10 ℃分别吸胀6 和24 h 后相比,胚根线粒体AsA 含量差异显著(P<0.05);20 与10 ℃吸胀12 h 后相比,胚根线粒体AsA 含量无显著差异(图6)。
20 ℃处理下胚根线粒体GSH 的含量在吸胀24 h 期间总体呈先下降后上升的趋势,吸胀24 h 后含量最高。10 ℃处理下胚根线粒体GSH 的含量也呈先下降后上升的趋势,吸胀12 h 后含量最低。10 与20 ℃分别吸胀6、12和24 h 后相比,胚根线粒体GSH 含量差异均显著(P<0.05)(图6)。
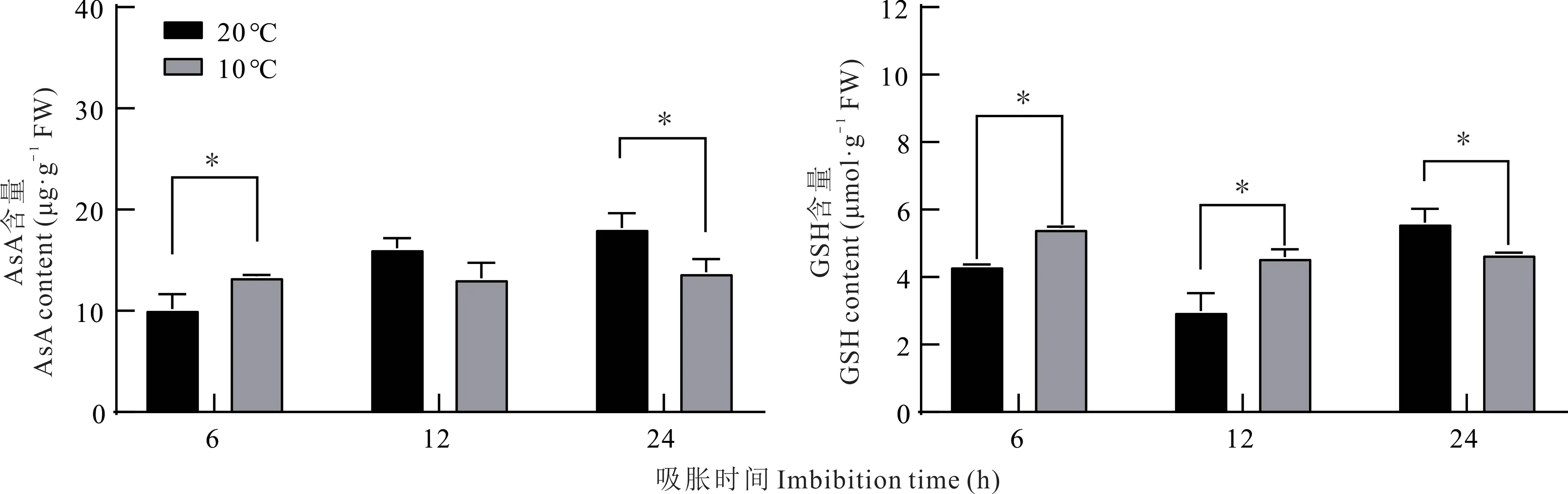
图6 紫花苜蓿种子吸胀期间胚根线粒体内AsA 和GSH 含量的变化Fig.6 Changes of AsA and GSH content in radicle mitochondrial of alfalfa seeds during imbibition
2.6 AsA-GSH 循环抗氧化指标聚类分析
通过聚类分析发现(图7),7 个苜蓿胚根线粒体抗氧化防御系统相关指标主要分为3 组:Ⅰ包括AsA 含量和GR 活性;Ⅱ包括GSH 含量和MDHAR 活性;Ⅲ包括POD、CAT 活性和H2O2含量。从热图中可以明显看出,Ⅰ中的AsA 含量和GR 活性在20 ℃处理下较大,在10 ℃处理下较小,说明低温胁迫影响了AsA 含量和GR 活性;Ⅱ中的GSH 含量和MDHAR 活性在20 ℃吸胀早期较小,后期较大,而在10 ℃条件下吸胀早期较大,后期较小,说明低温胁迫诱导了MDHAR 和GSH 的生成。但是萌发后期GSH 含量和MDHAR 活性又下降,降低了线粒体抗氧化能力。
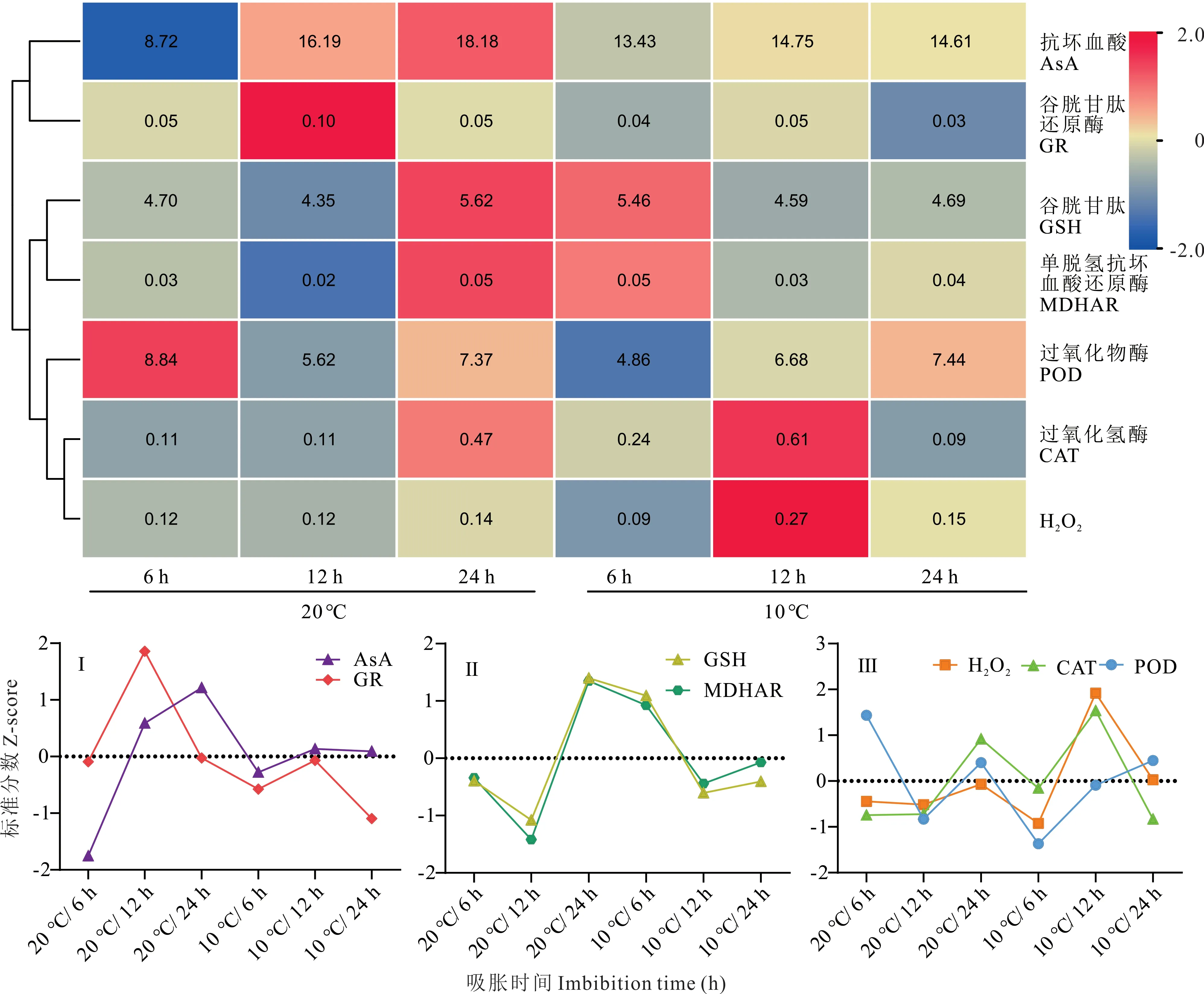
图7 基于苜蓿种子线粒体抗氧化相关指标的聚类分析Fig.7 Cluster analysis based on mitochondrial antioxidant related indexes of alfalfa seeds
3 讨论
3.1 低温胁迫对紫花苜蓿种子发芽特性的影响
种子是植物最重要的繁殖器官,种子萌发是植物生命史的关键一步。种子在低温下吸胀萌发期间容易发生吸胀冷害,进而影响种子的萌发进程和萌发整齐度[24]。种子的发芽能力通常用发芽率、发芽势、发芽指数和平均发芽时间来衡量[25]。种子发芽指数在一定程度上反映了种子萌发的速度。李建设等[26]研究发现,低温处理茄子(Solanum melongena)种子的发芽率、发芽指数等指标均降低。李佳荫等[27]研究发现与常温处理相比,4 ℃低温处理的12 个菜豆(Phaseolus vulgaris)品种种子的发芽率均显著降低。本研究发现,10 与20 ℃条件下发芽相比,种子的发芽率无显著变化,这与赵文静[28]的研究结果一致。本试验中发芽势和发芽指数在低温胁迫下均显著降低(P<0.05),平均发芽时间显著增加(P<0.05),这与高茜等[29]的研究结果一致。 由此可以看出,本研究中选择的低温胁迫温度是10 ℃,没有造成发芽率的显著降低,仅仅影响了种子的萌发速度。
种子吸水速率的快慢在一定程度上反映了种子活力的高低,其对种子发芽率也有影响,因此,种子吸水速率也是影响种子萌发快慢的一个因素。种子萌发过程中,低温胁迫影响水解酶性质、膜结合蛋白的活力及膜透性,从而延缓种子的吸水进程[30]。本研究发现,10 ℃下紫花苜蓿种子的吸水速率较20 ℃变缓,说明低温延缓了种子的吸水速率,限制了种子的发芽速度以及萌发的整齐程度,延长了种子萌发时间,进而影响种子萌发的进程。
3.2 低温胁迫对紫花苜蓿种子胚根线粒体抗氧化酶活性的影响
温度影响植物体内的生理机能,进而影响生理生化过程。低温胁迫会抑制一系列的生理机能,抑制种子的萌发和生长。研究发现,低温对种子的生理生化过程影响十分复杂,低温胁迫会导致种子内产生大量ROS,导致细胞膜脂过氧化,进而引起种子内代谢紊乱,最终抑制种子的生长发育[31]。本试验中10 ℃处理下胚根线粒体H2O2含量显著高于20 ℃处理下的每个阶段。说明低温导致紫花苜蓿种子积累了大量ROS,并且随着低温胁迫的持续,ROS 的积累量逐渐升高。但是植物在长期进化中形成了一套内源抗氧化保护酶系统,形成了种子对低温等逆境胁迫的防御机制,清除体内过量的ROS,维持细胞的正常代谢[32]。种子对ROS 的抗性与种子内部清除ROS的能力息息相关。SOD、POD、CAT 以及AsA-GSH 循环中的GR 和MDHAR 是种子内主要的ROS 清除剂,共同协调ROS 维持在一个正常水平,从而防止伤害。因此,它们被称为抗氧化保护系统。该酶系统与植物种子抗寒性的关系已有很多报道。本研究发现,10 ℃处理早期,胚根线粒体POD 和CAT 活性显著下降,说明在低温胁迫初期紫花苜蓿种子抗氧化系统受到破坏,胚根线粒体CAT 活性又受到低温抑制无法正常发挥作用,这与娄慧等[33]的研究结果类似。但是种子吸胀12 h 后胚根线粒体POD 和CAT 活性逐渐升高,逐渐恢复了抗氧化能力,说明种子萌发后期胚根线粒体POD 活性维持在一个较高的水平,以清除体内积累的ROS,这与玉米种子[7]在低温胁迫下的萌发不一致,可能是两者胁迫温度不同所导致。MDHAR、GR 和APX 是AsA-GSH 循环中的关键酶,APX 可以清除H2O2,MDHAR 和GR 是保证AsA 和GSH 再生的关键酶,从而保证AsA-GSH 循环的顺利进行,以减轻ROS 对细胞带来的伤害[34]。本研究中10 ℃下胚根线粒体MDHAR 和GR 活性总体呈下降的趋势,这与赵宝龙等[35]的研究结果一致,说明紫花苜蓿种子在低温胁迫下降低了GR 活性,从而影响了GSH 的再生,使得AsA-GSH 循环无法有序进行。根据本试验的结果可以得出,紫花苜蓿种子在遭受低温胁迫初期,通过提高抗氧化酶的活性以清除过量ROS,但随着低温胁迫的加重,大部分酶活性也会受到低温影响无法正常发挥作用,导致种子线粒体抗氧化系统无法正常发挥作用,进一步影响了种子的萌发进程。
3.3 低温胁迫对紫花苜蓿种子胚根线粒体内抗氧化物及ROS 含量的影响
种子在吸胀萌发过程中伴随着抗氧化能力的变化,主要包括抗氧化酶活性以及抗氧化剂含量的变化,抗氧化系统在种子吸胀过程中维持种子抗氧化状态发挥着重要作用。AsA 和GSH 是AsA-GSH 循环系统中重要的抗氧化物质,APX 以AsA 为电子供体,催化H2O2反应生成H2O,AsA 也可以与ROS 直接反应,参与ROS 的解毒作用。AsA 可 以 在DHAR 和MDHAR 的催化 下 生 成MDHA 和DHA[36]。GR 可 以 催 化GSSG 生成GSH[37]。本研究发现,10 ℃下吸胀初期胚根线粒体AsA 较高,这说明紫花苜蓿种子通过提升体内抗氧化物的含量以抵御低温胁迫,这与郭丽红等[38]的研究结果相同,但是萌发后期胚根线粒体AsA 含量降低,出现这种情况可能是因为在AsA-GSH 循环中用来催化AsA 再生的MDHAR 的活性和催化GSH 再生的GR 活性受到了低温的抑制,导致酶活性降低,从而影响胚根线粒体AsA 和GSH 的再生。在吸胀初期,胚根线粒体H2O2含量维持在一个相对较低的水平,说明此时抗氧化系统可以清除低温胁迫产生的H2O2,而随着低温处理的时间延长,抗氧化系统遭遇损伤,无法清除过量的ROS 导致ROS 在胚根线粒体中积累[39]。
3.4 紫花苜蓿种子胚根线粒体AsA-GSH 循环响应低温胁迫的规律
基于本研究的结果,依据紫花苜蓿种子在低温下吸胀过程中胚根线粒体AsA-GSH 循环抗氧化酶和抗氧化剂含量变化规律,绘制了紫花苜蓿种子胚根线粒体AsA-GSH 循环响应低温胁迫的规律示意图(图8)。与20 ℃标准发芽温度相比,10 ℃低温胁迫处理下,紫花苜蓿种子胚根线粒体电子传递链泄漏电子,在线粒体中产生ROS。在种子吸胀初期,AsA-GSH 循环抗氧化酶和抗氧化剂及时清除ROS,随着低温胁迫的进一步加重,胚根线粒体抗氧化能力降低,使得ROS 产生速率大于清除速率,最终导致ROS 在胚根线粒体中积累,限制了线粒体抗氧化能力,进而延长了紫花苜蓿种子的萌发进程。
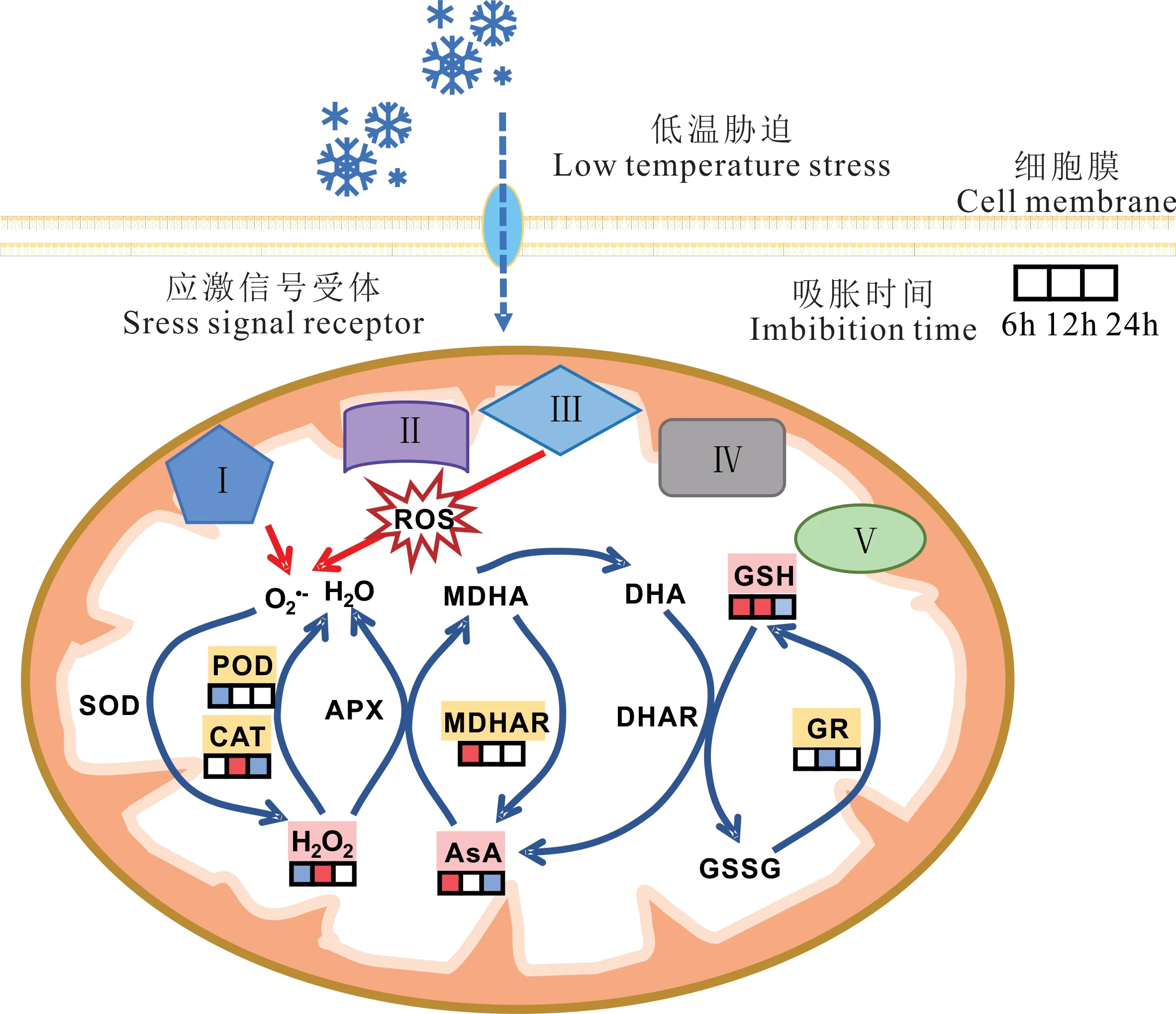
图8 苜蓿种子胚根线粒体AsA-GSH 循环对低温胁迫的响应示意图Fig.8 Response diagram of mitochondrial AsA-GSH cycle in alfalfa seed radicle to low temperature stressI、II、III、IV 和V 分别表示NADH、琥珀酸氧化还原酶、细胞色素C 氧化还原酶、细胞色素C 还原酶和ATP 合成酶;□表示10 ℃/20 ℃,红色代表上升,白色代表不变,蓝色代表下降,从左到右依次为吸胀6、12 和24 h。I,II,III,IV and V represent NADH,succinic acid oxidoreductase,cytochrome C oxidoreductase,cytochrome C reductase and ATP synthase,respectively. Square represents 10 ℃/20 ℃,red square represents a significance increase,white square represents insignificance decrease,blue square represents a significance decrease,from left to right:Imbibition 6,12 and 24 h. MDHAR、DHAR、GSSG 和DHA 分别表示单脱氢抗坏血酸还原酶、脱氢抗坏血酸还原酶、谷胱甘肽和氧化型抗坏血酸。MDHAR,DHAR,GSSG and DHA represent monodehydroascorbate reductase,dehydroascorbate reductase,glutathione and oxidized ascorbate,respectively.
4 结论
低温胁迫抑制紫花苜蓿种子的萌发及生长,主要表现为降低种子的发芽势和发芽指数,增加平均发芽时间;通过降低AsA-GSH 循环中GR、MDHAR、POD 活性、AsA 和GSH 含量,使胚根线粒体内的H2O2积累,产生氧化损伤,继而延缓了种子萌发的正常进程。
