棕榈粕替代部分玉米对藏羊母羊小肠形态发育、消化酶活性及抗氧化功能的影响
2023-03-21周力侯生珍王志有杨葆春韩丽娟桂林生
周力,侯生珍,王志有,杨葆春,韩丽娟,桂林生
(1. 青海大学农牧学院,青海 西宁 810016;2. 宁夏大学农学院,宁夏 银川 750021)
玉米(Zea mays)具有适口性好、能值高且易于消化吸收等许多优点,一直是动物饲料中主要的能量来源[1]。但随着玉米价格高涨,加上能量原料供应量不能满足规模化养羊业的需求,因此,积极寻找优质的能量饲料替代产品便成了当前畜牧业研究的热点。
棕榈粕(palm kernel meal,PKM)作为棕榈仁油加工后的副产物,产量丰富,营养价值较高且价格低廉,在畜禽饲料中的应用日渐广泛[2]。以福建龙岩麻鸭为研究对象[3],结果发现饲粮中棕榈粕添加水平对蛋鸭平均蛋重、蛋黄重和蛋壳重具有显著影响。樊庆山等[4]试验证实,3~5 月龄夏杂牛饲粮中棕榈粕可明显促进犊牛生长,同时还能提高机体的抗氧化功能。丁翠英[5]研究表明,在日粮中添加14.3%的棕榈粕能够提升荷斯坦奶牛的产奶量,改善乳成分,提高营养物质表观消化率,并有效增加养殖效益。其他试验亦发现[6],棕榈粕可以代替部分日粮中的部分苜蓿(Medicago sativa)草粉,在日粮中添加20%棕榈粕可以提高肉兔的生长性能且对饲料消化率无负面影响。基于上述研究结论,可知在饲粮中添加适宜比例的棕榈粕,可促进动物生长发育、降低饲养成本以及改善产品品质。
目前有关棕榈粕与反刍动物关系的研究较少,将其应用到绵羊饲粮中更是鲜有报道。因此,本试验采用不同比例的棕榈粕替换母羊精料补充料中部分玉米,通过分析不同比例棕榈粕饲粮对高原型藏羊肠道组织形态学、消化酶活性、pH、脂多糖及抗氧化能力的影响,以期为棕榈粕在藏羊饲粮中的推广应用提供理论依据。
1 材料与方法
1.1 试验时间和地点
试验时间:2021年5-8 月;试验地点:青海省海南州共和县香咔梅朵牧业有限公司。
1.2 动物选择与分组
试验以精料补充料中不同水平棕榈粕(0%、15%、18%和21%)为单因素随机试验设计,选取发育健康的2~3 月龄高原型藏羊母羊120 只,随机分为4 组,每组30 只,每组6 个重复,每个重复5 只母羊。试验分预饲期7 d,正试期90 d。
1.3 饲粮组成及饲养管理
根据母羊不同饲养阶段营养需要量,参考中国《肉羊饲养标准》(NY/T 816-2004)[7]进行饲料配制,基础饲粮组成和营养水平见表1。棕榈粕营养成分委托中国科学院西北高原研究所测定,其中水分7.90%,粗灰分4.60%,粗蛋白16.50%,粗纤维31.10%,粗脂肪6.00%,酸性洗涤纤维33.20%,中性洗涤纤维72.20%。饲粮由精料补充料、燕麦(Avena sativa)青干草和燕麦青贮(干物质基础)组成。整个试验分两个阶段,第一阶段为0~30 d,日粮精粗比为6∶4(精料∶燕麦青贮∶燕麦青干草=6∶2∶2),第二阶段为31~90 d,日粮精粗比为7∶3(精料∶燕麦青贮∶燕麦青干草=7∶1.5∶1.5)。试验期间每天上午(08:30)和下午(17:30)通过人工将饲料搅拌均匀后饲喂母羊两次,自由采食、自由饮水。试验开始前对圈舍清扫消毒,母羊进圈后按照常规方法进行防疫与驱虫。
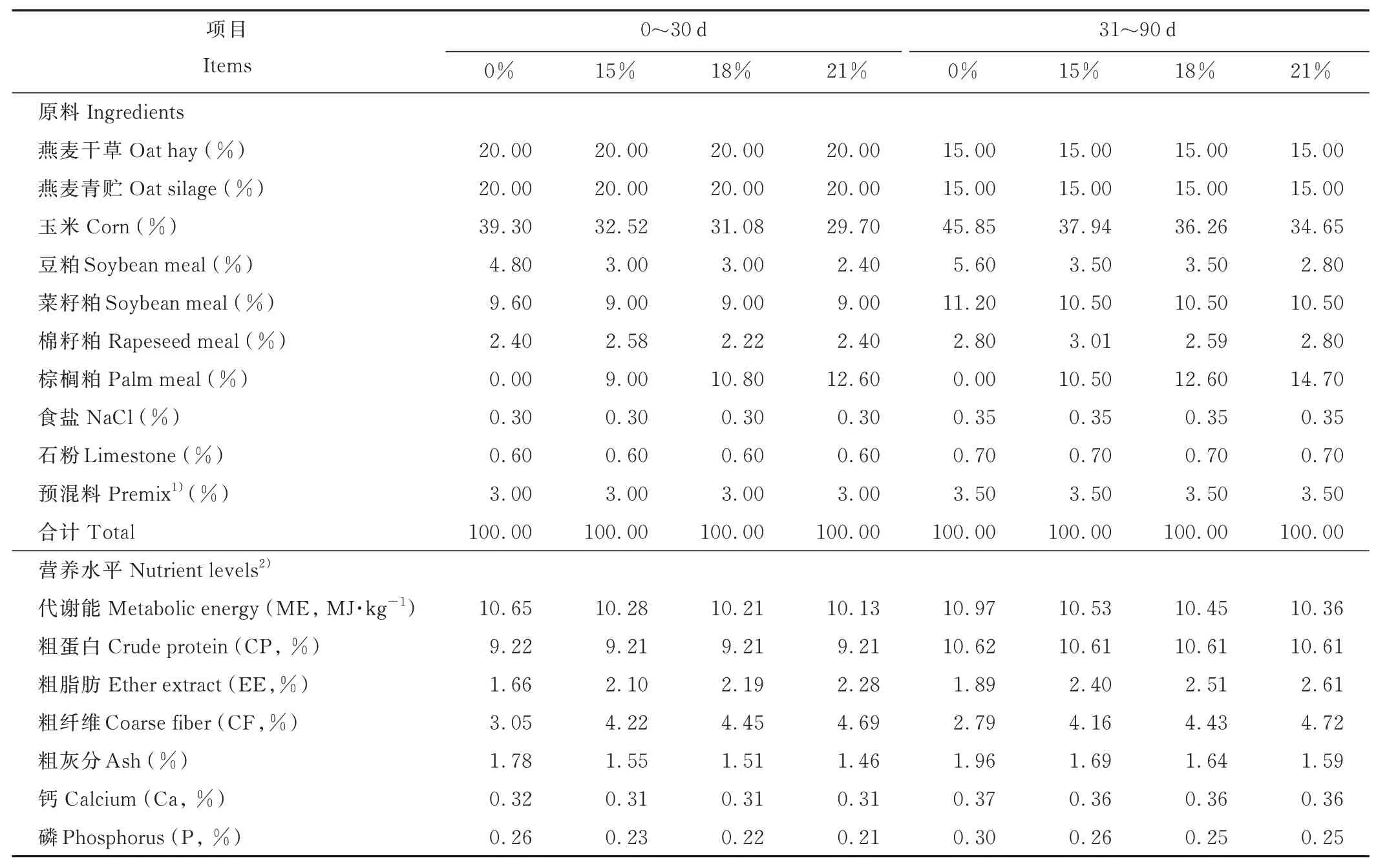
表1 基础饲粮组成及营养水平(干物质基础)Table 1 Composition and nutrient levels of basal diets(DM basis)
1.4 母羊屠宰及样品采集
试验结束时每组选取5 只接近平均体重的母羊(禁食12 h、禁水2 h)切断颈静脉放血致死,迅速打开腹腔,按马仲华[8]的方法分离出3 个肠段,剪取十二指肠、空肠和回肠2~3 cm 组织,生理盐水冲洗干净后放入4%的多聚甲醛中固定,时间不少于48 h,利用苏木精-伊红(hematoxylin eosin,HE)染色制作常规的石蜡切片。同时采集空肠食糜分装到离心管,立即投入液氮中保存待测。
1.5 小肠相关指标及测定方法
1.5.1 切片制作及组织形态学观察 运用Olympus-BX51(奥林巴斯有限责任公司,日本)显微照相系统观察小肠各段(十二指肠、空肠以及回肠)组织形态并拍照,通过Image-Pro Plus 6.0 图像分析软件测定十二指肠、空肠以及回肠的绒毛高度、绒毛宽度、隐窝深度、黏膜厚度,并计算绒毛高度/隐窝深度。每张切片选取5 个清晰完整的视野,每个视野测定4 组数据,结果取其平均值。
1.5.2 肠道食糜消化酶活性的分析 α-淀粉酶(α-amylase)、纤维素酶(cellulase,CE)、脂肪酶(lipase)、胰蛋白酶(trypsin,TPS)和糜蛋白酶(chymotrypsin)活性由江苏酶标生物科技有限公司提供的试剂盒测定。
1.5.3 肠道食糜抗氧化能力的检测 总抗氧化能力(total antioxygentic capacity,T-AOC)和丙二醛(malondialdehyde,MDA)含量,超氧化物歧化酶(superoxide dismutase,SOD)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)和过氧化氢酶(catalase,CAT)活性由南京建成生物工程研究所提供的试剂盒测定。
1.5.4 肠道食糜pH 和脂多糖的测定 现场使用便携式PHS-3C 型pH 计(上海仪电科学仪器股份有限公司,中国)对母羊小肠内容物的pH 进行测定并详细记录其数值,同时利用酶联免疫吸附(enzyme-linked immunosorbent assay,ELISA)方法在Varioskan LUX 多功能酶标分析仪(新加坡)上以空白孔调零,450 nm 波长下依序测定各孔脂多糖(lipopolysaccharide,LPS)的吸光度(OD 值)。
1.6 数据分析
试验数据经Excel 2016 初步统计后,采用SPSS 25.0 软件进行单因素方差分析(one-way ANOVA),同时使用Duncan’s 法进行多重比较,试验结果以“平均值和标准误”表示,以P<0.05 表示差异显著,以P<0.01 表示差异极显著,0.05<P<0.10 为统计学上有趋势。
2 结果与分析
2.1 不同比例棕榈粕饲粮对藏羊母羊肠道形态发育的影响
从表2 和图1 可知,0%组和15%组十二指肠的绒毛高度显著高于其他2 组(P<0.05);其中0%组与15%组差异不显著(P>0.05);0%组十二指肠的绒毛宽度极显著高于18%组和21%组(P<0.01),与15%组相比差异不显著(P>0.05);各组间十二指肠的隐窝深度差异不显著(P>0.05);0%组十二指肠的黏膜厚度显著高于21%组(P<0.05),相较于15%组和18%组差异不显著(P>0.05);21%组十二指肠的绒毛高度/隐窝深度低于其他3 组,其中21%组与0%组、15%组差异极显著(P<0.01)。
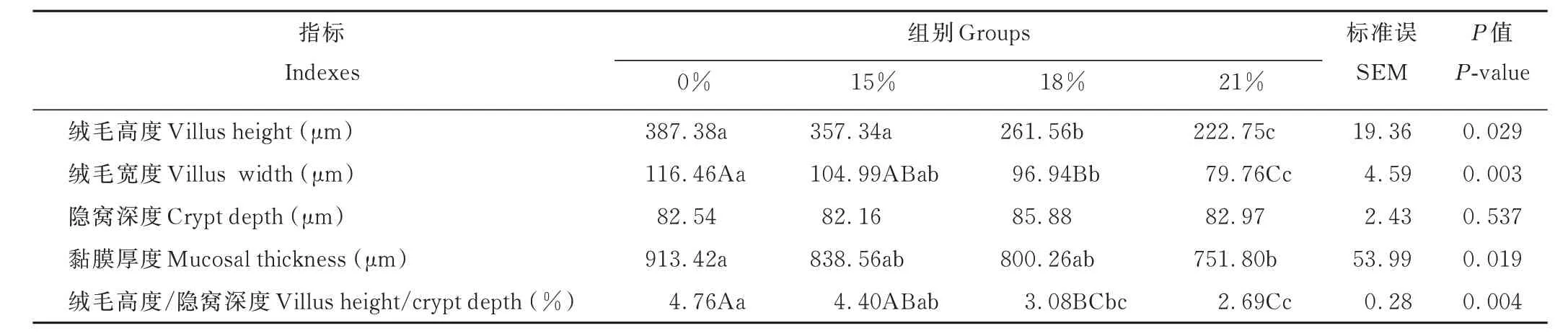
表2 棕榈粕替代玉米对藏羊母羊十二指肠组织形态的影响Table 2 Effect of palm meal instead of corn on duodenal tissue morphology of Tibetan sheep ewe
图1 不同比例棕榈粕饲粮条件下藏羊母羊十二指肠的石蜡切片Fig.1 Paraffin sections of duodenum of Tibetan sheep ewe fed with different proportion of palm meal(10×10)
从表3 和图2 可知,18%组空肠的绒毛高度显著低于15%组和21%组(P<0.05),且与0%组差异不显著(P>0.05);21%组空肠的绒毛宽度显著高于0%组与18%组(P<0.05),且与15%组差异不显著(P>0.05);18%组空肠的隐窝深度、黏膜厚度低于其他3 组,其中18%组与15%组、21%组差异显著(P<0.05);各组间空肠的绒毛高度/隐窝深度差异不显著(P>0.05)。

图2 不同比例棕榈粕饲粮条件下藏羊母羊空肠的石蜡切片Fig.2 Paraffin sections of jejunum of Tibetan sheep ewe under different proportion of palm meal diet(10×10)
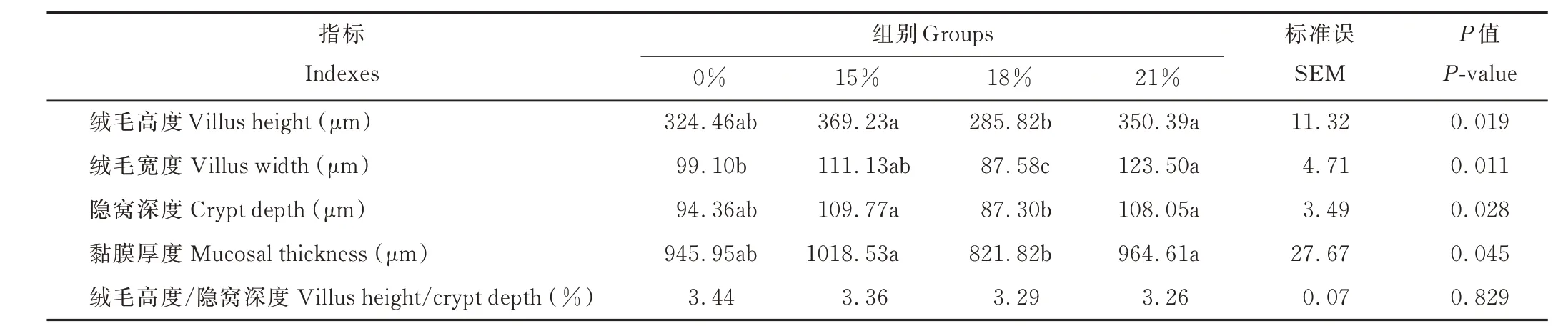
表3 棕榈粕替代玉米对藏羊母羊空肠组织形态的影响Table 3 Effects of palm meal instead of corn on jejunum morphology of Tibetan sheep ewe
从表4 和图3 可知,15%组回肠的绒毛高度高于其他3 组,其中15%组与18%组、21%组差异显著(P<0.05);各组间回肠的绒毛宽度差异不显著(P>0.05);0%组回肠的隐窝深度高于其他3 组(0.05<P<0.10);0%组和15%组回肠的黏膜厚度显著高于其他两组(P<0.05);15%组回肠的绒毛高度/隐窝深度高于其他3 组(0.05<P<0.10)。
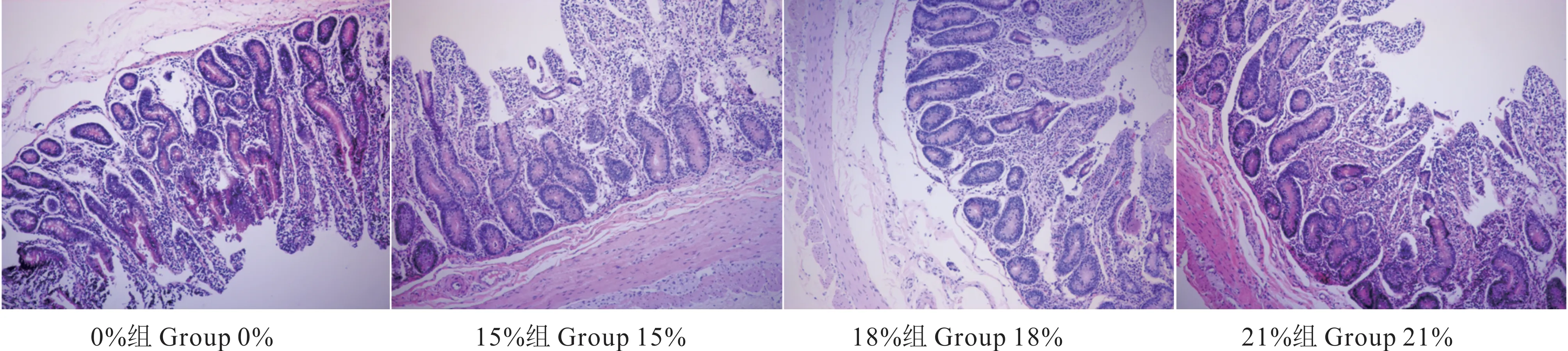
图3 不同比例棕榈粕饲粮条件下藏羊母羊回肠的石蜡切片Fig.3 Paraffin sections of ileum of Tibetan sheep ewe under different proportion of palm meal diet(10×10)

表4 棕榈粕替代玉米对藏羊母羊回肠组织形态的影响Table 4 Effect of palm meal instead of corn on ileum morphology of Tibetan sheep ewe
2.2 不同比例棕榈粕饲粮对藏羊母羊空肠消化酶活性的影响
从表5 可知,15%组空肠的α-淀粉酶活性显著高于其他3 组(P<0.05);0%组空肠的纤维素酶活性显著低于15%组和21%组(P<0.05),且0%组与18%组间差异不显著(P>0.05);15%组和21%组空肠的脂肪酶活性极显著高于0%组与18%组(P<0.01),其中15%组和21%组差异不显著(P>0.05);0%组空肠的糜蛋白酶活性显著低于15%组和18%组(P<0.05),且与21%组差异不显著(P>0.05);各组间空肠的胰蛋白酶活性差异不显著(P>0.05)。
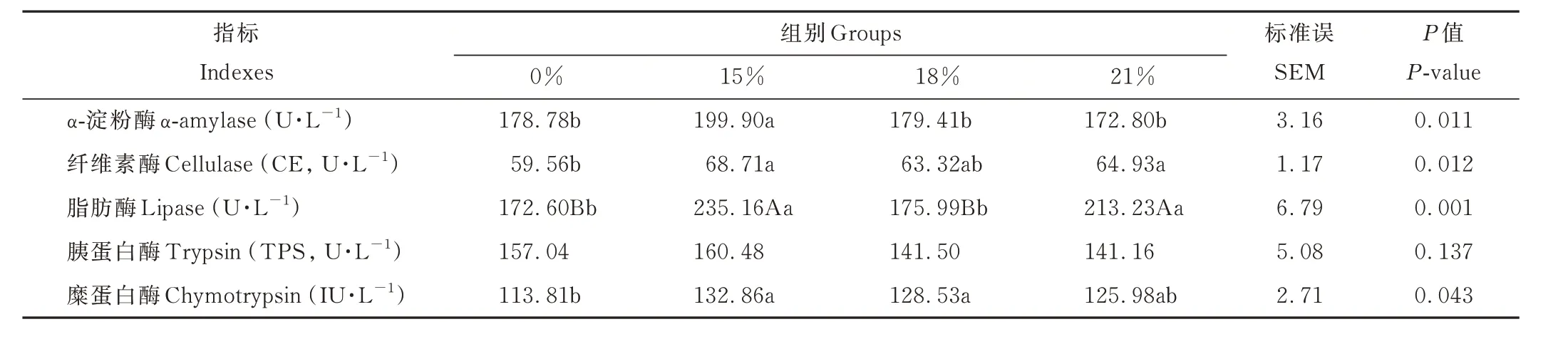
表5 棕榈粕替代玉米对藏羊母羊空肠消化酶活性的影响Table 5 Effect of palm meal instead of corn on jejunum digestive enzyme activity of Tibetan sheep ewe
2.3 不同比例棕榈粕饲粮对藏羊母羊空肠抗氧化指标的影响
从表6 可知,15%组空肠的谷胱甘肽过氧化物酶活性显著高于其他3 组(P<0.05);0%组空肠的过氧化氢酶活性显著低于15%组和18%组(P<0.05),与21%组差异不显著(P>0.05);18%组空肠的总抗氧化能力高于其他3 组(0.05<P<0.10);15%组空肠的超氧化物歧化酶活性高于其他3 组(0.05<P<0.10);各组间空肠的丙二醛含量差异不显著(P>0.05)。
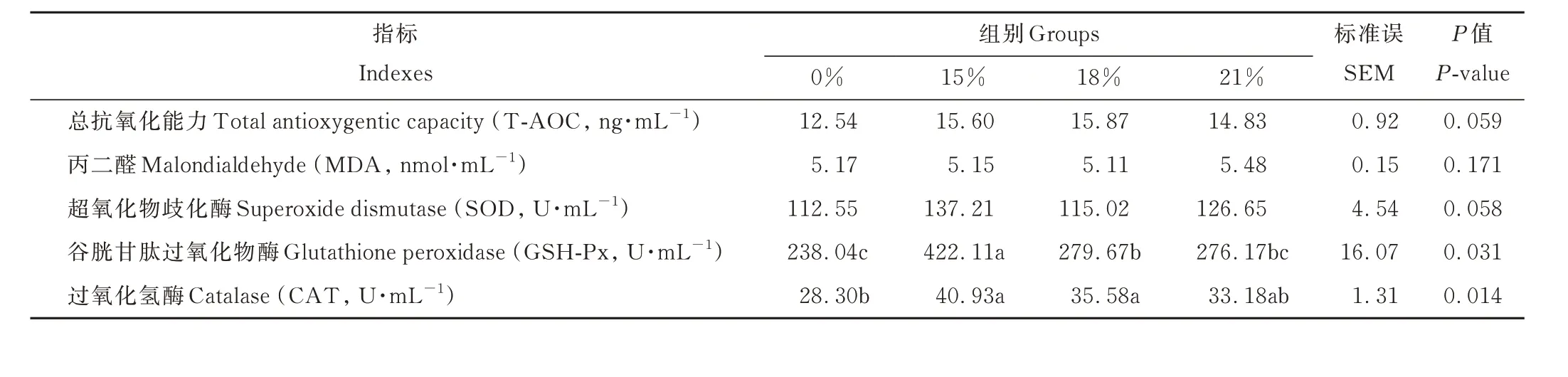
表6 棕榈粕替代玉米对藏羊母羊空肠抗氧化能力的影响Table 6 Effect of palm meal instead of corn on jejunum antioxidant capacity of Tibetan sheep ewe
2.4 不同比例棕榈粕饲粮对藏羊母羊空肠pH 和脂多糖的影响
从图4 可知,与0%组相比,其他3 组空肠pH 值均有所下降(0.05<P<0.10);0%组空肠脂多糖含量显著或极显著低于18%组和21%组(P<0.05 或P<0.01),且0%组与15%组间差异不显著(P>0.05)。
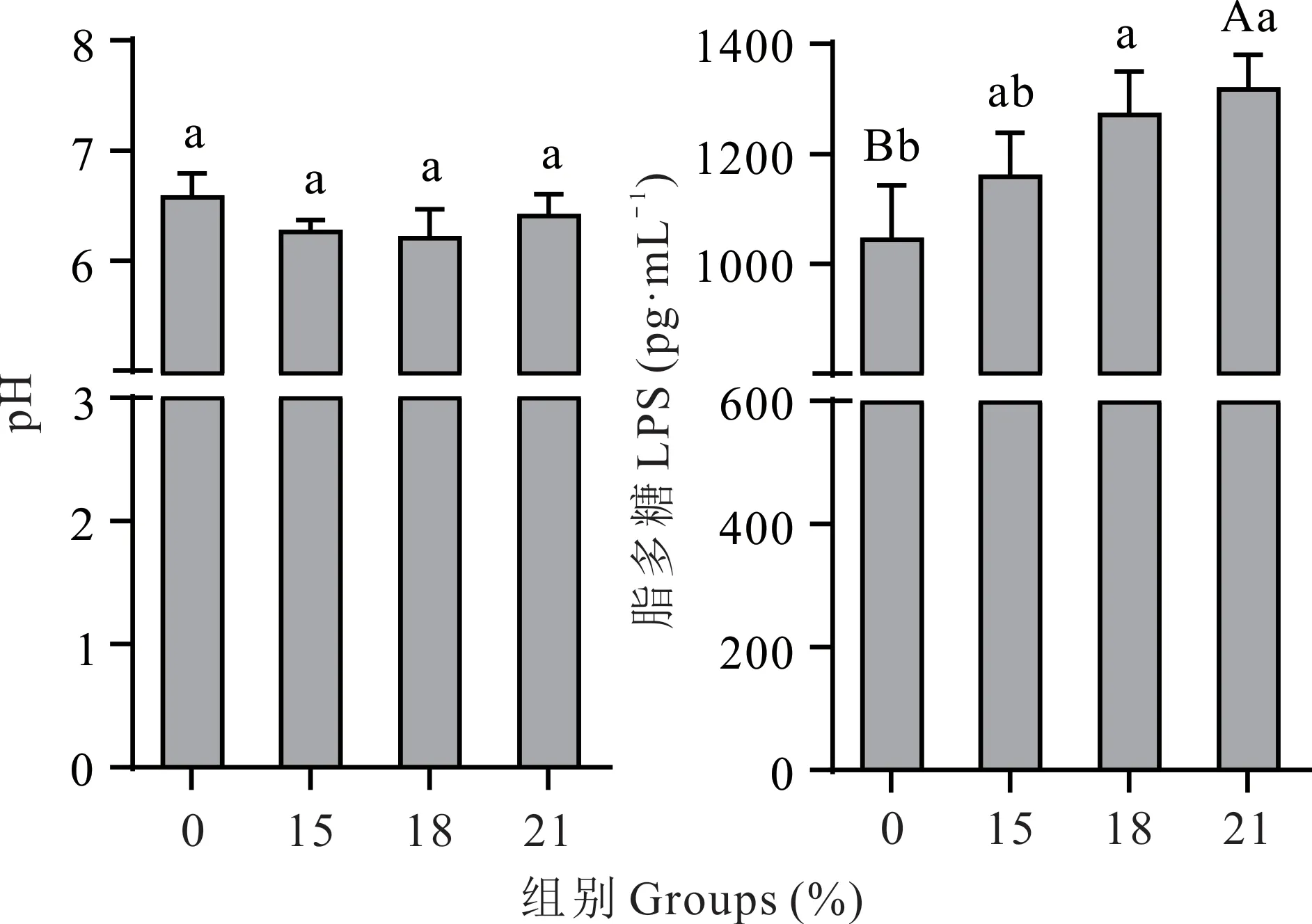
图4 棕榈粕替代玉米对藏羊母羊空肠pH 和脂多糖的影响Fig. 4 Effect of palm meal instead of corn on pH and lipopolysaccharide in jejunum of Tibetan sheep ewe不同小写字母表示差异显著(P<0.05),不同大写字母表示差异极显著(P<0.01),相同 字 母表 示差 异 不显 著(P>0.05)。Different small letters mean significant differences(P<0.05),different capital letters mean significant differences(P<0.01),and the same letter means no significant differences(P>0.05).
3 讨论
3.1 不同比例棕榈粕饲粮对藏羊母羊肠道形态发育的影响
反刍动物肠道发育受多种因素影响与调节,如激素、断奶日龄、生长因子等,其中饲粮组成也是一个重要的方面[9]。众所周知,小肠是反刍动物养分消化、吸收和转运的主要场所[10],其黏膜结构是其消化吸收功能的前提基础[11]。肠绒毛的高度越高,代表其成熟细胞越多,吸收营养物质的能力就越强[12]。本研究中,与0%组相比,饲喂15%棕榈粕具有促进空肠和回肠的绒毛高度、宽度的趋势。这说明15%棕榈粕替代部分玉米对藏羊空肠和回肠发育无不利影响。隐窝深度是反映细胞生成率的指标,当小肠隐窝深度越浅,说明动物肠道的分泌和吸收功能就越强[13]。此外,隐窝越浅还能表示进一步加快肠道黏膜细胞的生长发育,增强肠道损伤的修复作用并能有效提高动物的生产性能。而本试验发现,与0%组相比,15%组各肠段的隐窝深度差异不显著。这表明饲喂15%棕榈粕替代精料补充料中玉米未对藏羊小肠吸收能力产生显著影响。黏膜作为机体免疫系统的第1 道免疫防线,对抵抗外来致病菌的入侵具有重要作用。研究表明,反刍动物肠道黏膜厚度的增强有利于提高抗菌、抗炎的能力,可有效减少肠道疾病的发生[14]。从本试验结果来看,使用不同比例的棕榈粕替代玉米,与0%组相比,15%棕榈粕有利于增加藏羊小肠(除十二指肠外)的黏膜厚度。在湖羊上研究发现[15],绒隐比(绒毛高度/隐窝深度)代表小肠黏膜的成熟度,其比值与绒毛中成熟细胞的占比有关。本试验结果发现,相较于0%组,饲喂18%和21%组极显著降低了十二指肠的绒毛高度/隐窝深度,但使用15%棕榈粕则差异不显著。推测其原因:可能是15%棕榈粕能够有效调节藏羊肠道微生物区系和菌群,使其达到了一个最佳的平衡状态,从而改善了肠道发育。因此,饲喂15%棕榈粕能够明显促进藏羊肠道绒毛生长状况,并有助于肠道黏膜结构的完善。
3.2 不同比例棕榈粕饲粮对藏羊母羊空肠消化酶活性的影响
消化酶活性的高低可反映反刍动物采食性能,同时还能直接决定肠道对营养物质吸收和利用的程度[16]。机体的消化功能与其胃肠道所产生的消化酶活性及其分泌量呈正相关,继而影响动物的生长发育[17]。研究证实,日粮中外源酶蛋白酶可促进消化道中淀粉酶的活性,进而提高日粮消化率[18]。蛋白酶活性对小肠中蛋白质、氨基酸以及小肽消化吸收发挥着重要的作用[19]。在本试验中,与0%组相比,15%组空肠的胰蛋白酶活性差异不显著,但0%组空肠的糜蛋白酶活性显著低于15%组。本试验中,与0%组相比,15%组空肠的α-淀粉酶活性显著增加,这可能由于消化酶之间的协同效应所致。脂肪酶作为一种可诱导的胞外酶,其活性大小与摄入饲料中脂肪含量有关[20]。而本试验中,15%组空肠的脂肪酶活性极显著高于0%组,推测可能是由于饲料总营养物质的来源差异导致的,棕榈粕中含有较高的纤维含量以及脂肪含量,能够为脂肪酶提供更多的作用底物,进而促进脂肪酶的活性。此外,本试验亦发现,与0%组相比,15%组和21%组空肠的纤维素酶活性显著增强。由此可见,高纤维含量的棕榈粕能够被消化道微生物分解成更多的挥发性脂肪酸,而挥发性脂肪酸可以作为纤维分解菌的能量来源,进而增加纤维素酶的相对活性。因相关内容报道较少,具体作用机理还有待接下来深入研究。
3.3 不同比例棕榈粕饲粮对藏羊母羊空肠抗氧化能力的影响
正常情况下,机体内氧化系统和抗氧化系统之间处于平衡状态。然而当体内氧化与抗氧化状态失去平衡时,自由基可使肠道消化酶失去活性,蛋白质发生变性,从而破坏肠道功能[21]。因此,提高肠道抗氧化能力对于发挥动物肠道正常功能、促进正常生长以及维持健康均有着十分重要的意义。一般来讲,总抗氧化能力、丙二醛含量,超氧化物歧化酶、谷胱甘肽过氧化物酶以及过氧化氢酶活性等是评判机体抗氧化能力的重要指标[22]。研究证实[23],滩羊血清中总抗氧化能力提高或丙二醛含量下降时,表明机体抗氧化能力增强。本试验对藏羊母羊空肠食糜进行总抗氧化能力和丙二醛含量检测,发现各组间总抗氧化能力与丙二醛含量差异不显著。这提示采用不同比例的棕榈粕替代玉米未对藏羊母羊肠道抗氧化能力产生不利影响,具有一定的可行性。另外,动物体内也存在多种抗氧化酶,包括超氧化物歧化酶、谷胱甘肽过氧化物酶和过氧化氢酶等,彼此之间相互协调构成了体内清除自由基的第1 道酶防御机制[24]。谷胱甘肽过氧化物酶、超氧化物歧化酶和过氧化氢酶活性增强也表示机体抗氧化酶活性提高。本试验结果显示,与0%组相比,15%组空肠食糜谷胱甘肽过氧化物酶、过氧化氢酶活性显著增强。这意味着在饲粮中添加15%棕榈粕可以显著增强藏羊抗氧化酶活性。
3.4 不同比例棕榈粕饲粮对藏羊母羊空肠pH 和脂多糖的影响
肠道酸碱度是维持动物体内菌群动态平衡的一个重要因素[25]。pH 值的高低可直接影响肠道消化吸收功能。保持适宜的酸性环境可增强肠道的消化酶活性,提高对饲料的利用率,同时还能有效抑制有害微生物的生长,维持反刍动物机体健康[26]。研究表明,pH 值偏酸性有利于乳酸杆菌、双歧杆菌等有益菌的繁殖,进而提高动物的生长性能,增强抗病能力[27]。本试验发现,相较于0%组,其余3 组空肠食糜的pH 值均有所下降。由此可以看出,饲喂不同比例的棕榈粕替代精料补充料中玉米能在一定程度上改善藏羊肠道菌群。脂多糖又称内毒素,广泛存在于革兰氏阴性细菌细胞外膜,在细菌快速生长或裂解死亡时都会释放大量脂多糖[28]。在奶牛上研究证实[29],饲喂精料比例过高或有效中性洗涤纤维缺乏的饲粮时,可造成胃肠道中内毒素浓度显著增加。其他试验也表明,脂多糖能够引起肠道形态学损伤,如黏膜出现水肿、出血,甚至发生坏死[30]。在本试验中,18%组与21%组藏羊空肠食糜脂多糖含量显著或极显著高于0%组,且0%组和15%组差异不显著。这进一步表明,在饲粮中添加过量的棕榈粕能够损伤肠道黏膜结构。
4 结论
在本研究条件下,推荐使用15%棕榈粕替代精料补充料中玉米更有利于完善高原型藏羊肠道黏膜结构,增强空肠消化酶活性和提高抗氧化能力。
