超高效液相色谱-串联质谱法测定调味料中吗啡、可待因、蒂巴因、那可丁和罂粟碱残留量
2023-03-20张哲张莹赵桐赵灵智沈晶萍王世琨李思圆
张哲,张莹,赵桐,赵灵智,沈晶萍,王世琨,李思圆
(吉林农业大学 生命科学学院,长春 130118)
罂粟壳中含有吗啡、可待因、罂粟碱、那可丁、蒂巴因等生物碱,因其具有镇静、止痛、成瘾、损害神经系统等特性被列为毒品,严禁将其添加到食品中。由于火锅底料中添加罂粟壳会使火锅味道更美、口感更足,食用后容易上瘾,有些不良商家将罂粟壳加入火锅调料中以吸引回头客来牟取利益[1]。国家早在2008年印发了《食品中可能违法添加的非食用物质和易滥用的食品添加剂品种名单(第一批)》,规定火锅中不得违法添加罂粟壳,2011年又将禁用的食品类别扩大到火锅底料及小吃。历年发布的《国家食品安全抽检实施细则》中更是明确将吗啡、可待因、罂粟碱、那可丁、蒂巴因列为餐饮食品自制火锅调味料(底料、蘸料)的日常监测项目。
目前食品中罂粟壳成分的检测方法主要有气相色谱法[2]、液相色谱法、气相色谱/质谱法、液相色谱-质谱/质谱法。其中液相色谱-质谱/质谱法因具有分辨率高、灵敏度高、检测限低,定性、定量准确,可进行痕量分析等特点,已被市场监管总局指定为检测食品中吗啡、可待因、罂粟碱、那可丁和蒂巴因的补充检验方法,成为检测罂粟壳类生物碱的主要方法[3-4]。在色谱柱选择上,由于吗啡等生物碱极性大,在普通C18反相柱上保留时间短、峰形差,达不到较好的分离效果[5],大多采用BEH HILIC色谱柱进行检测[6-10]。然而HILIC柱为正向色谱柱,使用溶剂有限,只能使用70%以上乙腈,难以预平衡,且价格昂贵、使用寿命短,实验室普及率不高[11-12]。在样品前处理上,QuEChERS净化法操作简单,但净化效果不理想,且对吗啡等有强吸附,回收率低[13-16],常采用阳离子交换固相萃取净化法[17-18],而阳离子交换固相萃取柱除油脂效果不理想,操作较繁琐,且容易发生小柱堵塞现象[19-20],无法实现批量检测。
本试验采用实验室常用的Kinetex®2.6 μm Biphenyl 100 Å反相色谱柱分离,建立超高效液相色谱-串联质谱法测定调味料中罂粟壳类生物碱,吗啡等5种生物碱得到了很好的色谱保留和分离,且峰形对称;在样品处理上,样品经乙腈提取、盐析、低温高速离心后,将提取液氮吹近干,用10%乙腈溶液(含0.1%甲酸)溶解残渣后,再经低温高速离心、过膜除去样品中干扰物,获得了理想的净化、回收效果,使样品前处理过程更加简便,适合大批量的日常分析检测。
1 材料与方法
1.1 材料
调味料:固态火锅底料、半固态米线调味酱、半固态小龙虾调味酱、汤料共4种,购于超市。
自制火锅调味料(蘸料):海鲜汁、沙茶酱、孜然油、麻油、辣椒油、芝麻油共6种,购于火锅店。
1.2 试剂
甲醇中吗啡标准溶液(M-005-1ML,浓度1 mg/mL)、甲醇中可待因标准溶液(C-006-1ML,浓度1 mg/mL)、甲醇中蒂巴因标准溶液(T-115-1ML,浓度1 mg/mL)、甲醇中吗啡-D3标准溶液(M-006-1ML,浓度1 mg/mL)、甲醇中可待因-D3标准溶液(C-007-1ML,浓度1 mg/mL):Cerilliant;盐酸罂粟碱标准物质(纯度99.9%,CCHM700898)、那可丁标准物质(纯度97%,CCHM700909):CATO Research Chemicals Inc.;甲醇(色谱纯)、乙腈(色谱纯):Fisher Scientific公司;甲酸(色谱纯):上海安谱实验科技股份有限公司;无水乙酸钠(分析纯):天津市致远化学试剂有限公司;无水硫酸镁(分析纯):北京迈瑞达科技有限公司;0.1%甲酸-水溶液(体积比);0.1%甲酸-甲醇溶液(体积比);10%乙腈-水溶液(含0.1%甲酸);针头过滤器(0.2 μm,13 mm):Pall Corporation。
1.3 主要仪器与设备
API4000+超高效液相色谱-串联质谱联用仪(ESI离子源) 美国AB SCIEX公司;Kinetex®2.6 μm Biphenyl 100 Å色谱柱(100 mm×3.0 mm) 美国Phenomenex公司;涡旋混合器(重载数显型) 美国Talboys公司;KQ-500DE超声波清洗器 江苏昆山市超声仪器有限公司;KH20R-Ⅱ高速冷冻离心机 湖南凯达科学仪器有限公司;TTL-DC氮吹仪 北京同泰联科技发展有限公司。
1.4 液相色谱-质谱/质谱条件
1.4.1 色谱条件
色谱柱:Kinetex®2.6 μm Biphenyl 100 Å(100 mm×3.0 mm);柱温:40 ℃;流速:0.4 mL/min;进样量:5 μL;流动相:A相为 0.1%甲酸-水(体积比),B相为0.1%甲酸-甲醇(体积比)。流动相及梯度洗脱条件见表1。

表1 流动相及梯度洗脱条件Table 1 Mobile phases and gradient elution conditions
1.4.2 质谱条件
离子源:ESI;扫描方式:正离子模式,多反应监测(MRM);离子源参数:电喷雾电压(IS):5 500 V;雾化气压力(GS1):55 psi;辅助气压力(GS2):60 psi;气帘气压力(CUR):30 psi;离子源温度(TEM):550 ℃;喷撞气(CAD):10 mL/min。监测离子对、碰撞气能量和去簇电压参数见表2。

表2 监测离子对、碰撞气能量和去簇电压参数 Table 2 Monitoring ion pair,collision gas energy and declustering potential parameters
1.5 标准溶液配制
1.5.1 标准储备液配制
精密称取罂粟碱、那可丁标准品各10 mg(精确至0.01 mg),分别置于10 mL容量瓶中,加0.5%甲酸-甲醇溶液溶解并定容至刻度,罂粟碱、那可丁浓度各1.0 mg/mL。吗啡、可待因、蒂巴因、吗啡-D3、可待因-D3均为购置现成的标准溶液,其浓度均为1.0 mg/mL。
1.5.2 混合标准溶液配制
准确吸取吗啡、可待因标准储备液各100 μL,蒂巴因标准储备液20 μL,那可丁、罂粟碱标准储备液各10 μL于10 mL容量瓶中,用乙腈稀释并定容于10 mL。配制的混合标准溶液中吗啡、可待因浓度为10 μg/mL,蒂巴因浓度为2 μg/mL,那可丁、罂粟碱浓度为1 μg/mL。
1.5.3 混合标准使用液配制
准确吸取混合标准溶液0.1 mL于10 mL容量瓶中,用20%乙腈水溶液定容至刻度。配制的混合标准使用液中吗啡、可待因浓度为100 ng/mL,蒂巴因浓度为20 ng/mL,那可丁、罂粟碱浓度为10 ng/mL。
1.5.4 混合内标溶液配制
准确吸取吗啡-D3、可待因-D3标准储备液各10 μL于10 mL容量瓶中,用乙腈稀释并定容于10 mL。配制的混合内标溶液的浓度均为1 μg/mL。
1.5.5 混合内标工作液配制
准确吸取混合内标溶液1.0 mL于10 mL容量瓶中,用20%乙腈水溶液定容至刻度。配制的混合内标工作液的浓度均为100 ng/mL。
1.5.6 混合标准工作溶液系列配制
分别准确吸取混合标准使用液5,10,20,50,100,200 μL于6个样品瓶中,各加入100 ng/mL混合内标工作液50 μL,用10%乙腈-水溶液(含0.1%甲酸)定容至1.0 mL,混匀。配制的混合标准工作溶液系列中吗啡、可待因浓度分别为0.5,1.0,2.0,5.0,10.0,20.0 ng/mL;蒂巴因浓度分别为0.1,0.2,0.4,1.0,2.0,4.0 ng/mL;那可丁、罂粟碱浓度分别为0.05,0.1,0.2,0.5,1.0,2.0 ng/mL。此混合标准工作溶液中内标浓度均为5.0 ng/mL。
1.6 样品处理
称取1.50 g(精确至0.01 g)试样于50 mL离心管中,加入1 μg/mL混合内标溶液75 μL,固体样品加3 mL水,半固体样品加2 mL水,液体样品不加水,涡旋振荡30 s,准确加入乙腈15 mL,涡旋1 min,超声提取30 min,加入6 g无水硫酸镁和1.5 g无水醋酸钠粉末,立即涡旋振荡2 min,吸附样品中的全部水分,以9 500 r/min离心5 min(4 ℃),准确吸取1.0 mL上清液于10 mL浓缩管中,于40 ℃水浴中氮吹至近干,准确加入1.0 mL 10%乙腈溶液(含0.1%甲酸)溶解残渣,涡旋1 min,超声2 min,再涡旋1 min后,将溶液转移至1.5 mL离心管中,以9 500 r/min离心5 min(4 ℃),上清液过0.22 μm滤膜后,进行超高效液相色谱-串联质谱测定。
2 结果与分析
2.1 色谱柱的选择
以0.1%甲酸-水-0.1%甲酸-乙腈为流动相,考察了Kinetex®2.6 μm Biphenyl 100 Å(100 mm×3.0 mm)和Kinetex®2.6 μm F5 100 Å(50 mm×3.0 mm)两款反相色谱柱对吗啡、可待因、蒂巴因、那可丁和罂粟碱的分离效果,结果:在Kinetex®2.6 μm F5 100 Å色谱柱上,吗啡岀峰快,保留时间短,峰形较宽、不对称,响应值低,且5种生物碱各离子对的离子比不稳定(见图1),可见此款反相色谱柱不是首选柱,这与文献[5]、文献[20]的研究结果一致;而在Kinetex®2.6 μm Biphenyl 100 Å色谱柱上,吗啡等5种生物碱均有合适的保留时间和令人满意的峰形,且响应值增高(见图2)。分析原因:Kinetex®2.6 μm Biphenyl 100 Å柱是一款核-壳联苯基色谱柱,这种由核-壳颗粒带来的高性能配合独特的固定相,可以实现反相保留以及增强极性与芳香类化合物的选择性,且能显著改善色谱峰形,提高灵敏度,其色谱分离相互作用机理:由联苯基双环结构所产生的高密度电子云可起到类似弱阳离子交换的作用,使得碱性分析物的保留增强。

图1 Kinetex® 2.6 μm F5 100 Å柱-混合标准工作溶液总离子流色谱图Fig.1 The total ion current chromatogram of Kinetex® 2.6 μm F5 100 Å column-mixed standard working solution

图2 Kinetex® 2.6 μm Biphenyl 100 Å柱-混合标准工作溶液总离子流色谱图Fig.2 The total ion current chromatogram of Kinetex® 2.6 μm Biphenyl 100 Å column-mixed standard working solution
2.2 流动相的选择
在Kinetex®2.6 μm Biphenyl 100 Å色谱柱(100 mm×3.0 mm)上分离,分别以0.1%甲酸-水和0.1%甲酸-乙腈,0.1%甲酸-水(含10 mmol/L甲酸铵)和0.1%甲酸-乙腈,0.1%甲酸-水和0.1%甲酸-甲醇为流动相,按表1中梯度程序洗脱,考察3种流动相对吗啡、可待因、蒂巴因、那可丁和罂粟碱的分离效果,结果表明,以0.1%甲酸-水和0.1%甲酸-乙腈为流动相,那可丁和罂粟碱两色谱峰重合(见图2),在0.1%甲酸-水中加入10 mmol/L甲酸铵后,那可丁和罂粟碱两峰不但没有分开,5种生物碱的响应值反而下降。改用0.1%甲酸-水和0.1%甲酸-甲醇为流动相,5种生物碱均得到了良好的色谱分离,各离子对的离子比更稳定,且吗啡、可待因的响应值显著提高(见图3),故选用0.1%甲酸-水和0.1%甲酸-甲醇为流动相。

图3 5种生物碱混合标准工作溶液的总离子流色谱图Fig.3 The total ion current chromatogram of mixed standard working solution of five kinds of alkaloids
2.3 质谱条件优化
根据5种生物碱的化学性质,采用电喷雾电离正离子模式扫描。针泵进样100 ng/mL标准溶液,5种生物碱离子化时均得到[M+H]+分子离子作为母离子。调节碰撞气能量(CE)值,将母离子进一步碰碎,分别选择响应值较高的两个子离子,按多反应监测(MRM)组建监测离子对,用Ramp进一步优化碰撞气能量CE和去簇电压DP参数(见表2)。设定离子源参数和液相色谱参数,进样分析混合标准工作溶液,验证所选择的离子对的响应值和稳定性满足检测要求。5种生物碱混合标准工作溶液的多反应监测(MRM)色谱图见图4。










图4 5种生物碱混合标准工作溶液的多反应监测(MRM)色谱图Fig.4 Multi-reaction monitoring (MRM) chromatograms of mixed standard working solution of five kinds of alkaloids
2.4 前处理方法优化
文献中,样品提取后主要有两种净化方法:一是QuEChERS试剂净化,二是阳离子交换固相萃取净化。QuEChERS净化法操作简单,但回收率低,而阳离子交换固相萃取净化法操作较繁琐,且容易堵塞小柱。本文在BJS 201802《食品中吗啡、可待因、罂粟碱、那可丁和蒂巴因的测定》方法的基础上进行了改进,固体样品加3 mL水,半固体样品加2 mL水,液体样品不加水,加乙腈15 mL超声提取,保证样液中乙腈含量大于80%,可有效沉淀蛋白质,加入无水醋酸钠促进生物碱从水相转移至有机相,并用无水硫酸镁去除水相,在4 ℃下9 500 r/min高速离心,有效分层去除蛋白质、油脂等杂质。吸取1 mL乙腈提取液氮吹近干,加1 mL 10%乙腈溶液(含0.1%甲酸)溶解残渣,进行溶剂转换,再在4 ℃下9 500 r/min高速离心、过膜,目的是进一步去除有机物杂质来净化样液。同时,用10%乙腈溶液(含0.1%甲酸)溶解样液,可以避免出现溶剂效应而导致吗啡、可待因峰形展宽,响应值降低的情况发生。结果表明,5种生物碱的回收率均达75%以上。
2.5 方法的校准曲线和检出限
按本文优化的色谱质谱条件,对混合标准工作溶液系列进行测定,以吗啡、可待因的峰面积与相应内标物峰面积的比值为纵坐标,吗啡、可待因的浓度与相应内标物浓度的比值为横坐标,绘制内标-标准工作曲线;以蒂巴因、那可丁、罂粟碱的峰面积为纵坐标,蒂巴因、那可丁、罂粟碱的浓度为横坐标,绘制外标-标准工作曲线,回归方程和相关系数见表3。结果表明,吗啡、可待因在0.50~20.0 ng/mL,蒂巴因在0.10~4.0 ng/mL,那可丁、罂粟碱在0.05~2.0 ng/mL范围内均有良好的线性关系,相关系数r均大于0.998。另外,在半固态调味酱空白样品中加入低浓度混合标准工作液,制备加标样品,按本文方法进行提取测定并计算其信噪比,以3倍信噪比(S/N=3)对应的加标量为最低检出限。由吗啡、可待因、蒂巴因、那可丁、罂粟碱的信噪比图(见图5~图9)可知,吗啡、可待因的方法检出限为1.0 μg/kg,蒂巴因的方法检出限为0.2 μg/kg,那可丁、罂粟碱的方法检出限为0.1 μg/kg。该方法检出限低,适用于调味料中吗啡、可待因、蒂巴因、那可丁和罂粟碱的痕量分析。
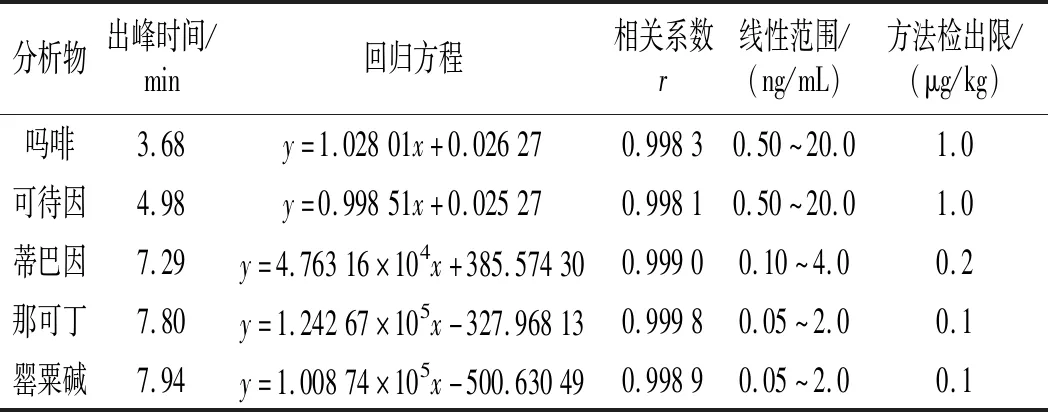
表3 标准曲线的回归分析和方法检出限Table 3 Regression analysis and method detection limits of standard curves
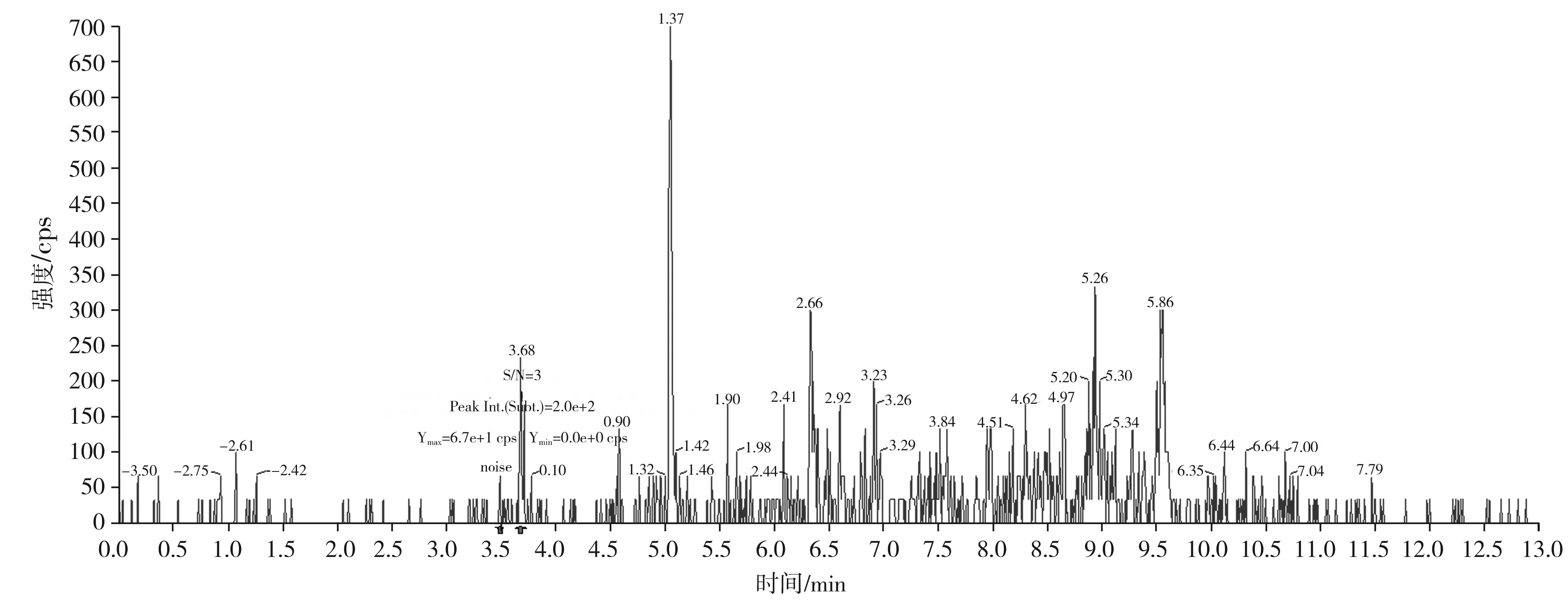
图5 吗啡定量离子对286.0/165.1的信噪比图(加标量1.0 μg/kg)Fig.5 The signal to noise ratio diagram of morphine quantitative ion pair 286.0/165.1 (with adding standard matter amount of 1.0 μg/kg)

图6 可待因定量离子对300.0/215.1的信噪比图(加标量1.0 μg/kg)Fig.6 The signal to noise ratio diagram of codeine quantitative ion pair 300.0/215.1(with adding standard matter amount of 1.0 μg/kg)

图7 蒂巴因定量离子对312.0/58.2的信噪比图(加标量0.2 μg/kg)Fig.7 The signal to noise ratio diagram of thebaine quantitative ion pair 312.0/58.2(with adding standard matter amount of 0.2 μg/kg)

图8 那可丁定量离子对414.2/220.2的信噪比图(加标量0.1 μg/kg)Fig.8 The signal to noise ratio diagram of narcotine quantitative ion pair 414.2/220.2(with adding standard matter amount of 0.1 μg/kg)

图9 罂粟碱定量离子对340.2/202.1的信噪比图(加标量0.1 μg/kg)Fig.9 The signal to noise ratio diagram of papaverine quantitative ion pair 340.2/202.1(with adding standard matter amount of 0.1 μg/kg)
2.6 方法的精密度和加标回收率
分别选取固态、半固态、液态调味料为空白样品(检测结果均为阴性),分别按5,10,20倍检出限3个浓度水平加入5种生物碱混合标准使用液,制备加标样品,对每个添加水平重复测定6次,计算加标回收率和相对标准偏差,数据见表4。结果表明,吗啡回收率在76.6%~117.3%范围内,相对标准偏差在11.9%~14.4%之间;可待因的回收率在84.4%~111.4%范围内,相对标准偏差在4.2%~14.1%之间;蒂巴因的回收率在85.1%~111.5%范围内,相对标准偏差在2.7%~7.1%之间;那可丁的回收率在75.2%~103.6%范围内,相对标准偏差在2.6%~7.2%之间;罂粟碱的回收率在83.0%~106.0%范围内,相对标准偏差在1.9%~5.3%之间,满足GB/T 27404-2008《实验室质量控制规范 食品理化检测》中附录F对精密度、回收率的要求,说明该方法准确、稳定、可靠。

续 表
2.7 样品测定
实验共选取10种调味料进行了检测,其中固态火锅底料、半固态米线调味酱、半固态小龙虾调味酱、汤料共4种预包装调味料购于超市;海鲜汁、沙茶酱、孜然油、麻油、辣椒油、芝麻油共6种自制火锅调味料(蘸料)购于火锅店,均未检测出吗啡、可待因、蒂巴因、那可丁、罂粟碱,说明目前该类市售调味料质量状况良好,结果令人满意。
3 结论
本试验采用实验室常用的Kinetex®2.6 μm Biphenyl 100 Å反相色谱柱,建立了超高效液相色谱-串联质谱法测定调味料中罂粟壳类生物碱,吗啡等5种生物碱均得到了很好的色谱保留和分离,降低了方法检出限;在样品处理上进行了改进,获得了理想的净化、回收效果,使样品前处理过程更加简便。该方法检出限在0.1~1.0 μg/kg之间,加标回收率在75.2%~117.3%范围内,相对标准偏差均小于15%,具有较高的灵敏度、准确度和重现性,可用于调味料中吗啡、可待因、蒂巴因、那可丁和罂粟碱的痕量分析,且该方法更容易推广应用。
