混菌固态发酵对紫苏粕抗氧化性的影响
2023-03-20陈林林杨茜瑶李伟宋佳琪王玲
陈林林,杨茜瑶,李伟,宋佳琪,王玲
(哈尔滨商业大学 食品工程学院,哈尔滨 150028)
紫苏在古代汉语中又被称为紫苏子[1],一年生直立草本植物[2],其叶片通常是折叠的,一侧为绿色,另一侧为紫色,是一种含有大量挥发性成分的天然植物,常被人们用作调味品或香料[3-4]。紫苏具有降低血脂水平、改善心血管疾病、改善视力、促进大脑神经系统生长发育等作用[5-6],其主要含有多酚等抗氧化成分,可以清除细胞内的自由基[7-10];在我国主要被用作香料或药物,或者泡茶、煮粥使用,也可作为临床药物使用[11]。紫苏籽提炼油脂后所得的副产品为紫苏粕,紫苏粕中富含紫苏油脂、多糖、纤维素、蛋白质、抗氧化物质等[12]。其中多酚和抗氧化肽等抗氧化物质具有抗肿瘤、抗衰老等功效,经常被用于保健食品中。
近年来,为提高紫苏粕的生物利用价值,多采用提取和纯化的途径来获得紫苏粕中的有效成分。Wang等[13]采用超声-酶辅助萃取和液-液萃取的方法提取紫苏叶中的多酚,粗提物中多酚含量较高,对DPPH·、O2-·、ABTS+·的清除能力分别是VC的1.71,2.40,1.14倍。Huang等[14]将紫苏籽经微波处理,冷榨提取紫苏籽油,提高了紫苏籽油的总生育酚、植物甾醇含量和抗氧化能力,实现了紫苏的高附加值综合利用。由此可见,不同加工提取方式对紫苏性能有很大的影响。Yang等[15]从紫苏种子副产物中提取蛋白质并用碱性蛋白酶水解,从水解物中提纯抗氧化肽。获取两种具有较强抗氧化活性的肽,能高效地淬灭自由基(DPPH·、ABTS+·和·OH)并显示出高氧自由基吸收能力。
为实现紫苏粕中有效成分的高附加值利用,结合降低酶解反应成本,本文选用酵母菌和双歧杆菌复配进行紫苏饼粕混合发酵,通过发酵过程酶解提高紫苏粕中抗氧化物质活性。探究发酵条件对发酵后产物的活性成分含量和体外自由基清除活性的影响,并对抗氧化活性指标进行相关性分析。
1 材料与方法
1.1 材料
紫苏粕:黑龙江省桦南农盛园食品有限公司;发酵菌种:酵母菌(Saccharomycescerevisiae)131、双歧杆菌(Bifidobacteria)sq-1,保存于本实验室;1,1-二苯基-2-三硝基苯肼(DPPH):东京化成工业株式会社;2,4,6-三吡啶基三嗪(TPTZ)、2-联氨-双-3-乙基苯并噻唑啉-6-磺酸(ABTS):萨恩化学技术(上海)有限公司;三氯化铁:天津市双船化学试剂厂;三羟甲基氨基甲烷(Tris)、吐温80:天津市泰兴试剂厂。
1.2 仪器与设备
BKQ-B75L立式压力蒸汽灭菌器 上海申安医疗器械厂;HNY-100B恒温培养振荡器 天津欧诺仪器仪表有限公司;TGL-16高速台式离心机 上海医疗器械六厂;UV-2550紫外可见分光光度计 日本岛津公司。
1.3 方法
1.3.1 样品前处理
准确称量紫苏饼粕粉500 g,取1 500 mL的石油醚对其浸泡30 min脱脂,弃去上层油脂清液。重复上述操作3次,将脱脂后的紫苏粕通过旋转蒸发去除多余石油醚。对紫苏粕进行抽提后置于80 ℃烘箱中进行烘干,置于4 ℃冰箱中保存备用。
1.3.2 培养基的制备
参考文献[16]的方法配制双歧杆菌的培养基,将双歧杆菌的培养基置于已灭菌的锥形瓶中,常温放置,备用。准确称取6.24 g双歧杆菌培养基,加入100 mL的无菌水,100 ℃搅拌至溶解,120 ℃条件下灭菌20 min,取出冷却,放置备用。
酵母菌培养基的制备:称取26.00 g麦芽汁培养基(实验室自制),加入200 mL的无菌水,100 ℃搅拌至溶解,120 ℃条件下灭菌20 min,取出冷却,备用。
1.3.3 菌种活化
准确称取双歧杆菌0.50 g,接种在100 mL已灭菌的双歧杆菌培养基中,混合均匀后封口置于32 ℃无氧条件下恒温静置培养24 h。准确称取酵母菌0.50 g于200 mL的酵母菌培养基中,封口后置于35 ℃恒温水浴振荡器中65 r/min培养24 h。上述两种菌液可作为一代菌液。分别吸取一代菌液1%于各自的培养基中,与上述培养条件一致,即可获得二代菌液。
1.3.4 不同发酵条件对紫苏粕抗氧化活性的影响
将双歧杆菌和酵母菌混合接种在灭菌后的紫苏饼粕上,按复配混合菌总接种量为4%,考察菌种复配比(酵母菌和双歧杆菌的比例为3∶1、2∶1、1∶1、1∶2、1∶3)、料液比(紫苏粕和水的比例为1∶1、1∶2、1∶3、1∶4、1∶5)、发酵时间(12,24,36,48,72 h)、pH(3.0,4.0,5.0,6.0,7.0)和发酵温度(26,28,30,32,34 ℃)5个因素对发酵后紫苏粕抗氧化活性的影响。
将发酵后的紫苏粕置于高速离心机中,在4 000 r/min下离心15 min,取上清液作为待测液。测定抗氧化活性和抗氧化活性成分并分析抗氧化活性与活性成分之间的相关性。
1.3.4.1 DPPH·清除能力的测定
参考文献[17]进行修改,取2 mL紫苏粕发酵上清液和2 mL配制好的DPPH·无水乙醇溶液;取2 mL无水乙醇溶液和2 mL紫苏粕发酵上清液;取2 mL的无水乙醇溶液与2 mL DPPH·无水乙醇溶液,反应30 min,在517 nm处测定吸光值,分别记为A1、A2、A0,清除能力按式(1)进行计算:
(1)
式中:SC1为DPPH·的清除率;A1为2 mL紫苏粕发酵上清液+2 mL DPPH的吸光值;A2为2 mL无水乙醇+2 mL紫苏粕发酵上清液的吸光值;A0为空白对照的吸光值。
1.3.4.2 ·OH清除能力的测定
取紫苏粕发酵上清液适量,将其稀释10倍,取1 mL稀释后的紫苏粕发酵上清液,依次加入1 mL 6 mmol/L FeSO4溶液、1 mL 9 mmol/L 水杨酸溶液、1 mL 9.9 mmol/L H2O2溶液,测定吸光值(510 nm),记为A1;用蒸馏水替代H2O2溶液,测定吸光值(510 nm),记为A2;用蒸馏水作对照,测定吸光值(510 nm),记为A0,按式(2)计算·OH清除能力[18]:
(2)
式中:SC2为·OH的清除率;A1为1 mL紫苏粕发酵上清液+1 mL FeSO4+1 mL水杨酸+1 mL H2O2的吸光值;A2为1 mL紫苏粕发酵上清液+1 mL FeSO4+1 mL水杨酸+1 mL蒸馏水的吸光值;A0为1 mL蒸馏水+1 mL FeSO4+1 mL水杨酸+1 mL H2O2的吸光值。
1.3.4.3 O2-·清除能力的测定
取8.8 mL浓度为50 mmol/L的Tris-HCl缓冲溶液于10 mL试管中,25 ℃下水浴20 min,取出立即加入25 ℃预热过的7 mmol/L邻苯三酚溶液0.2 mL,将二者的混合溶液定容至10 mL,此时开始进行氧化反应,待反应启动后1 min开始计时,在325 nm处进行测定,每隔30 s测定一次吸光值,共记录数据6次,绘制曲线,曲线斜率为邻苯三酚自氧化速率。同样取紫苏粕发酵上清液1.0 mL,加入配制好的邻苯三酚,可以得到溶液的自氧化速率,按式(3)进行计算[19]:
(3)
式中:SC3为O2-·的清除率;A0为邻苯三酚的自氧化速率;AX为加入紫苏粕发酵上清液后的邻苯三酚自氧化速率。
1.3.4.4 ABTS+·清除能力的测定
在试管中加入1 mL的紫苏粕发酵上清液和5 mL ABTS+·反应液,25 ℃下反应10 min,在734 nm处测吸光值为As,以不加紫苏粕发酵上清液的ABTS+·溶液为空白对照测其吸光值为A0。按式(4)计算ABTS+·的清除能力[18]:
(4)
式中:SC4为ABTS+·的清除率;A0为1 mL紫苏粕发酵上清液+5 mL ABTS+·反应液的吸光值;AS为1 mL紫苏粕发酵上清液+5 mL蒸馏水的吸光值。
1.3.4.5 FRAP总还原能力的测定
参照文献[20]的方法,配制pH 3.6的0.3 mol/L醋酸缓冲液,10 mmol/L TPTZ溶液,用40 mmol/L HCl溶液定容于20 mmol/L氯化铁(FeCl3)溶液中。将上述溶液以10∶1∶1的比例混合制成FRAP(ferric reducing ability of plasma)工作液。取1 mL上清液与6 mL FRAP工作液于试管中,37 ℃反应10 min。测其吸光值A(593 nm),吸光值越大,表示总还原能力越强。
1.3.5 发酵紫苏粕中多酚含量的测定
标准曲线的绘制(没食子酸):配制浓度为0.1 mg/mL的没食子酸标准溶液。准确称量0.25 g FeSO4试剂和1.25 g酒石酸钠,用蒸馏水定容在250 mL 容量瓶中得到酒石酸亚铁显色剂。取0,0.1,0.2,0.4,0.6,0.8,1.0 mL 配制好的没食子酸标准溶液,加2 mL 酒石酸亚铁显色剂和5 mL pH 7.5的PBS缓冲溶液,定容至10 mL容量瓶中,测定此时溶液的吸光值(540 nm),以没食子酸浓度(μg/mL)为横坐标、吸光值A为纵坐标,绘制标准曲线:y=0.014 7x+0.000 7,R2=0.992 4,计算多酚含量。
1.3.6 发酵紫苏粕蛋白质含量的测定
参考文献[21]的方法,称取0.10 g考马斯亮蓝试剂将其溶解在50 mL 95%的乙醇中,加入100 mL 85%(质量和体积比)磷酸后,用蒸馏水定容至1 000 mL,过滤制得考马斯亮蓝溶液,以标准蛋白质浓度(mg/mL)为横坐标、吸光值(595 nm)为纵坐标,绘制标准曲线y=0.707 9x-0.002 71,R2=0.992 4,根据标准曲线计算得出发酵液中蛋白质含量。
1.3.7 数据处理与统计分析
使用SPSS 17.0软件对实验数据进行显著性差异分析,显著性水平P<0.05,采用Pearson进行线性相关分析,用Origin 2018软件绘图,得出实验结论。
2 结果与分析
2.1 发酵条件对紫苏粕抗氧化活性的影响
2.1.1 菌种复配比对抗氧化性的影响
由图1可知,当酵母菌和双歧杆菌复配比在3∶1~1∶3的范围内,DPPH·、·OH、O2-·、ABTS+·4种自由基的清除效果趋势大致相同,总体为先上升后下降。当双歧杆菌的含量过高时,阻碍发酵粕中多酚的释放,使整体抗氧化活性降低[22—23],在菌种比为2∶1时DPPH·、·OH、O2-·、ABTS+·的清除率均达到最大(P<0.05),分别为50.60%、43.4%、46.15%、67.65%。菌种比对DPPH·、·OH、O2-·、ABTS+·的清除率影响显著(P<0.05),这与张雪等[24]的实验结果一致。
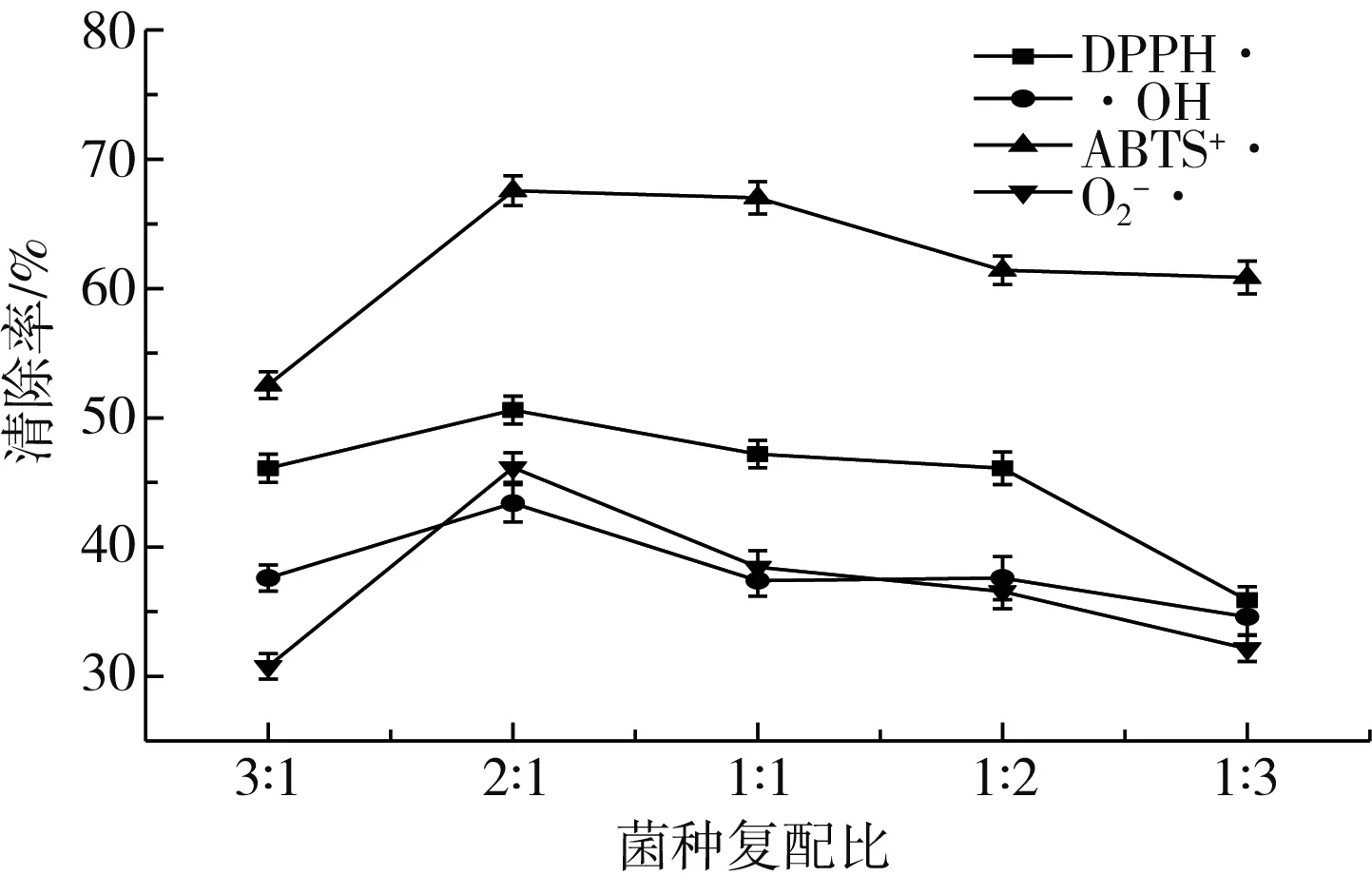
图1 菌种复配比对紫苏粕抗氧化性的影响Fig.1 Effect of bacterial strain compound ratio on antioxidant activity of perilla meal
2.1.2 料液比对紫苏粕抗氧化性的影响
由图2可知,当料液比在1∶1~1∶5的范围内,DPPH·、·OH、O2-·、ABTS+·4种自由基的清除效果均逐渐下降。水含量逐渐升高使样品浓度减少,导致多酚含量减少,使整体抗氧化活性呈下降趋势[25],在料液比为1∶1时,DPPH·、·OH、O2-·、ABTS+·的清除率均达到最大(P<0.05),分别为67.42%、59.65%、68.03%、73.58%。料液比对DPPH·、·OH、O2-·、ABTS+·的清除率影响显著(P<0.05),且对4种自由基的清除能力呈一定的线性相关。
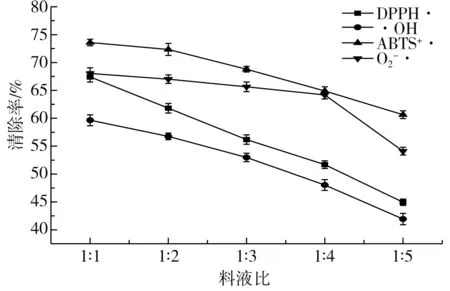
图2 料液比对紫苏粕抗氧化性的影响Fig.2 Effect of solid-liquid ratio on antioxidant activity of perilla meal
2.1.3 发酵时间对紫苏粕抗氧化性的影响
由图3可知,抗氧化活性随发酵时间的增加而增大,多在72 h时达到最大后显著下降(P<0.05)。原因是在12~72 h时菌株生长加快,处于对数生长时期[26]。发酵液中多糖对自由基的清除率在72 h时·OH、O2-·、ABTS+·的清除率达到最大,分别为74.54%、71.36%、75.91%;只有DPPH·的清除率在48 h时最大,为78.05%。因此,发酵时间以72 h为宜。
2.1.4 pH对紫苏粕抗氧化性的影响
由图4可知,抗氧化活性随pH的增加而增大,在pH为7.0时达到最大(P<0.05)。酸性条件对乳酸菌和双歧杆菌会产生影响,降低菌类的生物活性,使其产酶的能力下降,抑制酚酸的释放[27],当pH达到7.0时,达到最佳条件,DPPH·、·OH、O2-·、ABTS+·的清除率均达到最大,分别为66.22%、53.27%、63.68%、82.98%。pH在3.00~7.00范围内,DPPH·、·OH、O2-·、ABTS+·的清除能力分别上升了40.65%、16.28%、23.02%、15.43%,其中对ABTS+·的清除能力明显高于对其他3种自由基的清除能力。因此,选择pH为7.0。

图4 pH对紫苏粕抗氧化性的影响Fig.4 Effect of pH on antioxidant activity of perilla meal
2.1.5 发酵温度对紫苏粕抗氧化活性的影响
由图5可知,随着发酵温度的升高,抗氧化活性基本显示出先增大后减小的趋势,抗氧化活性受发酵温度的影响显著(P<0.05),由于发酵温度较低,菌株生长缓慢,产酶能力差,阻碍酚酸的释放[28]。当温度达到36 ℃时,清除能力最弱,在32 ℃时清除能力最强,由大到小依次为ABTS+·(85.11%)>DPPH·(63.83%)>O2-·(62.04%)>·OH(55.70%);其中对ABTS+·的清除能力明显高于其他3种自由基。因此,发酵温度为32 ℃时对抗氧化活性的影响显著(P<0.05)。

图5 发酵温度对紫苏粕抗氧化性的影响Fig.5 Effect of fermentation temperature on antioxidant activity of perilla meal
2.2 发酵紫苏粕中抗氧化物质与评价指标相关性分析
测定发酵后紫苏粕发酵上清液的抗氧化活性指标及成分,经过SPSS分析得相关性分析,见表1。
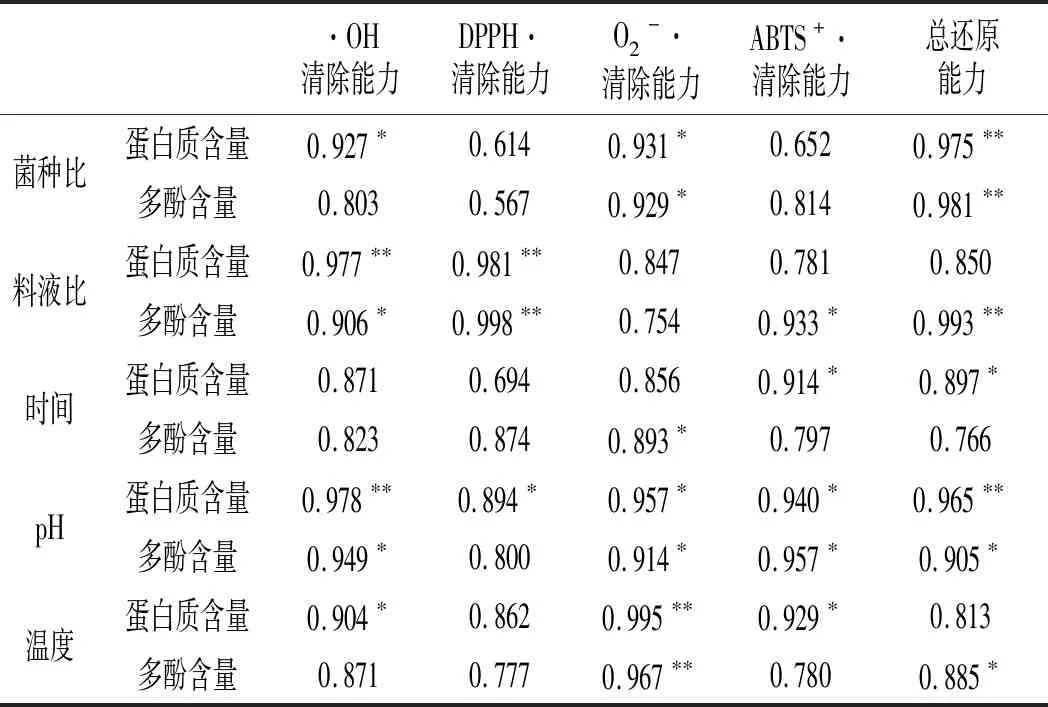
表1 发酵条件对紫苏粕抗氧化活性影响的相关性Table 1 Correlation of effect of fermentation conditions on antioxidant activity of perilla meal mg/g
由表1可知,在改变菌种比时,紫苏粕发酵上清液中蛋白质含量与·OH、O2-·两种自由基的清除能力的线性关系显著[29](P<0.05),与总还原能力的线性关系极显著(P<0.01);多酚含量与O2-·清除能力之间线性关系显著,与总还原能力之间线性关系极显著,与其他活性指标间的相关性不显著。料液比对蛋白质含量和多酚含量影响的评价方法中,蛋白质含量与·OH、DPPH·的清除能力之间线性关系极显著(P<0.01);多酚含量与·OH、ABTS+·清除能力之间线性关系显著,与DPPH·清除能力、总还原能力、蛋白质含量之间线性相关性极显著[25],与其他活性指标间的相关性不明显。发酵时间对蛋白质含量和多酚含量影响的评价方法中,蛋白质含量与ABTS+·清除能力、总还原能力之间线性关系显著(P<0.05);多酚含量与O2-·的清除能力之间线性关系极显著(P<0.01),与其他活性指标间无明显相关性。pH值对紫苏发酵液中蛋白质含量和多酚含量影响中,蛋白质含量与DPPH·、ABTS+·、O2-·清除能力之间线性关系显著(P<0.05),与·OH清除能力和总还原能力的线性关系极显著(P<0.01);多酚含量与·OH、ABTS+·、O2-·清除能力之间线性关系显著(P<0.05),与蛋白质含量的线性关系极显著(P<0.01),与其他指标相关性不显著。发酵温度对蛋白质含量和多酚含量影响的评价方法中,与文献[30]的结果类似,蛋白质含量与·OH、ABTS+·清除能力之间的线性关系显著(P<0.05),与O2-·清除能力的线性关系极显著(P<0.01);多酚含量与总还原能力、蛋白质含量之间线性关系显著(P<0.05),与O2-·清除能力的线性关系极显著(P<0.01)。
3 结论
采用酵母菌和双歧杆菌对紫苏粕进行混菌发酵,以紫苏粕发酵上清液的抗氧化活性为指标,确定混菌发酵的条件,并测定发酵后多酚含量和蛋白质含量的变化。结果表明,经过混菌发酵后,紫苏粕清除自由基能力在不同的菌种比、料液比、发酵时间、pH和发酵温度条件下均发生了明显的变化,在酵母菌与双歧杆菌的复配比为2∶1、料液比为1∶1、pH为7.0、发酵温度为32 ℃、发酵时间为48 h时,紫苏粕发酵上清液中蛋白质含量可达1.33 mg/g;多酚含量达到20.82 mg/g;对DPPH·、·OH、O2-·、ABTS+·的清除能力分别为69.51%、74.54%、71.36%、85.11%,表明采用混菌发酵紫苏饼粕具有较强的抗氧化能力,为紫苏加工副产物的综合利用提供了参考。
