杜仲叶超微粉添加量对发酵苹果汁品质的影响
2023-03-20张丽华唐培鑫查蒙蒙冯路瑶纵伟
张丽华,唐培鑫,查蒙蒙,冯路瑶,纵伟*
(1.郑州轻工业大学 食品与生物工程学院,郑州 450001;2.食品生产与安全河南省协同创新中心,郑州 450001;3.河南省冷链食品质量安全控制重点实验室,郑州 450001)
杜仲是中国特有的名贵滋补中药材[1]。最新研究表明,杜仲叶富含黄酮、多糖、多酚等活性成分,具有与杜仲皮相似的降血压、降血糖、抗炎和抗骨质疏松等功能[2-3]。杜仲叶在2005年被载入《中华人民共和国药典》,2018年纳入药食两用物质管理。在中国的湖南省和河南省等地,有将杜仲嫩叶入菜、煮粥、泡茶及制作主食的饮食习俗[4-5]。近年来,利用杜仲叶开发的产品有杜仲茶、杜仲叶饮料、杜仲叶浸膏粉等[6-8],但将其作为配料应用在食品加工中的研究较少。
超微粉碎技术是生产保健品和功能性食品的新型加工技术,能最大限度地保留天然活性物质的功能。已有研究表明,超微粉碎能够增加天然可食植物中总酚和总黄酮的溶出[9]。陈书明等[10]发现提高面包中杜仲叶超微粉(superfine powder ofEucommiaulmoidesOliv.leaves,SPEL)的添加量,有利于增强其清除1,1-二苯基-2-三硝基苯肼(DPPH)自由基的能力;Zhang等[11]研究发现杜仲叶超微粉碎后,更有利于杜仲叶功能性食品的开发。
近年来,益生菌发酵果蔬汁饮料因具有改善人体肠道菌群,改善便秘和乳糖不耐症,抑制一些腐败菌在肠道内定植等功能受到许多消费者的青睐。益生菌在苹果汁发酵中研究表明,植物乳杆菌发酵不仅能在一定程度上抑制苹果汁氧化酶的活性,而且能够提高发酵苹果汁的抗氧化活性和赋予果汁香气[12]。然而,益生菌发酵过程中苹果汁的总酚、绿原酸、原花青素B2含量降低[13-14]。但是还有研究表明,植物乳杆菌发酵在降低桑叶的苦味[15]、提高木瓜叶的总酚和非洲茄香草酸、醋酸、铁藻酸、黄酮类(卡钦、奎辛和叶黄素)和抗坏血酸的功能性成分含量等方面效果显著[16-17]。目前,已有研究发现桑叶和植物乳杆菌混合发酵能够提高奶酪的营养价值[18];橄榄叶和植物乳杆菌混合发酵能够提高餐用橄榄的总酚含量[19]。因此,本研究将SPEL添加到苹果汁中,探究SPEL不同添加量(1%、2%、3%)对发酵苹果汁中总酚、黄酮、有机酸等功能性成分和香气的影响,可为杜仲叶功能性产品开发提供借鉴。
1 材料与方法
1.1 材料与试剂
新鲜苹果:购于当地丹尼斯超市;杜仲叶:2021年6月采自国家林业局泡桐研究开发中心杜仲种植基地;植物乳杆菌(LactobacillusplantarumCICC 20022):中国工业微生物菌种保藏中心。
福林酚:北京索莱宝科技有限公司;没食子酸、硝酸铝、苹果酸、酒石酸:天津市科密欧化学试剂有限公司;MRS肉汤、MRS培养基:北京奥博星生物技术有限责任公司;果胶酶、纤维素酶:江苏锐阳生物科技有限公司;3,5-二硝基水杨酸、葡萄糖:国药集团化学试剂有限公司;盐酸:洛阳昊华化学试剂有限公司;氢氧化钠、亚硝酸钠、磷酸二氢钾、抗坏血酸、柠檬酸:天津市大茂化学试剂厂;乳酸:郑州派尼化学试剂厂;甲酸:阿拉丁试剂有限公司;乙酸:天津市富宇精细化工有限公司。
1.2 仪器与设备
LDZX-50KBS立式压力蒸汽灭菌器 上海申安医疗器械厂;SC-80C全自动色差仪 北京康光光学仪器有限公司;PHS-3C pH计 上海雷磁仪器厂;PAL-1数显折光糖度仪 日本ATAGO公司;TU-1810紫外可见分光光度计 北京普析通用仪器有限责任公司;BPH-9272精密恒温培养箱 上海一恒科学仪器有限公司;SW-CJ-2D超净工作台 上海浦东荣丰科学仪器有限公司;PEN3 电子鼻系统 德国AIRSENSE公司;Agilent G4212.60008型高效液相色谱仪 美国安捷伦公司;PM100行星式球磨仪 弗尔德(上海)仪器设备有限公司;TECAN酶标仪 勒菲生物科技(上海)有限公司。
1.3 实验方法
1.3.1 菌种活化
将冻干菌粉在MRS肉汤培养基中活化后,吸取0.75 mL于1.5 mL的离心管中,用甘油1∶1冷冻保藏,然后配制100 mL MRS肉汤培养基,经煮沸溶解、高压蒸汽灭菌(0.1 MPa,121 ℃,20 min)、冷却至室温后,加入1管保藏在甘油中的植物乳杆菌菌液,摇匀,在37 ℃恒温培养箱中培养48 h,按照1%的接种量转接2代后得到活化好的植物乳杆菌培养液。培养液离心取沉淀即得到植物乳杆菌菌泥,用无菌水重悬2次后,配制成浓度为0.1 g/mL的菌悬液,备用。
1.3.2 植物乳杆菌发酵苹果汁的制备
杜仲叶超微粉(superfine powder ofEucommiaulmoidesOliv.leaves,SPEL)的制备:将新鲜杜仲叶清洗,置于50 ℃的电热恒温鼓风干燥箱中脱水烘干。将烘干好的杜仲叶进行超微粉碎,用粒度仪测得平均粒径为200 μm,装袋密封放在干燥器中备用。
苹果经清洗、去皮、切片热烫1 min后进行打浆,向苹果浆中分别添加1%、2%、3%的SPEL。用纤维素酶∶果胶酶为2∶1的复合酶于40 ℃酶解4 h,经过滤、离心后得到的澄清液于0.1 MPa、121 ℃灭菌20 min,待其冷却至室温后添加4%的植物乳杆菌菌悬液,在37 ℃的培养箱中进行发酵,取发酵0,12,24,36,48 h的样品进行测定。
1.3.3 植物乳杆菌活菌数的测定
植物乳杆菌活菌数的测定方法参考GB 4789.35—2016[20]。
1.3.4 pH值的测定
采用PHS-3C pH计直接测定。
1.3.5 可溶性固形物的测定
采用PAL-1数显折光糖度仪,单位记为°Brix。
1.3.6 色差的测定
取一定体积的发酵液离心,得上清液,以蒸馏水为对照,用色差仪测定色差值。其中L*代表亮度,a*代表红绿色度,b*代表黄蓝色度,ΔE*越大表明色差越大。
1.3.7 功能性成分的测定
1.3.7.1 总糖、还原糖的测定
采用3,5-二硝基水杨酸(DNS)比色法进行测定[21]。
总糖含量测定:取1 mL发酵液于50 mL的烧杯中,加入5 mL HCl,混合均匀后于68 ℃水浴15 min,冷却后分别用2 mol/L 和0.1 mol/L NaOH溶液将其中和至中性,定容至100 mL的容量瓶中制成待测液。取0.4 mL待测液于具塞管中,加蒸馏水补至0.4 mL后分别加入0.8 mL的DNS试剂,混合均匀进行5 min的沸水浴,冷却至室温后加水定容至10 mL,在540 nm处测定吸光度值。
还原糖含量测定:取1 mL发酵液于10 mL离心管中,50 ℃水浴20 min,离心后取上清液加水定容至100 mL,制成待测液。取0.4 mL待测液于具塞管中,按照总糖含量的测定方法测定吸光度值。
总糖、还原糖含量均按式(1)计算:
(1)
式中:X为样品中总糖或还原糖的含量(以葡萄糖计),mg/mL;C为根据标准曲线计算得出的葡萄糖浓度,mg/mL;V0为样品体积,mL;V1为待测液定容体积,mL。
1.3.7.2 总酚的测定
总酚含量采用Folin-Ciocalteus法测定[22]:取1 mL发酵液,加入25 mL pH为3.0的70%酸性乙醇,避光反应30 min后在80 ℃恒温水浴60 min。离心取上清液,滤渣用乙醇洗涤2次,合并滤液,定容于50 mL容量瓶中,得到待测液。取1 mL待测液于25 mL比色管中,加水稀释至6 mL后,再分别加入0.5 mL福林酚试剂、1 mL 15%的Na2CO3溶液,避光反应30 min后加水定容至25 mL,以零管为对照,在760 nm处测定吸光度值。
总酚含量按式(2)计算:
(2)
式中:X为样品中总酚的含量(以没食子酸计),mg/dL;C为根据标准曲线计算得出的没食子酸浓度,μg/mL;V0为样品体积,mL;V1为比色定容体积,mL;V2为待测液定容体积,mL。
1.3.7.3 总黄酮的测定
采用硝酸铝络合法测定[23]。取1 mL发酵液于25 mL具塞比色管中,用30%乙醇溶液定容至6 mL后,分别加入1 mL 5%的NaNO2溶液,摇匀静置6 min后,再加入1 mL 10%的Al(NO3)3溶液,摇匀静置6 min后,最后加入10 mL 10%的NaOH溶液,用30% 乙醇定容至25 mL,摇匀静置15 min。以零管为对照,于510 nm处测定吸光度值。总黄酮含量按式(3)计算:
(3)
式中:X为样品中总黄酮的含量(以芦丁计),mg/dL;C为根据标准曲线计算得出的芦丁浓度,μg/mL;V0为样品体积,mL;V1为比色定容体积,mL。
1.3.7.4 有机酸的测定
采用高效液相色谱法对有机酸含量进行测定。
色谱条件:Agilent填充柱C18(4.60 mm×250 mm,5 μm),流动相:KH2PO4(0.02 mol/L,pH 2.60)∶甲醇为92∶8(体积比),流速为1.0 mL/min,柱温为30 ℃,进样量为10 μL,配备PDA检测器,检测波长为210 nm。
样品测定:发酵液经5000×g离心10 min,0.22 μm滤膜过滤得上清液,用外标法进行定量。通过各标准品的标准曲线对苹果汁中有机酸含量进行定量,以mg/L表示。
1.3.8 香气的测定
精确量取发酵液8 mL于样品瓶中,于50 ℃水浴10 min后,将电子鼻探头插入样品瓶中,通过顶空吸气法用电子鼻进行测定。电子鼻参数设置:清洗时间 100 s,样品测定时间 60 s,进样流量和载气流量均为 400 mL/min。电子鼻传感器名称及敏感物质参数见表1。

表1 电子鼻传感器名称及敏感物质Table 1 Names and sensitive substances of electronic nose sensors

续 表
1.4 数据统计与分析
所有数据均为3次独立重复试验的平均值,数据表示为“平均值±标准差”。采用SPSS统计软件进行差异显著性分析,通过Origin函数绘图软件制图。电子鼻数据采用WinMuster 软件进行主成分分析(PCA)和载荷分析(loading analysis)。
2 结果与分析
2.1 SPEL对植物乳杆菌发酵苹果汁活菌数的影响
不同添加量的SPEL对苹果汁发酵过程中活菌数的影响见图1。

图1 杜仲叶超微粉添加量对发酵苹果汁活菌数的影响Fig.1 Effect of the addition amount of SPEL on the viable count of fermented apple juice
在发酵过程中,4组苹果汁的活菌数均呈先上升后下降的趋势。随着SPEL添加量的增加,发酵苹果汁中植物乳杆菌的活菌数增多,发酵36 h时,各组苹果汁中活菌数均达到最大。发酵36 h后,活菌数呈下降趋势。产生这种现象的原因是植物乳杆菌代谢过程中产生乳酸,抑制了植物乳杆菌的生长;另一方面可能是SPEL对植物乳杆菌的生长有类似嗜酸乳杆菌的促进作用,因此添加SPEL的活菌数始终大于对照组的活菌数[24]。
2.2 SPEL对植物乳杆菌发酵苹果汁pH和可溶性固形物的影响
苹果汁酸度高,使得植物乳杆菌在较低的pH环境下发酵时间长、活菌数增幅低[25]。
由图2中A可知,发酵0 h时,与对照组苹果汁的pH(2.75)相比,随着SPEL添加量的增加,苹果汁的pH分别升高至2.93,3.07,3.12。结合图1可知,添加SPEL可以通过提高苹果汁的pH,避免低酸环境对植物乳杆菌生长能力的抑制,更适合植物乳杆菌的生长。随着发酵时间的增加,对照组的pH下降了26.91%,3组添加SPEL的苹果汁pH分别下降了26.96%、28.01%、29.17%,主要是植物乳杆菌在代谢过程中产生乳酸,也表明高添加量的SPEL能够促进植物乳杆菌在苹果汁中的生长。


图2 杜仲叶超微粉添加量对发酵苹果汁pH(A)和可溶性固形物(B)的影响Fig.2 Effect of the addition amount of SPEL on pH (A) and soluble solid (B) of fermented apple juice
由图2中B可知,在发酵0 h时,对照组的可溶性固形物含量为9.07°Brix,随着SPEL添加量的增加,可溶性固形物含量分别增加了3.64%、9.15%、12.79%,可能是由于杜仲叶中富含胶质,在发酵前进行的酶解处理中使用的果胶酶可以将杜仲叶中的胶质酶解成小分子物质,使细胞壁疏松,从而降低扩散阻力,使细胞内的可溶性固形物充分溶解出来[26]。在发酵前后,与对照组相比,不同SPEL添加量的苹果汁可溶性固形物含量具有显著性差异,其中添加3% SPEL的苹果汁中可溶性固形物含量一直显著高于其他3组。发酵48 h后,4组样品的可溶性固形物含量分别降低至8.87,9.13,9.43,10.07°Brix,可能是植物乳杆菌利用了苹果汁基质中大量的可溶性糖。
2.3 SPEL对植物乳杆菌发酵苹果汁色差的影响
色泽是评价果汁感官品质的重要因素,除了能测得产品本身的质量,还可以影响人们对产品的主观感受或喜欢程度。杜仲叶的颜色为深绿色,其添加量的变化会影响果汁的色泽。
由表2可知,与对照组相比,随着SPEL添加量的增加,苹果汁的L*值显著降低(P<0.05),果汁色泽变暗;a*值和b*值显著增加(P<0.05),苹果汁的红黄色得到显著改善。随着发酵时间的增加,样品的色泽值L*、a*和b*变化不明显,与De Oliveira等[27]利用复合菌株分别发酵西印度樱桃和番石榴后果汁亮度均显著提高的结果不一致,这可能是发酵基质不同导致的,也可能是SPEL自身颜色影响了发酵过程中果汁的色泽变化。

表2 杜仲叶超微粉添加量对发酵苹果汁色泽的影响Table 2 Effect of the addition amount of SPEL on the color of fermented apple juice
2.4 SPEL对植物乳杆菌发酵苹果汁总糖和还原糖的影响
不同添加量的SPEL对苹果汁总糖和还原糖的影响见图3中A。在发酵前,4组样品的总糖质量浓度分别为27.46,28.67,30.10,30.79 g/L,在发酵24~36 h内,4组果汁中总糖含量分别降低7.87%、11.84%、13.33%、13.46%。随着SPEL添加量的增加,总糖消耗越多,作为碳源被植物乳杆菌的生长所利用。由图3中B可知,SPEL能提高果汁中还原糖的含量,且还原糖含量随着SPEL添加量的增加而增加。其中3% SPEL组的还原糖含量显著高于其他3组(P<0.05),对照组和1% SPEL组的还原糖含量在发酵前24 h内呈上升趋势,可能是由于发酵过程中,植物乳杆菌将果汁中的蔗糖和多糖转化为还原糖[28]。
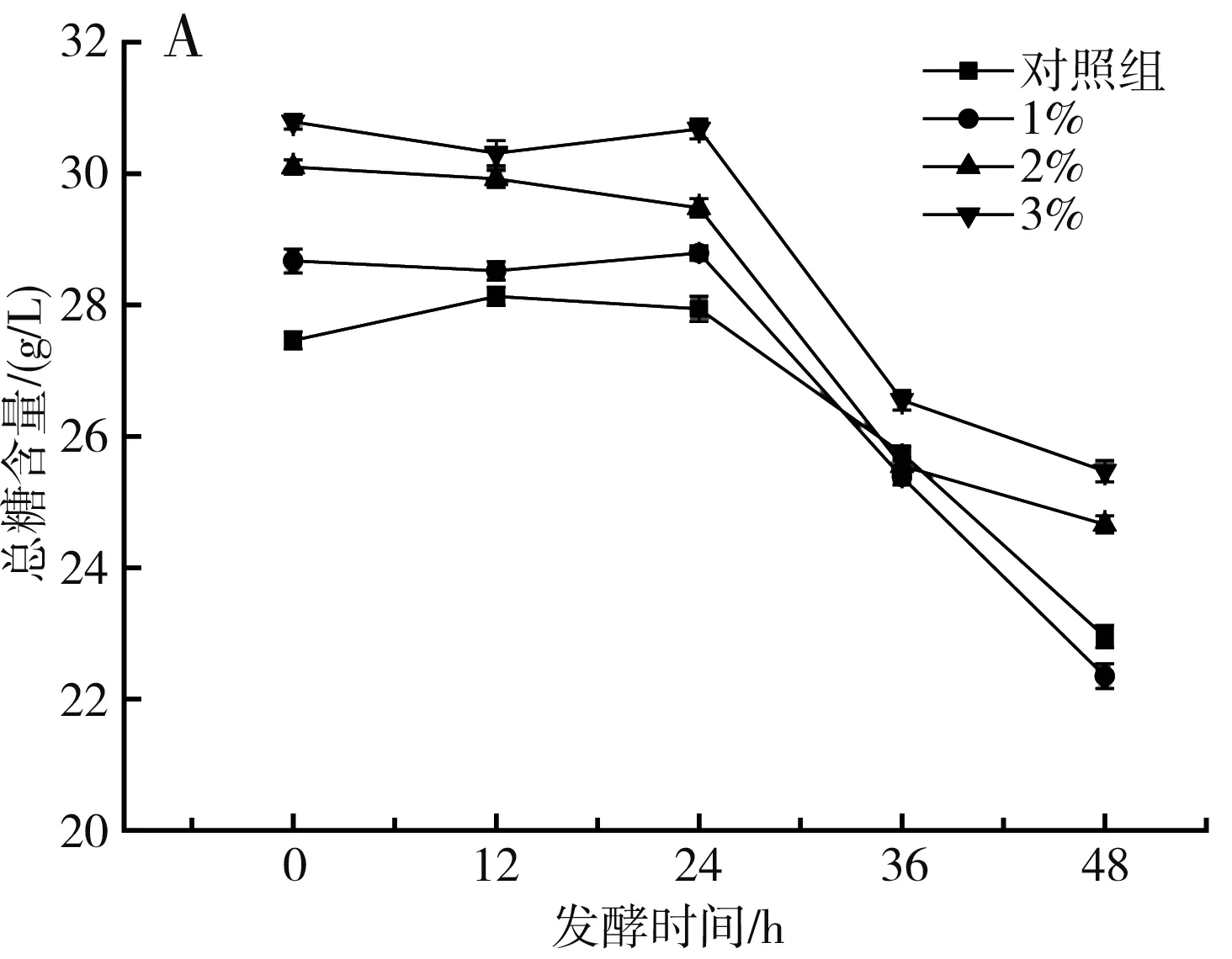

图3 杜仲叶超微粉添加量对发酵苹果汁总糖(A)、还原糖(B)的影响Fig.3 Effect of the addition amount of SPEL on the total sugar (A) and reducing sugar (B) of fermented apple juice
2.5 SPEL对植物乳杆菌发酵苹果汁总酚和总黄酮的影响

由图4可知,随着SPEL添加量的增加,苹果汁中总酚和总黄酮含量显著增加。由图4中A可知,与对照组相比,1%、2%和3% SPEL的样品中,总酚含量分别增加了56.76%、108.11%、150.00%。由图4中B可知,1%、2%、3% SPEL的样品中,黄酮含量分别增加了100.00%、271.43%、300.00%。前人研究结果表明,杜仲叶中多酚和总黄酮含量较高[29],罗磊等发现利用果胶酶酶解能增加杜仲叶中黄酮的释放量。植物乳杆菌在发酵过程中为了保持生长会降解酚类物质,导致在发酵过程中总酚和总黄酮含量降低[30]。苹果汁发酵36 h后,总酚和总黄酮含量增加,可能是由于苹果汁中存在一定含量的植物乳杆菌,将大分子酚类化合物解聚,转化简单的酚类物质[31]。
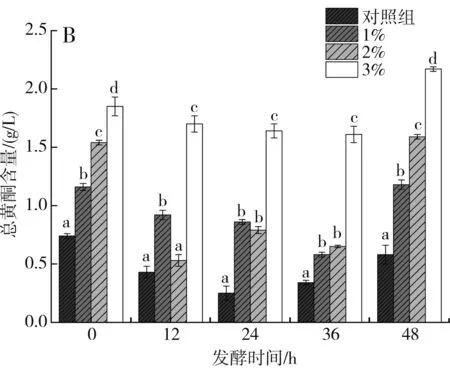
图4 杜仲叶超微粉添加量对发酵苹果汁总酚(A)、总黄酮(B)的影响Fig.4 Effect of the addition amount of SPEL on the total phenols (A) and total flavonoids (B) of fermented apple juice
2.6 SPEL对植物乳杆菌发酵苹果汁有机酸含量的影响
果汁中的有机酸含量对其营养品质和感官特性有很大的影响[32]。试验测定了植物乳杆菌发酵苹果汁中的7种有机酸含量,7种有机酸相关系数见表3,有机酸测定结果见表4。
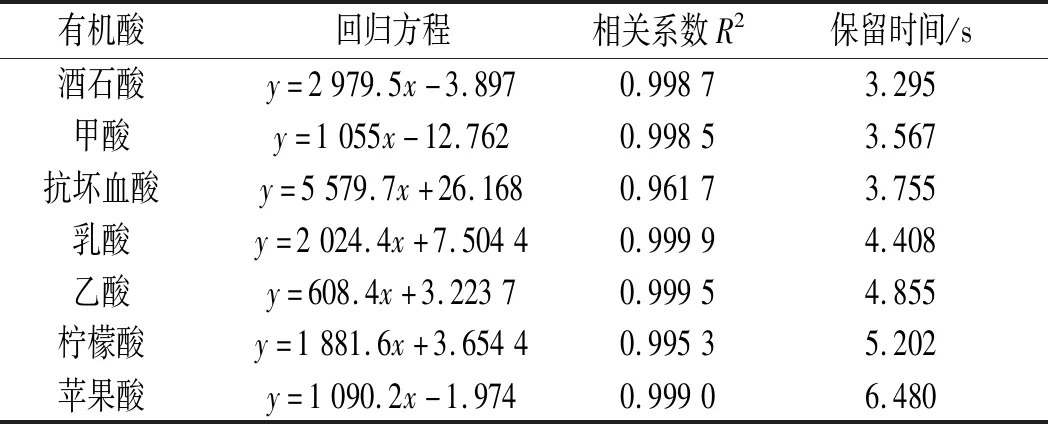
表3 不同有机酸的标准曲线Table 3 The standard curves of different organic acids
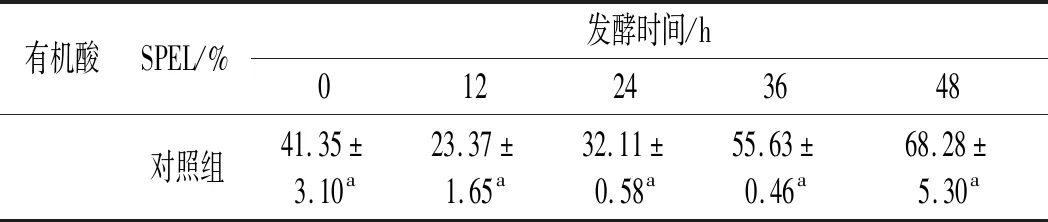
表4 杜仲叶超微粉添加量对植物乳杆菌发酵苹果汁有机酸含量的影响Table 4 Effect of the addition amount of SPEL on the content of organic acids in fermented apple juice
由表4可知,添加SPEL的苹果汁在发酵过程中甲酸、酒石酸、乳酸、己酸和抗坏血酸的变化趋势与对照组相同,质量浓度均有显著增加(P<0.05)。但是苹果酸的质量浓度变化不显著,柠檬酸的质量浓度反而显著降低,这与对照组的柠檬酸和苹果酸的质量浓度分别显著升高和降低(P<0.05)明显不同。且随着SPEL添加量的增加,发酵后苹果汁中的甲酸、酒石酸、抗坏血酸、乳酸和苹果酸的质量浓度均有显著增加(P<0.05),与SPEL添加量呈正相关;而乙酸和柠檬酸的质量浓度均显著降低,其降低量与SPEL添加量无关(P>0.05)。与对照组相比,发酵48 h后的3% SPEL组,甲酸、酒石酸、抗坏血酸和乳酸质量浓度分别增加了53.19%、116.94%、255.18%、31.06%;苹果酸的质量浓度增加了98.48 mg/L;而乙酸和柠檬酸的质量浓度分别降低了47.40%和90.20%。其中甲酸、酒石酸、乳酸和抗坏血酸的质量浓度增加是因为SPEL为植物乳杆菌提供了更多的发酵底物[33];苹果酸的质量浓度变化不明显,可能是SPEL中某种物质被植物乳杆菌转化成苹果酸;乙酸的质量浓度降低,可能是因为SPEL含有的某种功能因子促进了植物乳杆菌快速增殖,使得乙酸含量降低的时间点由36 h提前到24 h;柠檬酸的质量浓度降低,可能是因为添加SPEL促进了柠檬酸的分解或者抑制了丙酮酸的代谢,从而导致柠檬酸的含量不断降低[34]。
2.7 SPEL对植物乳杆菌发酵苹果汁香气的影响


由图5中A可知,发酵48 h后,与对照组相比,W1S(烃类物质)、W2S(醇类物质)、W1W(无机硫化物)、W2W(芳香物质和有机硫化物)4个传感器所对应的响应值较强,这与郭玉如的研究结果一致[35]。由香气响应雷达图(见图5中A)可知,对照组的挥发性气味最弱,随着SPEL添加量的增加,挥发性气味有所增强,3% SPEL组的挥发性气味相对较强。为了更直观地反映添加SPEL对植物乳杆菌发酵苹果汁香气的影响,对试验数据进行PCA和 Loading分析。

图5 杜仲叶超微粉对发酵苹果汁香气响应雷达图(A)、挥发性风味物质载荷分析(B)和主成分分析(C)的影响Fig.5 Effects of SPEL on aroma response radar diagram (A),volatile flavor substance loading analysis (B) and principal component analysis (C) of fermented apple juice
由图5中B可知,添加不同SPEL的主成分1(PC1,78.74%)和主成分2(PC2,20.80%)贡献率之和为99.54%,涵盖了样品的大部分原始信息[36]。其中W1S、W2S对第一主成分的贡献率最大,W1W对第二主成分的贡献率最大,这和香气雷达图结果是一致的。由图5中C可知,发酵前后添加SPEL组和对照组相比,各组图形都被很好地分开,说明添加SPEL能够改变发酵苹果汁的风味。从第一主成分上来看,对照组发酵前后PC1横轴坐标基本上不变,而添加SPEL组的PC1横轴坐标整体向右移动,且随着SPEL添加量的增加,PC1轴的变化量变小,表明发酵后1% SPEL组对发酵苹果汁的挥发性香气成分影响最大,但从横坐标上贡献率来看,3% SPEL组的挥发性物质含量更高,具有更好的风味。
3 结论
添加SPEL能够显著提高发酵苹果汁中的pH。
添加SPEL能够显著提高发酵苹果汁的功能性成分含量。发酵后苹果汁中还原糖、总酚、黄酮含量以及甲酸、酒石酸、抗坏血酸、乳酸和苹果酸5种有机酸的含量均显著高于对照组。
添加SPEL能够显著改善苹果汁的色泽和风味。
