低温等离子体处理对L-精氨酸-D-核糖的美拉德产物抗氧化活性的影响
2023-03-20章银良郭浩彬黄天琪赵宇张丽程梦梦黄圆圆
章银良,郭浩彬,黄天琪,赵宇,张丽,程梦梦,黄圆圆
(郑州轻工业大学 食品与生物工程学院,郑州 450001)
等离子体可分为高温等离子体和低温等离子体,是继固态、液态、气态之后物质的第四态[1],其中低温等离子体常用于食品的杀菌[2]、保鲜[3]、改性[4]中。大量研究表明低温等离子体技术相比于其他物理辅助技术,具有能极大地保持食品原有的感官、营养等性质,且不会产生副毒作用[5]。研究表明,低温等离子体处理会改变食品的抗氧化活性,Bao等[6]研究表明低温等离子体预处理可以有效地抑制枣切片中抗氧化剂的降解。于弘慧等[7]对比低温等离子体杀菌与巴氏杀菌的理化性质表明,低温等离子体杀菌处理梨汁的多酚和维生素C含量分别比巴氏杀菌处理的高26.5%和20.6%,较好地保持了梨汁的色泽,对DPPH自由基和羟基自由基的清除能力大大提高。刘振蓉等[8]使用低温等离子体处理猕猴桃浊汁时发现,低温等离子体处理使得猕猴桃浊汁中丙二醛含量提高,而VC含量、总酚含量、叶绿素含量显著降低,VC、总酚等减少会降低猕猴桃浊汁的抗氧化活性。
美拉德反应(Maillard reaction,MR)是指羰基化合物和氨基化合物在一定反应条件下发生的化学变化,这类化学反应会生成棕黑色聚合物——美拉德反应产物(Maillard reaction products,MRPs)[9]。食品加工过程中合理利用美拉德反应能极大地提高食品的风味、货架期等[10-11]。在食品的热加工过程中,美拉德反应时常发生。在前期的研究过程中,我们已经得知MRPs对不同种类的自由基均具有较好的清除作用[12-13]。等离子体处理在放电时产生大量的正、负带电粒子、电子和中性粒子,以及大量自由基[14],而等离子体灭菌是食品加工的最后一个阶段,因此探讨等离子体处理对MRPs抗氧化活性的研究有利于深入了解低温等离子体处理对食品加工过程中抗氧化活性的影响,同时也为丰富天然抗氧化剂的检测指标以及深入研究MRPs提供了参考依据。
1 材料、设备与方法
1.1 试剂与材料
D-核糖(AR)、L-精氨酸(AR):北京索莱宝科技有限公司;氢氧化钠(AR)、无水乙醇(AR):天津市永大化学试剂有限公司;盐酸(AR):烟台市双双化工有限公司;1,1-二苯基-2-苦肼基自由基(DPPH,AR)、5,5-二甲基-1-吡咯啉-N-氧化物(DMPO,AR)、2,2,6,6-四甲基哌啶氧化物(TEMPO):上海麦克林生化科技有限公司;去离子水:实验室自制。
1.2 仪器与设备
SQP电子天平 赛多利斯科学仪器(北京)有限公司;E-scan电子顺磁共振波谱仪 德国布鲁克科技(北京)有限公司;FE20 pH计 瑞士梅特勒-托利多公司;HH-1智能型数显恒温油浴槽 巩义市予华仪器有限责任公司;HH-S水浴锅 巩义市英峪予华仪器厂;Tecan Spark 20M多功能微孔板读数仪 瑞士Tecan公司;CTP-2000K等离子体实验装置 南京苏曼电子有限公司。
2 实验方法
2.1 MRPs的制备
称取12.5 g精氨酸和12.5 g核糖置于烧杯中,溶解于450 mL去离子水中,用移液枪吸取HCl(4 mol/L)和NaOH(6 mol/L)调整pH为12.0,然后用去离子水定容至50 mL,混合均匀,置于160 ℃恒温油浴槽中反应200 min,每组反应平行3次。反应结束后快速置于冰水中冷却并进行相关测定,剩余样品置于-20 ℃冰箱中保存备用。
2.2 低温等离子体处理
时间组:取1 mL的MRPs溶液,均匀涂在处理皿内,置于放电处。调节电压为25 V,分别处理1,2,3,4,5 min。吸取处理后的溶液至15 mL带盖棕色离心管中备用。
电压组:取1 mL的MRPs溶液,均匀涂在处理皿内,置于放电处。设置电压分别为10,15,20,25,30 V,处理2 min。吸取处理后的溶液至15 mL带盖棕色离心管中备用。
处理量组:分别取0.5,1,1.5,2,2.5 mL的MRPs溶液,均匀涂在处理皿内,置于放电处。设置电压为25 V,处理2 min。吸取处理后的溶液至15 mL带盖棕色离心管中备用。
2.3 DPPH自由基清除率的测定
参考Daravath等[15]、章银良等[16]的方法,并稍作修改。取0.1 mL MRPs于具塞刻度管中,加入4.9 mL去离子水,电压组和时间组配制成50倍稀释液,处理量组配制成100倍稀释液,振荡摇匀。再取500 μL MRPs(去离子水溶液作为空白对照组)与2 mL 0.5 mmol/L DPPH于棕色具塞试管中振荡混合均匀。暗反应20 min后,立即放入电子顺磁波谱仪的谐振腔中开始测量。将扫描波谱图传入布鲁克自带软件WinEPR-Processing中,对DPPH自由基ESR谱图进行二重积分,积分区域为(3 450±0.01) G~(3 525±0.01) G,将测量的二重积分值记为As。在相同操作条件下空白组记为Ac。美拉德反应产物对DPPH自由基的清除能力可由下式计算得出:
ESR测定条件:频率9.792 069 GHz,功率5.00 mW,中心磁场3 487 G,扫描宽度100 G,调制幅度2.27 G,调制频率86.00 kHz,时间常数40.96,扫描时间83.88 s(20.97 s×4次),横坐标点数512,接收机增益3.17×103。
2.4 均匀实验因素水平设计
以DPPH自由基(DPPH·)清除率为检测指标,采用U5(53)均匀实验表,因素水平见表1。

表1 U5(53)均匀实验因素水平表Table 1 Factors and levels of U5(53) uniform experiment
2.5 等离子体处理对MRPs褐变指数的影响测定
吸取1 mL未处理的MRPs和不同强度处理后的MRPs,稀释50倍并混匀,添加量组稀释100倍,用多功能孔板读数仪测量空板OD值,记为S2,吸取100 μL MRPs置于孔板内,在420 nm的波长处测量MRPs的吸光度值,记为S1。S1-S2为MRPs在420 nm处的实际吸光度值。
2.6 超氧阴离子测定
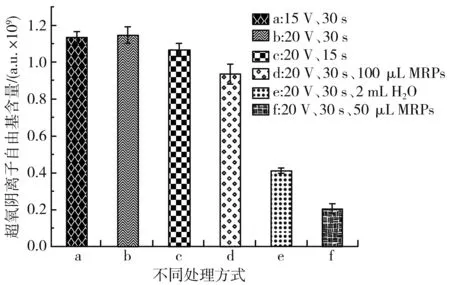
吸取0.5 mL去离子水,加入250 μL 0.25 mmol/L TEMPO,混匀后均匀涂抹在等离子体处理皿内,设置电压为20 V,处理30 s。对照组:调节电压为20 V,处理15 s;调节电压为15 V,处理30 s,吸取2 mL去离子水,加入250 μL 0.25 mmol/L TEMPO,调节电压为20 V,处理30 s,吸取100,500 μL MRPs于0.5 mL去离子水中,加入250 μL 0.25 mmol/L TEMPO,调节电压为20 V,处理30 s。以此探究处理时间、处理量、处理电压、MRPs对超氧阴离子自由基的影响。处理完后吸取样品至毛细管中,放入核磁腔中进行ESR谱图测定。
ESR测定条件:频率9.793 810 GHz,中心磁场3 487 G,调制幅度2.02 G,时间常数20.48,扫描时间10.49 s,扫描间隔时间19.51 s,接收机增益1.42×103。
2.7 羟基自由基的测定
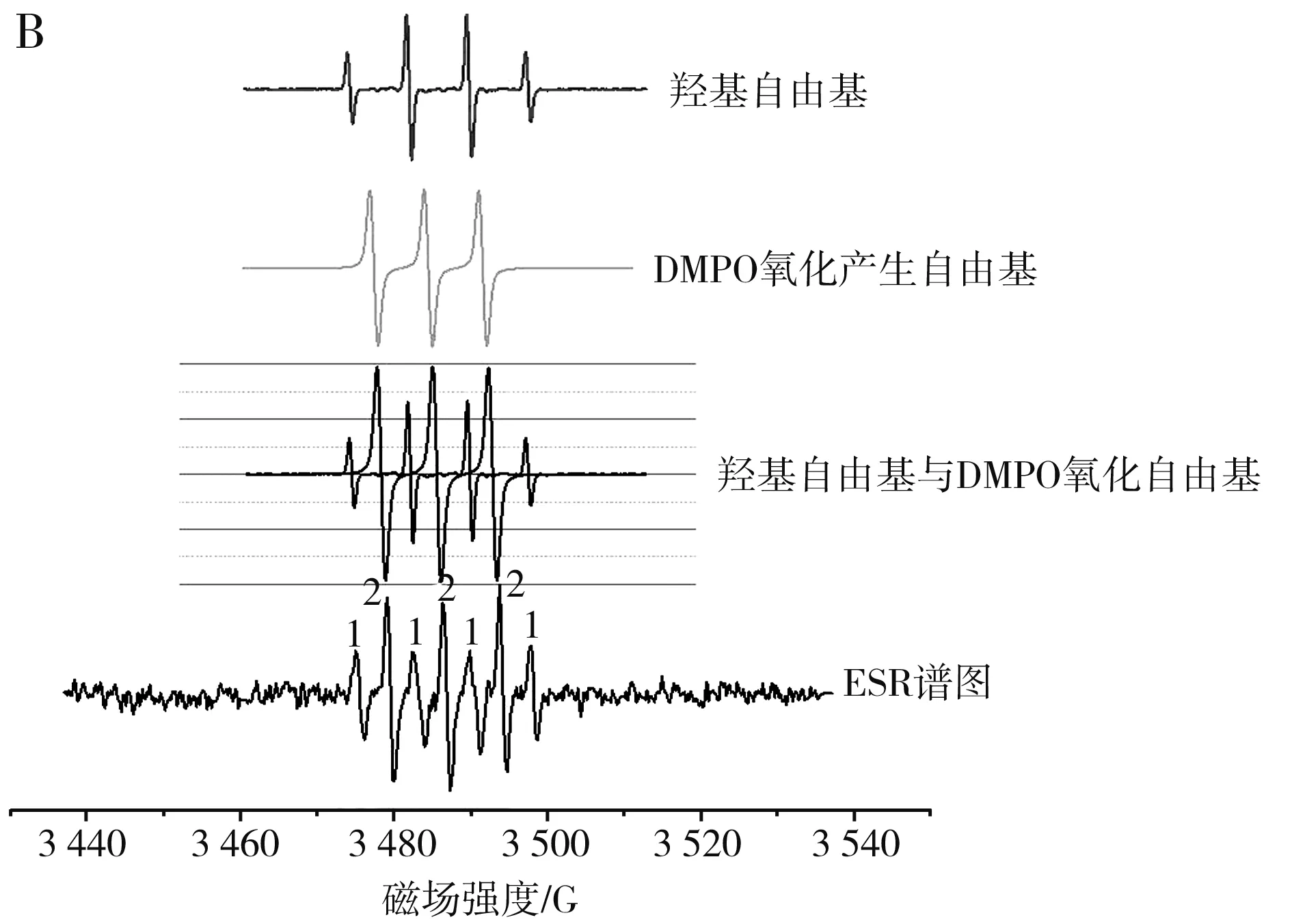
吸取0.5 mL去离子水,加入250 μL DMPO,混匀后均匀涂抹在等离子体处理皿内,设置电压为20 V,处理30 s。对照组:调节电压为20 V,处理1 min;调节电压为25 V,处理30 s,吸取2 mL去离子水,加入20 μL DMPO调节电压为20 V,处理30 s,吸取MRPs 0.5 mL,加入20 μL DMPO,调节电压为20 V,处理30 s。以此探究处理时间、处理量、处理电压对羟基自由基的影响。处理完后吸取样品至毛细管中,放入核磁腔中进行ESR谱图测定。
测量参数:频率9.790 245 GHz,调制幅度1.01 G,时间常数20.48,扫描时间10.49 s,扫描间隔时间19.51 s,接收机增益1.00×103,中心磁场3 487 G,功率5.00 mW,扫描宽度100 G,调制频率86.00 kHz,横坐标点数512。
2.8 统计分析
所有的实验均做3次平行,采用WinEPR-Processing、Simfonia、Origin 8.0、Mathematics 4.0及其相关方法进行处理,并用SPSS软件进行显著性分析(P<0.05表示差异显著)。
3 结果与分析
3.1 等离子体处理对MRPs抗氧化活性的影响
不同处理强度对MRPs抗氧化活性的影响曲线见图1(不同处理时间)、图2(不同处理电压)、图3(不同处理量)。
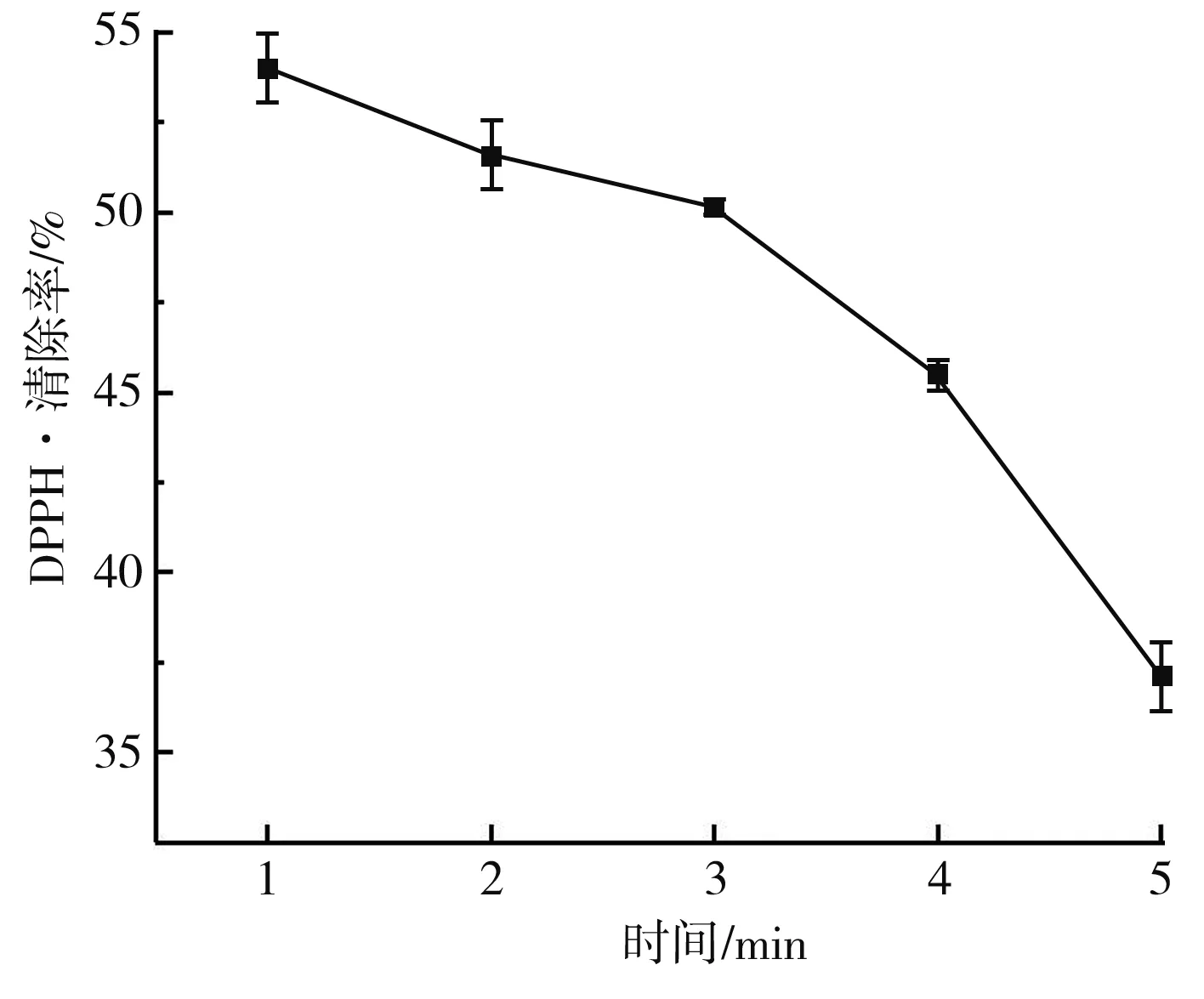
图1 不同处理时间对MRPs抗氧化活性的影响曲线图Fig.1 Effect of different treatment time on antioxidant activity of MRPs

图2 不同处理电压对MRPs抗氧化活性的影响曲线图Fig.2 Effect of different treatment voltages on antioxidant activity of MRPs
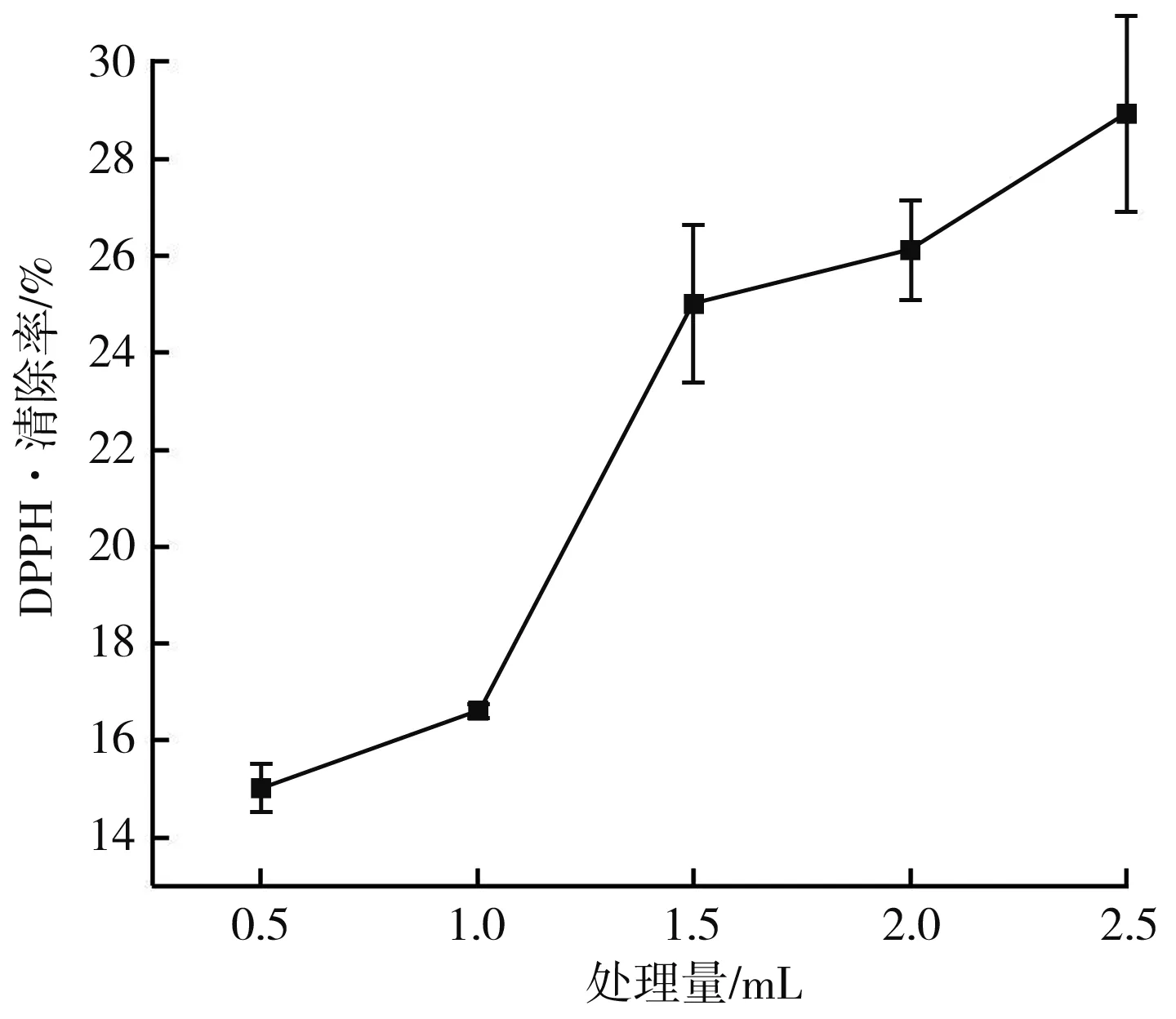
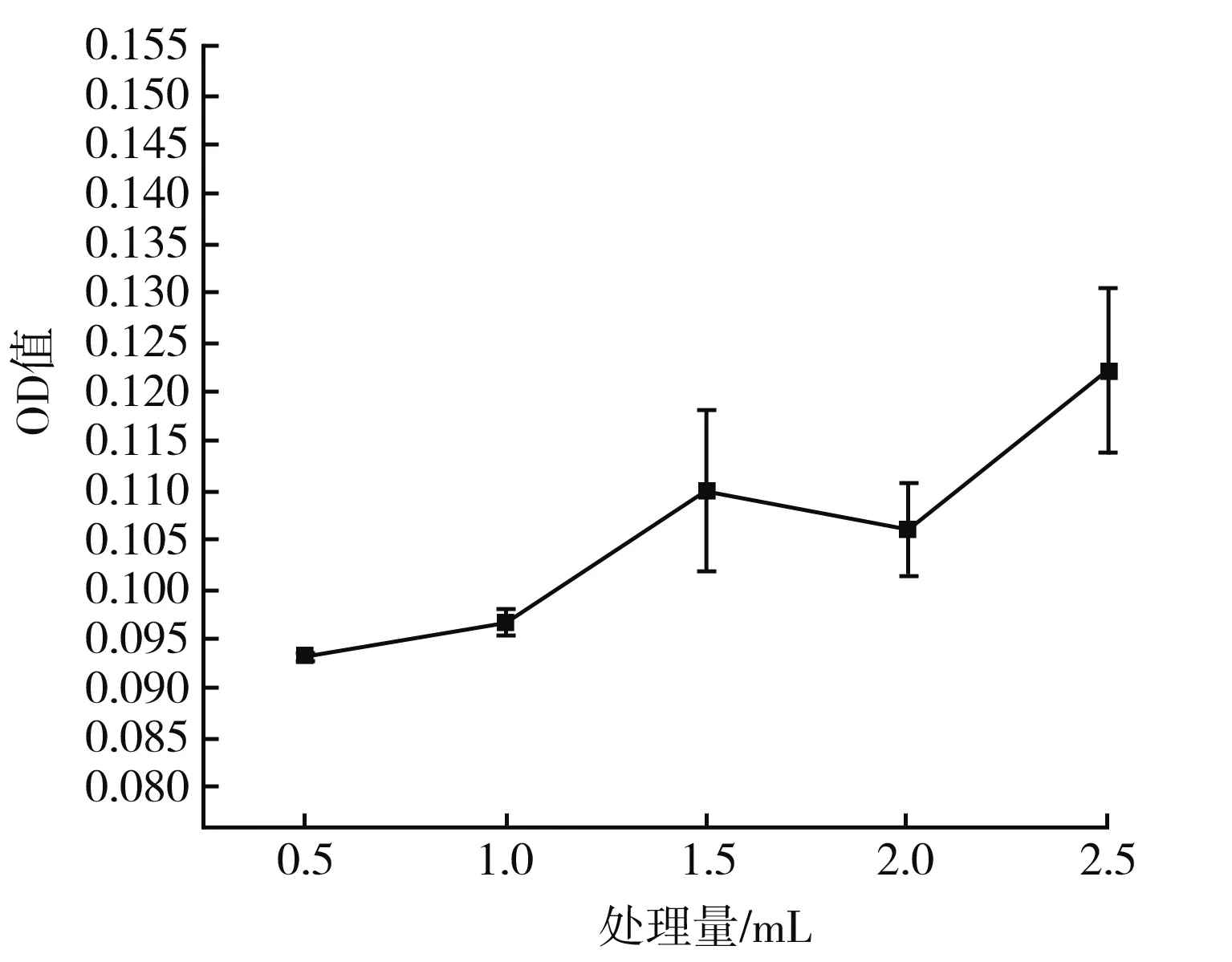
图3 不同处理量对MRPs抗氧化活性的影响曲线图Fig.3 Effect of different treatment capacity on antioxidant activity of MRPs
由图1可知,在功率恒定时,MRPs的抗氧化活性随着等离子体处理时间的延长而降低,在前3 min,等离子体处理的MRPs的抗氧化活性削弱较慢,在3~5 min时,MRPs对DPPH·的清除率迅速降低。由图2可知,随着电压的升高,MRPs对DPPH·的清除能力呈现出降低的趋势,等离子体放电过程中能够损耗MRPs末期产物,造成MRPs的抗氧化活性降低,在5~15 V内由于放电效果不明显,因此造成MRPs抗氧化活性物质的损耗较少,但是随着电压的增大,放电强度不断增大,因此造成MRPs对DPPH·的清除能力不断降低。由图3可知,在处理电压(V)和处理时间(min)一定时,MRPs的抗氧化活性受到等离子体处理量的影响,较大的处理量不仅缩短了两极板的放电距离,同时较其他实验组而言,其抗氧化活性物质总量也高于其余组,因此低温等离子体对MRPs抗氧化活性的影响随着MRPs处理量的增大而减小。
3.2 均匀实验结果
为了进一步探讨低温等离子体处理电压、处理时间以及MRPs处理量对MRPs抗氧化活性的相互影响,设计均匀实验,均匀实验结果见表2。

表2 均匀实验结果Table 2 Results of uniform experiment
以DPPH·清除率为指标,均匀实验结果采用Mathematics 4.0软件分析,结果如下:
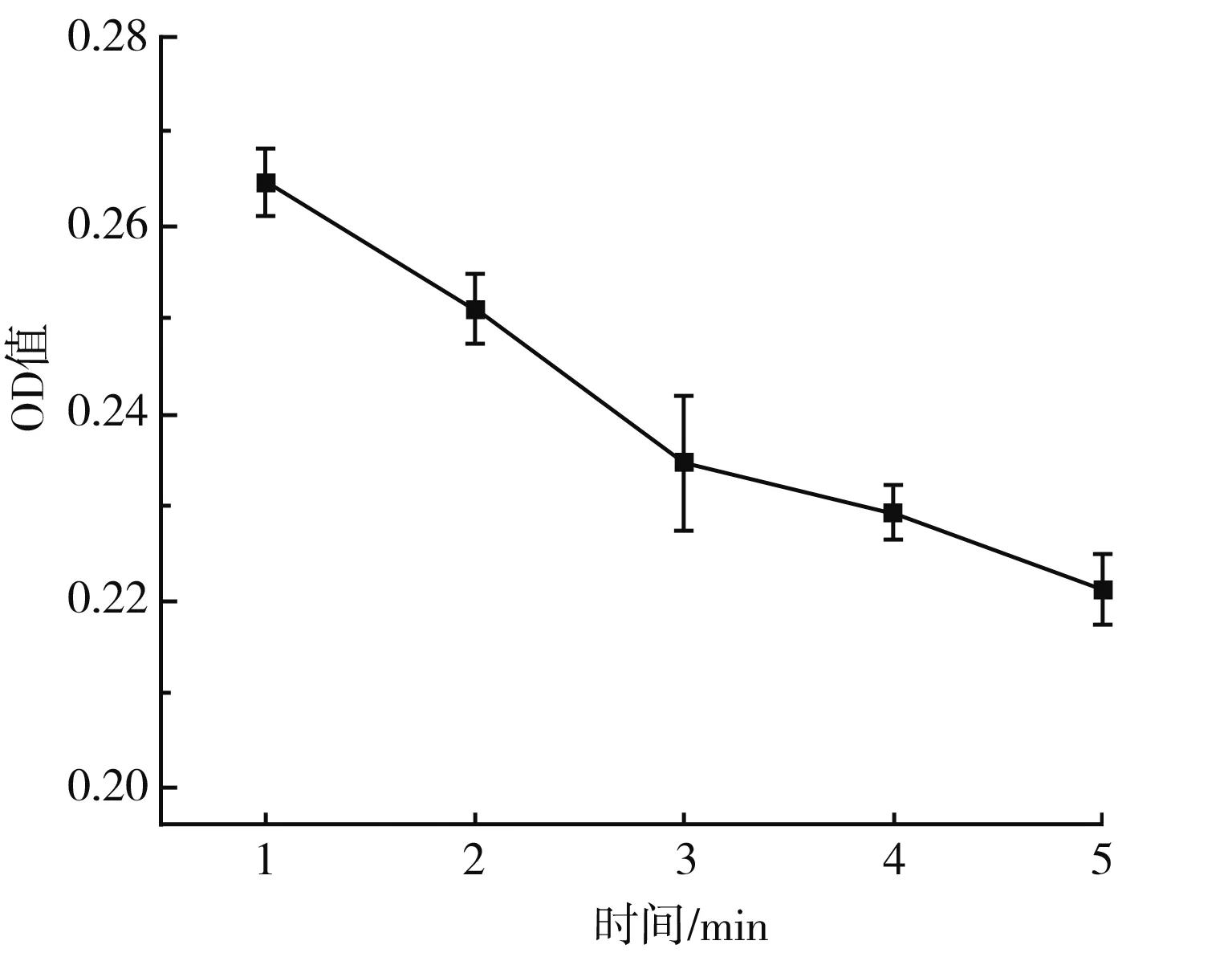
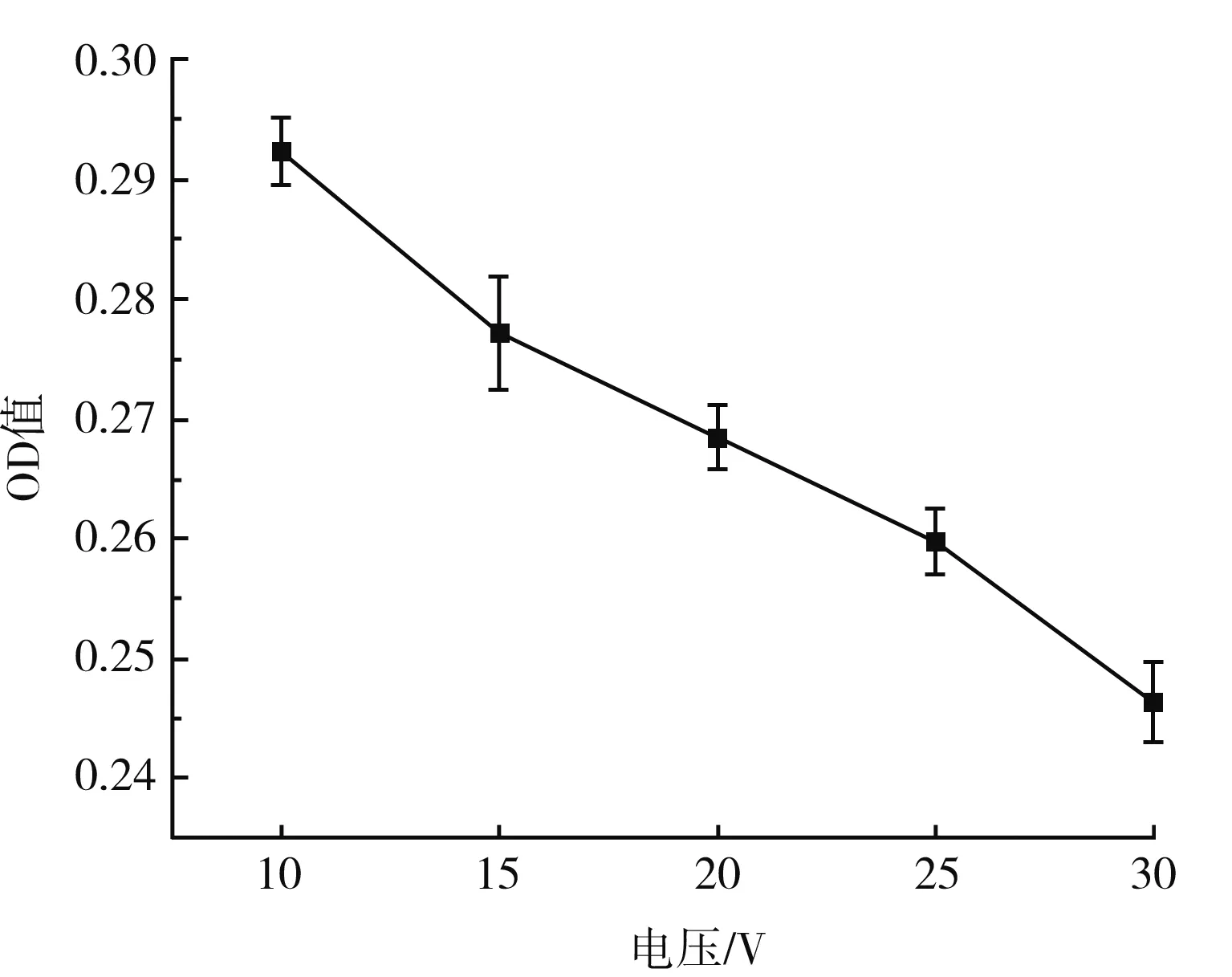
In[1]:=< In[2]:=data={{0.5,60,30,53.64},{1,120,25,50.91},{1.5,30,20,63.44},{2,90,15,70.34},{2.5,150,35,61.38}}; In[16]:=(regress=Regress[data,{1,x1*x2,x2^2,x3^2},{x1,x2,x3}]; Chop[regress,10^(-6)])。 EstimateSET-statPValue164.06240.413637154.8760.00411046X1X20.1083480.0034513431.3930.0202722X22-0.001384110.0000605116-22.87350.0278145X32-0.009881260.000686431-14.39510.0441538 R Squared → 0.999 255,Adjusted R Squared → 0.997 019, Estimated Variance → 0.181 613 2, ANOVA Table → DFSumofsqMeansqFRatioPValueModel3243.53381.1776446.9360.0347545Error10.1816320.181632Total4243.714 均匀实验采用Mathmatics 4.0软件分析: 以DPPH自由基清除率为考察指标Y,以处理量(X1)、处理时间(X2)、处理电压(X3)为影响因素进行回归分析,得到回归方程: Y=64.06+0.108 3X1X2-0.001 4X22-0.0099X32。 由回归分析的显著性分析可知,处理时间(X2) 、处理电压(X3)对DPPH自由基的清除率具有显著的影响,P值分别为0.027 8和0.044 1;处理量(X1)与处理时间(X2)具有显著的交互作用,对DPPH自由基清除率具有显著的影响,P值为0.020 2。 由回归方程求极值,结合研究实际得到最优水平:处理量(X1)为2.5 mL,处理时间(X2)为12 s,处理电压(X3)为15 V,在此条件下,DPPH自由基清除率为65.06%,高于实验中的最大值63.44%,实际清除率为62.38%,理论清除率与实际清除率相差2.68%,综合优化实验结果可靠。 MRPs褐变程度随处理强度的变化见图4(不同处理时间)、图5(不同处理电压)、图6(不同处理量)。 图4 MRPs在420 nm处的吸光度值随处理时间的变化曲线图Fig.4 Changes of absorbance values of MRPs at 420 nm with treatment time 图5 MRPs在420 nm处的吸光度值随处理电压的变化曲线图Fig.5 Changes of absorbance values of MRPs at 420 nm with treatment voltages 图6 MRPs在420 nm处的吸光度值随处理量的变化曲线图Fig.6 Changes of absorbance values of MRPs at 420 nm with treatment capacity MRPs在420 nm波长处的吸光度值常常用来表示MRPs末期产物的生成情况[17]。由图4和图5可知,随着放电时间的延长以及电压的升高,MRPs在420 nm处的吸光度值不断降低,即美拉德反应的末期产物不断减少。由图6可知,随着处理量的增大,MRPs的OD值随之增大,这可能与处理量的加大缩短了等离子体两极板的距离以及本身抗氧化活性物质高于其他组有关。综上,由等离子处理对MRPs抗氧化活性的影响结果和OD值的变化情况可知,等离子体处理造成MRPs抗氧化活性降低的原因其实是等离子体处理MRPs后MRPs末期产物减少,而造成MRPs末期产物减少的原因可能是DPPH·的等离子放电过程中会产生各种自由基例如超氧阴离子、羟基自由基等[18],这些自由基都会对MRPs的抗氧化活性造成影响。在前期的研究中我们已经发现MRPs对各类自由基均具有很好的清除作用,且清除能力与氨基酸的种类密切相关。因此,放电产生的自由基极可能是造成MRPs不断减少的原因之一。 为了进一步探究低温等离子体处理对美拉德反应末期产物降低的原因,采用电子顺磁共振波谱仪,测量不同放电强度下超氧阴离子自由基和羟基自由基的生成情况;超氧阴离子自由基测定结果。 不同捕获剂捕获的超氧阴离子自由基见图7。 图7 不同捕获剂捕获的超氧阴离子自由基的ESR谱图Fig.7 ESR spectra of superoxide anion radicals captured by different capturing agents 由图7可知,同一自由基的峰数、出峰位置、峰强度与捕获剂的选取有关[19]。 由图8可知,超氧阴离子自由基的生成情况与等离子处理强度有关,在实验范围内,适当提高电压和处理时间能够提高超氧阴离子自由基的生成量,而加大处理量反而使得超氧阴离子自由基的生成量降低,这一结果与前文论述的MRPs抗氧化活性和末期产物生成量与等离子处理强度的影响变化相对应。添加MRPs后超氧阴离子自由基的含量降低,证明MRPs对超氧阴离子自由基具有一定的猝灭作用,且猝灭效果与其MRPs的含量呈正相关。 图8 不同处理对超氧阴离子自由基含量的影响Fig.8 Effects of different treatments on the content of superoxide anion radicals 羟基自由基测定结果见图9。 图9 不同处理强度下羟基自由基ESR谱图(A)及其拟合图(B)Fig.9 Hydroxyl radical ESR spectra (A) and its fitting diagram (B) under different treatment intensity 由图9中B可知,去离子水经过等离子体处理后,DMPO捕获到的图为DMPO-X图谱,通过叠加羟基自由基和DMPO谱图,发现其未知信号可能来源于羟基自由基,其叠加图和ESR谱图的峰数量和峰间距保持一致,产生这一现象的原因可能是等离子体放电过程不仅能产生自由基,可能同时会生成例如臭氧等小分子具有氧化性质的物质,将DMPO氧化。而羟基自由基生成量和等离子体处理强度的关系并不明确,这可能是由于等离子体处理使得处理液的pH改变[20],以及产生具有抗氧化活性的物质[21],从而使DMPO的捕获能力降低,导致有些实验组未捕获到羟基自由基。 由均匀实验结果可知,处理时间、处理电压对DPPH自由基的清除率具有显著的影响,处理量与处理时间具有显著的交互作用,对DPPH自由基的清除率具有显著的影响。由单因素实验结果可知,MRPs对DPPH自由基的清除效果受到等离子体处理的影响,升高电压或延长处理时间能够减弱MRPs的抗氧化活性,增大处理量会减少这一影响,这一结果和MRPs末期产物变化关系一致,因此低温等离子体处理MRPs会使MRPs末期产物降低,从而影响MRPs的抗氧化活性能力。通过检测等离子体处理产生的自由基种类和变化可知,超氧阴离子自由基的变化受等离子体处理的强度(电压、时间、处理量)的影响,且MRPs能够抑制超氧阴离子自由基的含量,而羟基自由基呈现不规律的变化,这极可能是低温等离子体处理过程中使得DMPO氧化开环导致捕获效果变弱。综上可知,等离子体在放电过程中会产生大量的不同种类的自由基,这极可能是经过等离子体处理后造成MRPs抗氧化活性降低的原因之一。

3.3 低温等离子体处理对MRPs褐变程度的影响
3.4 自由基测定结果


4 结论
