气相色谱-三重四极杆串联质谱法测定鲜食用菌中尼古丁和可替宁的含量
2023-03-20倪海平刘祥萍霍宗利李登昆
倪海平 ,刘祥萍* ,霍宗利 ,李登昆 ,张 云
(1.南京医科大学附属南京市疾病预防控制中心,南京 210003;2.江苏省疾病预防控制中心,南京 210001)
尼古丁又称烟碱,来源于自然界,当pH 大于10时,主要以分子态存在[1]。尼古丁会使人心跳加速、血压升高,大剂量摄入会引起呕吐和恶心,严重时会致死[2]。尼古丁在进入人体后,部分在肝脏中代谢为可替宁。食用菌中的可替宁为菌体内源性代谢产物,其含量与尼古丁含量呈正相关[3]。2009年欧盟修订鲜食用菌中尼古丁的最大残留限量为0.036 mg·kg-1,引起人们对鲜食用菌中尼古丁含量的关注[4]。
目前,尼古丁和可替宁的检测方法主要有高效液相色谱法[5]、毛细管电泳-紫外检测法[2]、气相色谱-质谱法[6]、固相微萃取-气相色谱-质谱法[7]、超高效液相色谱-串联质谱法[4]等。由于食用菌种类繁多,基质成分复杂,常规检测方法难以达到测定要求。鉴于此,本工作采用丙酮结合Qu ECh ERS 试剂包提取目标物,以二苯胺为内标[8],通过优化色谱条件和质谱参数,提出了气相色谱-三重四极杆串联质谱法测定鲜食用菌中尼古丁和可替宁含量的方法。
1 试验部分
1.1 仪器与试剂
GCMS-TQ8050 NX 三重四极杆型气相色谱质谱联用仪;Sorvall LYNX6000型高速落地离心机;QL-861型涡旋仪;XS-204 型电子天平;Milli-Q 型纯水机;0.45μm 聚四氟乙烯(PTFE)针式过滤器。
尼古丁和可替宁单标准溶液:1 000 mg·L-1。
混合标准储备溶液:100.0 mg·L-1,准确吸取尼古丁和可替宁单标准溶液各1.00 mL 于10 mL容量瓶中,用丙酮定容,配制成尼古丁和可替宁质量浓度均为100.0 mg·L-1的混合标准储备溶液。使用时,用丙酮稀释至所需质量浓度。
内标溶液:2.0 mg·L-1,准确称取20.0 mg二苯胺,用丙酮溶解后定容至10 mL,再用丙酮逐级稀释,配制成2.0 mg·L-1内标溶液。
二苯胺为美国化学会(ACS)级试剂;QuECh-ERS试剂包,含6 g 硫酸镁和1.5 g 乙酸钠,货号5982-5755。
1.2 仪器工作条件
1.2.1 色谱条件
DB-5MS色谱柱(30 m×0.25 mm,0.25μm);载气为氦气,流量1.2 mL·min-1;进样口温度280 ℃;进样压力220 kPa;不分流进样;进样时间1 min;进样量1μL。柱升温程序:初始温度50 ℃,保持1 min;以10 ℃·min-1速率升温至140 ℃,保持1 min;以5 ℃·min-1速率升温至210 ℃后,再以50 ℃·min-1速率升温至280 ℃,保持1 min。
1.2.2 质谱条件
电子轰击离子(EI)源;离子源温度25 ℃,接口温度28 ℃;溶剂延迟时间8 min;多反应监测(MRM)模式;其他质谱参数见表1,其中“*”为定量离子对。

表1 质谱参数Tab.1 MS parameters
1.3 试验方法
称取5.00 g样品于50 mL离心管中,准确加入丙酮5.00 mL和2.0 mg·L-1内标溶液25μL,涡旋1 min,加入Qu ECh ERS试剂包后再涡旋1 min,以12 000 r·min-1转速离心5 min,所得上清液经0.45μm PTFE针式过滤器过滤,取滤液待测。以尼古丁、可替宁的保留时间以及离子丰度比定性,内标法定量。
2 结果与讨论
2.1 色谱条件、质谱参数的优化
采用文献[9]报道的柱升温程序(初始温度50 ℃,保 持2 min;以30 ℃·min-1速率升温至150 ℃,保 持1 min;以20 ℃·min-1速率升温至220 ℃,保持5 min)分析50.0μg·L-1混合标准溶液和加标样品溶液(加标量为0.5μg)。结果表明:混合标准溶液和加标样品溶液中可替宁的出峰情况一致,保留时间为18.41 min;混合标准溶液中尼古丁保留时间为6.13 min,但加标样品溶液中尼古丁色谱峰在6.10 min附近有干扰,并且离子丰度比与混合标准溶液不符。因此,试验对柱升温程序进行优化,使干扰物与目标物完全分离。优化后的柱升温程序见1.2.1节,上述加标样品溶液在此条件下的色谱图见图1。
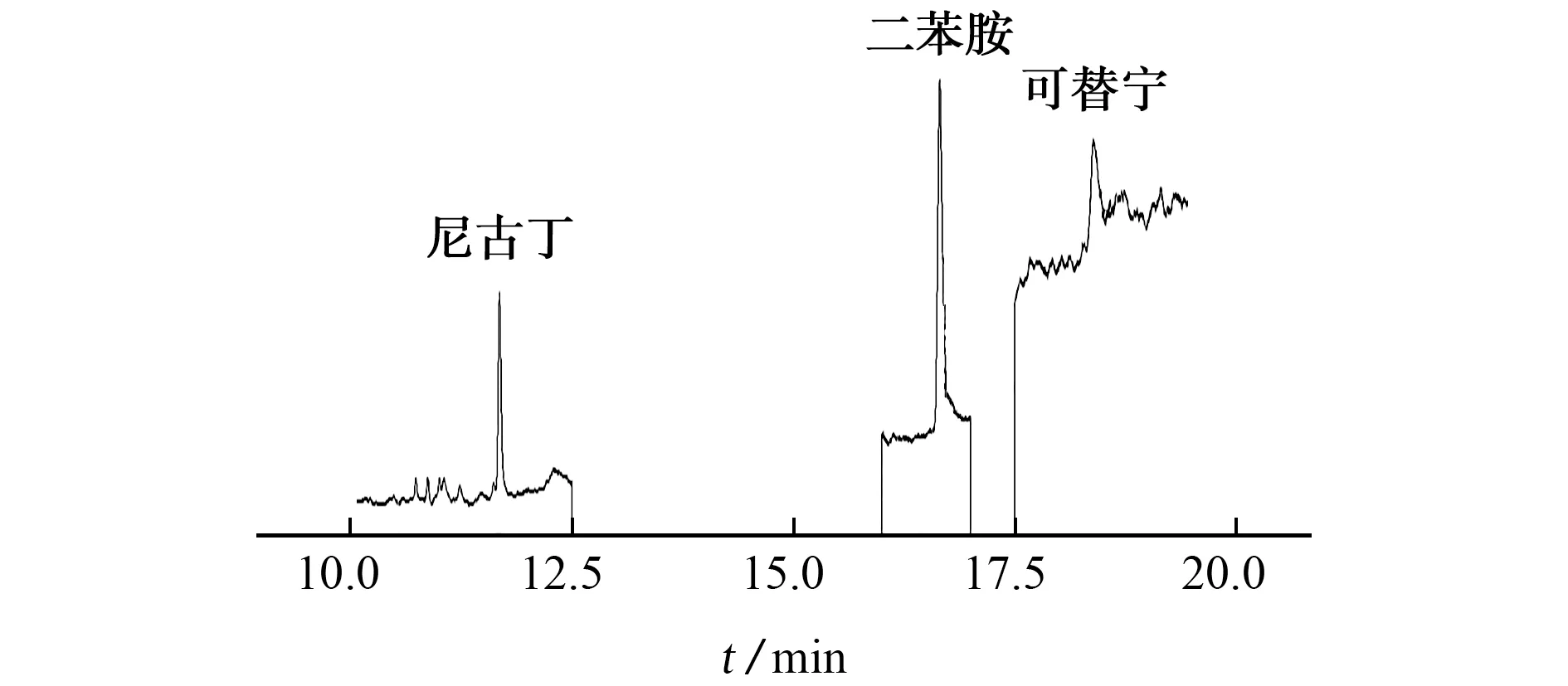
图1 加标样品溶液的色谱图Fig.1 Chromatogram of the spiked sample solution
混合标准溶液中尼古丁m/z84.10/82.10的离子对、可替宁m/z98.05/70.10的离子对响应较高,但加标样品溶液中这两个离子对均存在严重干扰,因此试验选择m/z162.10/84.10 和m/z176.10/98.10分别作为为尼古丁和可替宁的定量离子对。
2.2 提取条件的优化
2.2.1 提取剂
试验考察了66.7%(体积分数,下同)二氯甲烷溶液、乙腈、丙酮等3种提取剂的提取效果。结果表明:3种提取剂均能提取目标物,但66.7%二氯甲烷溶液提取后溶液颜色较深,干扰物较多;乙腈结合QuECh ERS试剂包提取得到的目标物色谱图展宽,影响定量分析;而丙酮结合QuECh ERS 试剂包提取得到的溶液可以直接进行检测,且尼古丁回收率为81.9%,可替宁回收率为89.3%。因此,试验选择的提取剂为丙酮。
2.2.2 Qu ECh ERS试剂包
试验考察了不同QuEChERS试剂包[①4 g硫酸镁、1 g氯化钠、1 g柠檬酸钠和0.5 g柠檬酸氢二钠;②6 g硫酸镁和1.5 g乙酸钠]对加标样品中目标物的提取效果。结果显示:使用Qu ECh ERS 试剂包①时,尼古丁和可替宁的回收率均不大于40.0%;使用QuEChERS试剂包②时,目标物回收率为96.7%~120%。可能是由于尼古丁和可替宁为弱碱性物质,乙酸钠为提取溶液提供了弱碱性环境,在盐析作用下目标物被萃取至丙酮中。并且试验发现在5.00 g样品中加入6 g硫酸镁和1.5 g乙酸钠可充分除去提取溶液中的水分,以防止尼古丁溶于水。因此,试验选用含6 g硫酸镁和1.5 g乙酸钠的Qu ECh ERS试剂包提取目标物。
试验还考察了QuECh ERS净化包(含885 mg硫酸镁、150 mgN-丙基乙二胺和15 mg石墨化碳黑)对提取溶液的净化效果,发现该QuEChERS净化包会吸附尼古丁,净化效果不明显。
2.3 基质效应、工作曲线和检出限
用空白提取溶液配制50.0μg·L-1基质匹配的混合标准溶液,按照仪器工作条件测定该溶液和相同质量浓度的混合标准溶液。根据基质效应(ME)值=目标物在基质匹配的混合标准溶液中的峰面积/目标物在混合标准溶液中的峰面积×100%计算ME值,结果得尼古丁ME值为156%,可替宁ME值为169%,表明存在基质增强效应。
用空白提取溶液和丙酮分别配制质量浓度为5.0,10.0,20.0,50.0,100.0,200.0μg·L-1的基质 匹配的混合标准溶液系列和混合标准溶液系列。以目标物与内标质量浓度比为横坐标,二者峰面积比为纵坐标绘制工作曲线和标准曲线。结果显示:两条曲线的线性范围均为5.0~200.0μg·L-1;尼古丁和可替宁工作曲线的线性回归方程为y=0.030 79x+0.030 80 和y=0.047 34x+0.002 130,相关系数为0.999 7和0.999 4;尼古丁和可替宁标准曲线的线性回归方程为y=0.025 22x-0.004 355 和y=0.033 35x-0.009 486,相关系数为0.999 6和0.999 0。经协方差分析,P值小于0.05,说明在5.0~200.0μg·L-1内两条曲线的斜率和截距均有差异,并且工作曲线斜率大于标准曲线斜率,进一步说明尼古丁和可替宁均存在基质增强效应。综上分析,试验选用工作曲线进行定量分析。
分别以信噪比大于3和10计算检出限和测定下限。结果显示:尼古丁的检出限为0.5μg·kg-1,测定下限为1.5 μg·kg-1;可替宁的检出限为2.0μg·kg-1,测定下限为5.0μg·kg-1。
2.4 精密度和回收试验
按照试验方法对空白样品进行3个浓度水平的加标回收试验,每个浓度水平测试6个平行样,计算回收率和测定值的相对标准偏差(RSD),结果见表2。
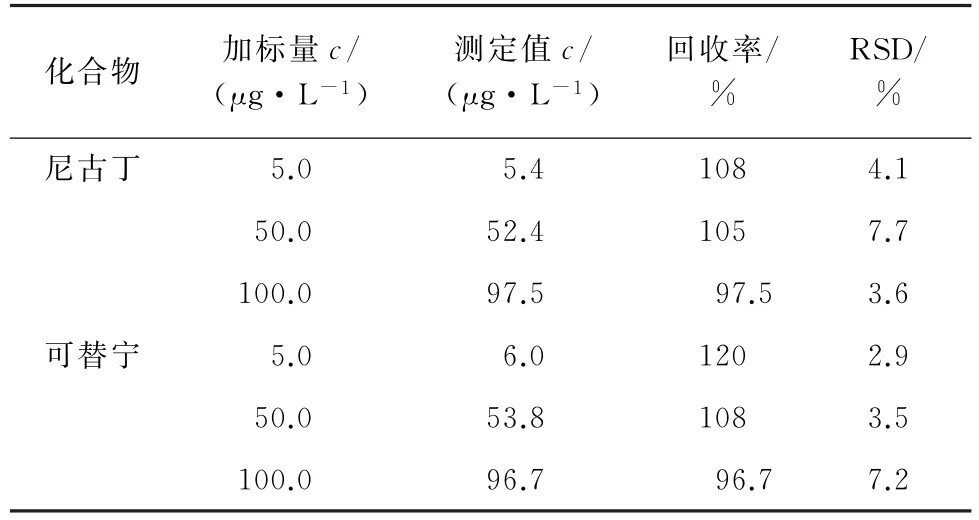
表2 精密度和回收试验结果(n=6)Tab.2 Results of tests for precision and recovery(n=6)
2.5 样品分析
采集南京市市售15份鲜食用菌,按照试验方法进行分析。结果表明,有13份样品检出尼古丁,检出率为86.7%,检出量为0.000 9~0.038 0 mg·kg-1,15份样品均未检出可替宁。
本工作以丙酮为提取剂,结合QuEChERS 试剂包提取尼古丁和可替宁,通过优化色谱条件和质谱参数,提出了一种快速、简便、稳定的气相色谱-三重四极杆串联质谱法测定鲜食用菌中尼古丁和可替宁含量的方法。
