基于生物质谱的蛋白质组学分析大西洋鲑中生物标志性肽段及过敏原特异性肽段
2023-03-20罗娇依郑越男刘彤彤郭亚辉孙姗姗
罗娇依 ,郑越男 ,刘彤彤 ,曹 进 ,郭亚辉 ,孙姗姗*
(1.中国食品药品检定研究院 国家市场监管重点实验室(食品质量与安全),北京 100050;2.松滋市公共检验检测中心,松滋 434200;3.江南大学 食品学院 食品科学与技术国家重点实验室,无锡 214122)
目前,已有多种食品分析技术应用于食品物种鉴别及过敏原检测,但可同时完成食品物种鉴别和过敏原检测的快速、可靠、高灵敏度的分析方法尚有待开发。DNA 条形码技术和定量免疫学分析技术(如免疫印迹法和酶联免疫吸附法)是传统鱼类鉴别的重要方法[1-2],前者可提供鱼类清晰可识别的DNA 序列,为水产品鉴定开辟新途径,提供水产品的物种序列[3-4]。虽然DNA 序列指导蛋白合成,但DNA 片段在基因表达过程中能否正确表达出过敏原蛋白具有不确定性,不能直接检测产品中的致敏蛋白;另一方面,食品基质及加工过程的复杂性会影响DNA 的提取效率,因此DNA 条形码技术在过敏原检测应用中存在局限性。定量免疫学分析技术不仅能对物种进行鉴别,还可以对过敏原成分进行检测,但是该方法灵敏度较低[5],食品基质的复杂性以及食品加工步骤可能改变蛋白结构,干扰对物种特异性蛋白的识别,从而出现假阴性或假阳性[6]。
基于生物质谱的蛋白质组学不仅可以对食品中的目标蛋白进行鉴定,还可以完成食品真实性鉴别,该技术有自上而下和自下而上两种途径[7]。物种不同但关系密切的同源蛋白可能仅存在几种氨基酸差异[8],这种差异很难被捕捉,因此自上而下研究策略不适用于物种鉴别。而自下而上研究策略是通过蛋白酶在特定位点切割蛋白形成多肽片段,对特定肽段的氨基酸序列进行分析,从而实现不同肽段在氨基酸序列水平上的分离[9-11]。这些特定肽段可被用作食品过敏原的生物标志物,也可作为物种真实性鉴别的标志性肽段。食品检验中选择特殊性强、差异化大的生物标志性肽段对于开发一种特定、通用的方法具有十分重要的意义[12]。文献[8]通过超高效液相色谱-高分辨质谱法筛选出大西洋鲑和虹鳟鱼的各5种生物标志性肽段,并对其特异性和稳定性进行考察,其中大西洋鲑的生物标志性肽段GDPGPGQQGVGPGGVGPAGGDK可用于大西洋鲑中虹鳟鱼掺假含量的定量检测,并成功区分了不同地区和不同批次的大西洋鲑和虹鳟鱼样品。文献[13-15]通过硫酸铵盐析、离子交换层析结合凝胶过滤方法对大西洋鲑中的小清蛋白进行纯化,得到的小清蛋白纯度达90%以上,应用免疫印迹法对纯化的小清蛋白进行过敏原性鉴定,结合激光辅助解析-飞行时间质谱法进行结构鉴定,采用圆二色谱、8-苯胺-1-萘磺酸(ANS)荧光探针及紫外-可见光谱技术研究了超声处理对大西洋鲑中的小清蛋白抗原性和结构的影响。鉴于此,本工作采用纳升液相色谱-四极杆-静电场轨道阱高分辨质谱联用法(Nano-UHPLC-Q/Exactive-HRMS)和超高效液相色谱-串联质谱法(UHPLC-MS/MS)筛选、鉴定大西洋鲑的生物标志性肽段和β-小清蛋白特异性肽段,并建立目标肽段的定量方法,旨在为大西洋鲑中过敏原β-小清蛋白的检测及大西洋鲑物种鉴别提供技术支持。
1 试验部分
1.1 仪器与试剂
Nano Ultimate 3000型液相色谱仪;Q-Extractive plus Orbitrap型质谱仪,配DPV 550 digital pico VIEW nanospray 型离子源;UPLC-Xevo TQ-S型超高效液相色谱-三重四极杆质谱仪;Bio Tek SYNERGY HT 型酶标仪;ZWF-110X30型恒温水浴摇床;CF16RXⅡ型离心机;SORVALL Legend MICRO 21R 型离心机。
单标准储备溶液:1 mmol·L-1,将4种标准特异性肽段及其同位素内标分别溶于水,配制成1 mmol·L-1单标准储备溶液。
磷酸盐缓冲溶液(PBS):取1片PBS片剂溶于100 mL 水,配制成 含0.01 mol·L-1磷酸盐、0.002 7 mol·L-1氯化钾、0.137 mol·L-1氯化钠的PBS。
二硫苏糖醇(DTT)溶液:500 mmol·L-1,称取7.7 mg DTT 标准品粉末,溶 于100 μL 50 mmol·L-1三羟甲基氨基甲烷-盐酸缓冲溶液(pH 8.0),配制成500 mmol·L-1DTT 溶液。
碘乙酰胺(IAA)溶液:100 mmol·L-1,称取18.6 mg IAA 标准品粉末,溶于1 mL 8 mol·L-1尿素溶液,配制成100 mmol·L-1IAA 溶液。
标准特异性肽段VAVNVEETK(缬氨酸-丙氨酸-缬氨酸-天冬酰胺-缬氨酸-谷氨酸-谷氨酸-苏氨酸-赖氨酸)及其内标V*(13C6,15N)AVNVEETK[V*(13C6,15N)同位素标记缬氨酸]、VAPLSEDFK(缬氨酸-丙氨酸-脯氨酸-亮氨酸-丝氨酸-谷氨酸-天冬氨酸-苯丙氨酸-赖氨酸)及其内标VAPL*(13C6,15N)SEDFK[L*(13C6,15N)同位素标记亮氨酸]、LTEIQSLER(亮氨酸-苏氨酸-谷氨酸-异亮氨酸-谷氨酰胺-丝氨酸-亮氨酸-谷氨酸-精氨酸)及其内标L*(13C6,15N)TEIQSLER[L*(13C6,15N)同位素标记亮氨酸]、TFFHTIGFASK(苏氨酸-苯丙氨酸-苯丙氨酸-组氨酸-苏氨酸-异亮氨酸-甘氨酸-苯丙氨酸-丙氨酸-丝氨酸-赖氨酸)及其内 标TF*(13C6,15N)FHTIGFASK[F*(13C6,15N)同位素标记苯丙氨酸]的纯度均不小于98%;胰蛋白酶(批号UA278568)、甲酸、乙腈、异丙醇、无水乙醇均为质谱级;DTT、IAA 标准品的纯度均不小于99%;盐酸为优级纯;三羟甲基氨基甲烷和尿素均为分析纯;试验用水为超纯水。
猪肉、牛肉、鸡肉、鸭肉、扇贝、章鱼、青龙虾、基围虾、黑虎虾、鲍鱼、生蚝、虹鳟鱼、大西洋鲑(挪威大西洋鲑)等样品均为市售产品。
1.2 仪器工作条件
1.2.1 Nano-UHPLC-Q/Exactive-HRMS
1)色谱条件 C18毛细管柱(15 cm×75μm,3μm);AcclaimTMPep MapTM100 Trap C18色谱柱(2 cm×100μm,5μm);Loading泵系统,流动相A为0.1%(体积分数,下同)甲酸溶液,B为含0.1%甲酸的50%(体积分数)异丙醇溶液,流量5.0μL·min-1;Nano泵系统,流动相A 为0.1%甲酸溶液,B为含0.1%甲酸的80%(体积分数)乙腈溶液,流量0.3μL·min-1;柱温4℃,样品室温度4℃;进样量10μL。Nano泵系统梯度洗脱程序:0~10 min时,B为5%;10~95 min时,B 由5%升至70%;95~100 min时,B由70%升至90%;100~130 min时,B由90%降至5%。
2)质谱条件 电喷雾离子源正离子(ESI+)模式电离,一级全扫描/数据依赖二级子离子模式(Full MS/dd-MS2)扫描;喷雾电压2.5 kV;毛细管温度250 ℃。Full MS扫描参数:分辨率70 000;目标自动增益控制(AGC)值1×106;最大注入时间60 ms;扫描范围 质荷比(m/z)300~1 500。dd-MS2扫描参数:分辨率17 500;目标AGC值1×105;最大注入时间60 ms;循环次数(Loop count)为10;最强离子数(Top N)为10;四极杆隔离窗口m/z2。
1.2.2 UHPLC-MS/MS
1)色谱条件 ACQUITY UPLC HSS T3 色谱柱(100 mm×2.1 mm,1.8μm);柱温30 ℃,样品室温度10 ℃;流量0.3 mL·min-1;进样量5μL;流动相A 为0.1%甲酸溶液,B 为乙腈。梯度洗脱程序:0~1 min时,B为5%;1~3 min时,B由5%升至70%;3~4 min时,B 由70%升至100%;4~6 min时,B由100%降至5%。
2)质谱条件 ESI+模式电离,多反应监测(MRM)模式扫描;毛细管电压3.0 kV;离子源温度120 ℃;脱溶剂气流量1 000 L·h-1,脱溶剂气温度500 ℃;锥孔气流量150 L·h-1;碰撞气为氩气,流量0.15 mL·min-1;目标肽段及其内标的MRM 参数见表1。

表1 目标肽段及其内标的MRM 参数Tab.1 MRM parameters of the target peptides and its internal standards
1.3 试验方法
1.3.1 数据分析
Nano-UHPLC-Q/Exactive-HRMS 原始数据导入PEAKS蛋白鉴定分析软件(版本8.0),进行De Novo、PEAKS DB、PEAKS PTM 分析。设定错误发现率(FDR)小于0.01、母离子容错度为10-5、每条肽段允许最大漏切数目为2;设定酰胺甲基化、去酰胺化、氧化、乙酰化修饰方式,每条肽段最多允许3种不同修饰方式,避免修饰过多导致肽段特异性匹配度降低。从Uniprot 网站(网址http://www.uniprot.org)下载大西洋鲑物种蛋白全序列谱库,作为原始数据匹配依据。
1.3.2 蛋白提取、富集和纯化
将大西洋鲑去除头部、内脏、鱼皮与鱼刺,搅碎后冷藏于-20 ℃。称取5 g样本于50 mL离心管,加入10 mL 正己烷,涡旋5 min,于4 ℃以转速9 000 r·min-1离心10 min;移除上清液,于沉淀中加入5 mL PBS(提取剂),涡旋5 min,于60 ℃水浴加热30 min,再于4 ℃以转速9 000 r·min-1离心10 min;取全部上清液,加入20 mL冷丙酮(丙酮于-20 ℃放置过夜),涡旋混匀,于-20 ℃静置2 h,再于4 ℃以转速9 000 r·min-1离心10 min;移除上清液,沉淀用10 mL PBS复溶,过0.2μm 聚丙烯(GHP)膜。
1.3.3 总蛋白含量的测定
采用Brad-ford 试剂盒测定总蛋白含量。向96孔板中依次加入50μL PBS、5μL蛋白提取液或5μL标准蛋白溶液系列(质量浓度依次为0.125,0.25,0.50,0.75,1.0,1.5,2.0 g·L-1)、200μL 考 马斯亮蓝染液,用酶标仪测定吸光度(测定波长为595 nm)。以标准蛋白溶液质量浓度为横坐标,对应的吸光度为纵坐标进行线性回归,根据建立的标准曲线计算样本中总蛋白含量。将蛋白提取液质量浓度稀释或浓缩至2.0 g·L-1后,待酶解。
1.3.4 蛋白酶解
1)高分辨质谱分析样本的酶解 移取含2.0 g·L-1蛋白的大西洋鲑提取液200μL,加入8 mol·L-1尿素溶液200μL,500 mmol·L-1DTT溶液40μL,于37℃水浴加热2 h,加入100 mmol·L-1IAA 溶液50μL,于暗处反应1 h 后,再加入500 mmol·L-1DTT 溶液50μL。参考文献[16-17],按照胰蛋白酶与总蛋白质量比为1∶20的比例加入胰蛋白酶,涡旋混匀后,于30 ℃摇床中以转速60 r·min-1孵育16 h,取出,加入10μL 甲酸终止反应,用水定容至1 mL,再于4℃以转速10 000 r·min-1离心10 min,上清液过0.2μm GHP 膜,待Nano-UHPLC-Q/Exactive-HRMS分析。
2)定量质谱分析样本的直接酶解 移取含2.0 g·L-1蛋白的大西洋鲑提取液100μL,按照胰蛋白酶与总蛋白质量比为1∶20的比例加入胰蛋白酶,随后步骤同高分辨质谱分析样本的酶解方法,并在酶解后加入内标,使其浓度为2.00μmol·L-1,得到的滤液待UHPLC-MS/MS 分析。经多次验证,提取液处于相同蛋白浓度水平下,省去变性与还原步骤直接酶解时,被检测离子对的丰度不受影响,可缩短操作时间,节省试验成本,此结果同文献[17]结果一致。
2 结果与讨论
2.1 特异性肽段的初级筛选及物种间交叉源性的二级筛选
大西洋鲑物种特异性肽段的初级筛选是基于自下而上的蛋白鉴定策略。首先采用Full MS模式扫描样本溶液中的母离子,四极杆进一步筛选响应值前10位的母离子碎裂出的子离子,并动态循环扫描,采集子离子信息;然后采用dd-MS2模式扫描,提供肽段母离子及其子离子的实际质量数,并与肽段b/y型裂解的氨基酸序列对应的理论质量数匹配,使用PEAKS软件对数据结果进行分析。结果共计鉴定出636种大西洋鲑蛋白,2 406条肽段。
特异性肽段的筛选一般遵循以下原则:①选择无缺失位点、无修饰、无漏切、响应值高、肽段长度为7~20个氨基酸;②排除含不稳定翻译后修饰基团的氨基酸序列;③排除含易氧化基团的氨基酸M(甲硫氨酸)与W(色氨酸)所在的肽段序列[18];④选取离子化后带两个正电荷的肽段,更有利于定量质谱分析。对于大西洋鲑中特定过敏原β-小清蛋白(序列号A0A286KA18),经筛选、酶切后鉴定出29条肽段(表2),其中仅第1~14条肽段符合特异性肽段属性。对于大西洋鲑物种特异性肽段,选择出26条来源于不同蛋白的高丰度肽段(表3),但这些肽段兼顾筛选要求的同时,其来源蛋白的特性应首先被评估,包括蛋白鉴定后在样本中的丰度、自身稳定性以及同源性等。例如,表3中α肌动蛋白、肌球蛋白-6作为肌肉蛋白在大西洋鲑中的丰度极高,肽段虽然符合筛选要求,但蛋白序列与其他物种的同源性也高度相似,可以排除作为特异性肽段筛选的来源蛋白。除此之外,还鉴定到了如丙酮酸激酶等多个中高丰度且参与代谢过程的酶类蛋白,但在蛋白提取过程中保持酶类蛋白稳定难度极大,其溶解性也各不相同,若自身结构在胰蛋白酶酶解前被破坏,会影响定量质谱分析,导致回收率降低,甚至无法检出。因此,鉴定出蛋白后,应根据试验目标依次对每个来源蛋白进行评估,综合考虑肽段和来源蛋白的性质,从而完成特异性肽段的初步筛选。

表2 β-小清蛋白酶切后的肽段序列Tab.2 Peptide sequences ofβ-parvalbumin after enzymolysis
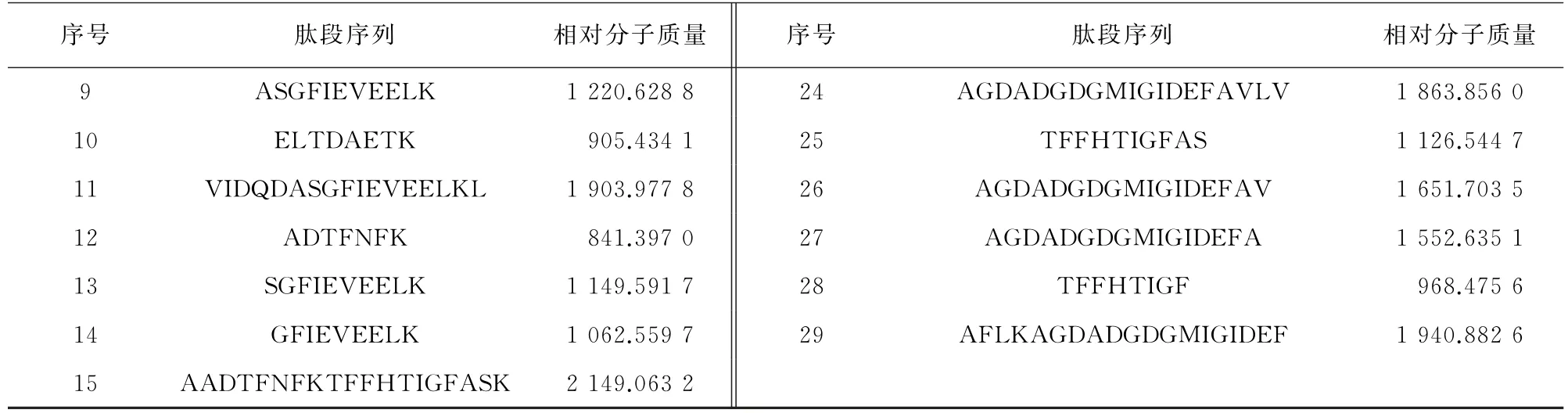
表2 (续)

表3 大西洋鲑中高丰度肽段序列Tab.3 High abundant peptide sequences in Salmo salar
大西洋鲑物种特异性肽段的交叉源性二级筛选有两个步骤。①BLAST 交叉源性二级筛选:通过Uniprot数据库中BLAST 检验工具(网址https://www.uniprot.org/blast/)对初选肽段进行交叉源性二级筛选,经BLAST 检验工具确认,分析同源性概率,结果筛选到过敏原特异性肽段1条(表2中△标记)、生物标志性肽段3条(表3中△标记);②交叉源性定量质谱验证:以上4 条目标肽段在鸡肉、鸭肉、猪肉、牛肉、章鱼、青龙虾、基围虾、黑虎虾、鲍鱼、生蚝、扇贝的蛋白提取液中均未检出。图1展示了在与大西洋鲑极其相似的虹鳟鱼提取液中4条目标肽段的检测结果。结果表明,作为鱼类主要过敏原的β-小清蛋白酶切肽段被检出[图1(a)],但大西洋鲑的3条生物标志性肽段未检出[图1(b)],说明大西洋鲑的3 条生物标志性肽段对于虹鳟鱼无特异性。

图1 目标肽段的子离子质谱图Fig.1 Daughter ion MS spectra of the target peptides
2.2 MRM 特异性肽段验证
MRM 被公认是灵敏度较高的检测方法,在食品靶向蛋白质组学中应用广泛[19]。由于高分辨质谱仪碰撞能量供给方式与普通定量质谱不同,当定量方法转化时,所筛选的离子对未必在定量质谱碰撞池中形成预测的子离子,因此需要将所筛选的大西洋鲑中生物标志性肽段与过敏原特异性肽段的酶解溶液进一步经MRM 分析确认,结果见图2。

图2 目标肽段的二级质谱图Fig.2 Secondary MS spectra of the target peptides
结果表明:高分辨质谱得到的肽段二级碎片离子(y离子)在定量质谱中均能被检测到,且高分辨质谱的二级质谱图中高丰度的y离子在定量质谱中的响应值高,可用于定量分析。
2.3 UHPLC-MS/MS质谱条件的优化
移取适量的单标准储备溶液,用水稀释,配制成4条目标肽段的混合标准溶液。按照1.2.2 节UHPLC-MS/MS仪器工作条件对混合标准溶液进行二级质谱扫描,选择丰度高且稳定的两个子离子分别作为定性离子和定量离子,并优化碰撞电压和锥孔电压,优化后的MRM 参数见表1。混合标准溶液的提取离子色谱图见图3。

图3 混合标准溶液的提取离子色谱图Fig.3 Extracted ion chromatograms of the mixed standard solution
2.4 蛋白提取条件的优化
通过L9(33)正交试验对料液比(样品质量∶提取液体积)、提取时间、提取温度等进行优化,根据检测到的肽段含量与样品总蛋白含量之比计算提取率。正交试验方案及结果见表4,极差分析结果见表5。

表4 正交试验方案及结果Tab.4 Scheme and results of the orthogonal test

表5 极差分析结果Tab.5 Results of the range analysis
结果表明:影 响 VAPLSEDFK、VAVNVEETK、LTEIQSLER 提取率的主要因素依次是提取温度、料液比、提取时间,影响TFFHTIGFASK 提取率的主要因素依次是提取温度、提取时间、料液比;VAPLSEDFK、VAVNVEETK、TFFHTIGFASK 的最佳提取温度与提取时间均为60 ℃和30 min;LTEIQSLER 的最佳提取温度与提取时间为40 ℃和2 h。但由于LTEIQSLER 提取率均可达到15%以上,而其他肽段提取率都在7%以下,为使更多肽段具有较高提取率,则优先考虑VAPLSEDFK、VAVNVEETK、TFFHTIGFASK的最佳提取条件。因此,试验选择的料液比为1∶1(即当样品质量为5 g时,提取液体积为5 mL),提取温度为60 ℃,提取时间为30 min,此时4条目标肽段均具有较高的提取率。
2.5 蛋白富集、纯化方式的优化
试验比较了超滤管(截留分子量3 k Da)和冷丙酮对蛋白富集、纯化的效果,并考察了冷丙酮加入量(提取液体积的1,2,4,6倍,即5,10,20,30 mL)对 4条目标肽段提取率的影响,结果见图4。

图4 超滤管和丙酮对目标肽段提取率的影响Fig.4 Effects of ultrafiltration and acetone on the extration rates of the target peptides
结果表明:超滤管对蛋白富集、纯化效果低于冷丙酮,这可能是由于冷丙酮与水的亲和力强,能破坏蛋白分子的水化膜[20],使蛋白变性、沉淀并终止蛋白本身的分解[21];当加入20 mL 冷丙酮时,LTEIQSLER、VAPLSEDFK、VAVNVEETK、TFFHTIGFASK 的提取率均较高。因此,试验选择采用20 mL冷丙酮富集、纯化蛋白。
2.6 标准曲线和检出限
移取适量的单标准储备溶液,用水稀释,配制成VAVNVEETK、VAPLSEDFK、LTEIQSLER 浓 度为0,0.01,0.10,0.50,1.00,5.00 μmol·L-1,TFFHTIGFASK浓度为0,0.50,1.00,2.50,5.00,10.00μmol·L-1,内标浓度为2.00μmol·L-1的混合标准溶液系列。按照UHPLC-MS/MS仪器工作条件进行测定,以目标肽段与内标浓度之比为横坐标,二者峰面积之比为纵坐标建立标准曲线,线性参数见表6。以3倍信噪比(S/N)计算检出限(3S/N),结果见表6。

表6 线性参数和检出限Tab.6 Linearity parameters and detection limits
2.7 精密度和回收试验
将猪肉、牛肉、鸡肉、鸭肉按照1∶1∶1∶1的质量比混合,得到空白样品。在空白样品提取液中添加低、中、高等3个浓度水平的混合标准溶液,按照试验方法提取、富集、纯化、直接酶解蛋白后,按照UHPLC-MS/MS 仪器工作条件进行测定,计算回收率和测定值的相对标准偏差(RSD),结果见表7。

表7 精密度和回收试验结果(n=6)Tab.7 Results of tests for precision and recovery(n=6)
结果显示:4条目标肽段的回收率为90.2%~105%,测定值的RSD 为1.5%~4.6%。
2.8 样品分析及大西洋鲑新鲜度评价
按照试验方法对大西洋鲑贮存过程中VAVNVEETK、VAPLSEDFK、LTEIQSLER、TFFHTIGFASK 的含量进行测定。试验发现,在4 ℃条件下贮存4 d时,大西洋鲑样品色泽稍暗淡,略带异味,肌肉组织不致密但也不松散;贮存至10 d时,大西洋鲑样品色泽暗淡,肌肉切面无光泽,有强烈的腥臭味,肌肉组织松散不致密,肌肉受压后凹陷不消失,失去肌肉弹性,需停止贮存期的测定。测定结果见表8。

表8 大西洋鲑贮存过程中目标肽段的含量Tab.8 Contents of the target peptides in Salmo salar during storage μg·g-1
结果显示:来自富含亮氨酸蛋白-20 的生物标志性肽段LTEIQSLER 和β-小清蛋白特异性肽段TFFHTIGFASK 的含量没有发生明显变化,而来自载脂蛋白A1的生物标志性肽段VAVNVEETK、VAPLSEDFK 的含量随贮存天数的延长逐渐减少,此结果与文献[16]的研究结果一致,说明大西洋鲑中载脂蛋白A1含量随贮存期的延长而减少,因此该蛋白有望成为判别大西洋鲑新鲜度的指标;贮存0~4 d 时,VAVNVEETK、VAPLSEDFK 含量相近;贮存6~10 d 时,VAVNVEETK 含量约为VAPLSEDFK的50%,并且8~10 d 时VAVNVEETK 含量在检出限附近,而VAPLSEDFK 含量的下降幅度略缓慢,因此VAPLSEDFK 更适合作为大西洋鲑新鲜度评价指标。来源相同的不同肽段在贮存过程中含量变化不一致的原因可能是因为VAVNVEETK 更容易被氧化,贮存环境加速了该肽段中氨基酸的降解[22]。
本工作基于蛋白质组学自下而上研究策略,采用Nano-UHPLC-Q/Exactive-HRMS 和UHPLCMS/MS,筛选、鉴定大西洋鲑物种的生物标志性肽段(VAVNVEETK、VAPLSEDFK、LTEIQSLER)和过敏原β-小清蛋白的特异性肽段(TFFHTIGFASK),对蛋白的提取条件、富集、纯化方法进行优化,并提出了UHPLC-MS/MS快速测定大西洋鲑中生物标志性肽段和过敏原β-小清蛋白特异性肽段含量的方法。该方法分析快速、检出限低、特异性好,提高了测定的灵敏度,减少了交叉反应的干扰,推广了肽段在大西洋鲑新鲜度评价中的适用性,为大西洋鲑中过敏原β-小清蛋白的检测、大西洋鲑物种鉴别及新鲜度评价提供技术支持,为食品过敏原标签的规范化提供参考。
