lncRNA H19在心力衰竭中的临床意义及对心肌细胞凋亡的影响*
2023-03-17王军珂司增梅宋彦洁王迎春李宁
王军珂, 司增梅, 宋彦洁, 王迎春, 李宁△
1青岛大学青岛医学院(山东青岛 266000); 2青岛大学附属医院核医学科(山东青岛 266000); 3青岛大学附属青岛市海慈医院心脏中心(山东青岛 266000)
目前,心力衰竭(heart failure,HF)全球患病人数已超过3 770万人,已成为心血管疾病中最常见的类型[1-2]。HF是许多病因继发的心脏功能损害的一个共同的慢性阶段,对患者的正常生活甚至生命安全均有着极大的威胁[3-4]。长链非编码RNA(long noncoding RNA,lncRNAs)正是近年来临床研究的热点之一,近年来研究发现lncRNA H19(H19)与HF的发生有关,被认为可能是HF患者有效的生物标志物[5-6]。然而,它在HF中的意义仍然很大程度上是未知的。研究发现,H19可以激活转化生长因子-β(transforming growth factor-β,TGF-β)/重组人Smad3蛋白(SMAD family member 3,Smad3)信号通路,由于TGF-β1/Smad3信号通路与不同类型的心血管疾病有关,H19可能在HF发病机制中起重要作用[7~9]。Zhuo等[10]在糖尿病心肌病大鼠模型中发现H19可通过DIRAS 3影响心肌细胞的自噬。Zhang等[11]对300例冠心病患者血浆标本中8个独立的lncRNAs的循环水平进行了检测,发现血浆H19是冠心病的独立预测因子。但是,目前有关H19与HF的研究还较为少见。 因此本研究旨在探讨H19在HF中的临床意义并通过TGF-β1/Smad3信号通路影响心肌细胞凋亡机制,这可能为理解HF的分子机制提供新的见解。
1 资料与方法
1.1 一般资料 选择2018年5月至2021年5月期间,我院收治的327例HF患者作为研究组,50例性别与年龄匹配的单纯糖尿病(或高血压)患者作为对照组。HF的诊断根据2017年ACC/AHA/HFSAHF管理重点更新指南中列出的标准[12]。本次研究严格遵循《赫尔辛基宣言》进行,并已获得我院伦理委员会的批准,所有研究对象均签署了知情同意书。
纳入标准:(1)初步诊断慢性HF至少3个月;(2)纽约心脏协会(New York heart association,NYHA)第Ⅰ~Ⅲ级;(3)所有研究对象年龄均>18岁。
排除标准:(1)患有心肌梗死、不稳定心绞痛等其他心脑血管疾病;(2)严重呼吸疾病;(3)恶性肿瘤;(4)身体残疾以及精神疾病。
1.2 血液标本采集 采集所有受试者空腹血5 mL,样品经2 000×g离心,4℃离心10 min,血浆保存于-80℃,待用。患者的各种生化指标均来自我院检验科检测数据。
1.3 RNA提取和逆转录-定量聚合酶链反应(RT-qPCR) 使用TRIzol试剂从血浆(或细胞)中提取总RNA,根据制造商的指示(美国Thermo Fisher公司),使用SuperScript Ⅲ反转录酶试剂盒对总RNA进行逆转录(美国Thermo Fisher公司)。采用SYBR-Green qPCR方法对cDNA进行扩增分析。反应条件:25℃ 30 min,42℃ 30 min,85℃ 5 min。PCR扩增40个周期,条件为95℃ 12 s,62℃ 40 s。使用GAPDH作为内源性对照,所有PCR反应均重复3次,使用2-ΔΔCT方法进行归一化。
1.4 心肌细胞来源 从1~2日龄Sprague-Dawley大鼠中分离出新生心室肌细胞。将手术切除的心肌组织置于37℃的D-Hanks缓冲液(含胰酶1.2 mg/mL和胶原酶0.14 mg/mL)中进行消化(美国GIBCO公司)。离心后,将细胞悬浮在Dulbecco改良的Eagle培养基/F-12中。分离细胞在37℃下预镀1 h,通过黏附心肌成纤维细胞分离心肌细胞。收集心肌细胞,稀释细胞至1×106·mL-1,在37℃和5%CO2条件下进行培养。
1.5 表达载体的构建与转染 H19低表达载体(si-H19组),H19低表达载体对照(si-H19对照组),TGF-β1过表达载体(pcDNA3.1组)和TGF-β1过表达载体对照(pcDNA3.1对照组)由中国上海Sangon公司设计合成。将心肌细胞培养到70%~80%的浓度,并使用Lipofectamine 2000试剂进行瞬时细胞转染。未转染的细胞(空白组)和空载体转染的细胞作为两个对照。
1.6 Western blot RIPA裂解心肌细胞并提取总蛋白,经10% SDS-PAGE凝胶电泳转移到PVDF膜后,在室温下在5%脱脂牛奶中封闭2 h。然后,用TGF-β1 (1∶1 300)、Smad3(1∶1 300)和GAPDH (1∶1 300)一抗4 ℃孵育过夜。随后,将膜与IgG-HRP山羊抗兔二抗(1∶900)在室温下孵育2 h(抗体均购买自中国Abcam公司)。使用增强型化学发光试剂(ECL,中国Sigma-Aldrich公司)进行显影,使用Image Jv1.46软件对数据进行归一化。
1.7 细胞凋亡检测 转染24 h后收集心肌细胞。用6孔板培养细胞,每孔加入150 μmol/L H2O2。细胞培养24 h,然后用0.25%胰酶消化。最后用碘化丙啶(PI)和Annexin V-FITC(日本Dojindo公司)染色,流式细胞术检测凋亡细胞。

2 结果
2.1 研究对象的特点 两组性别、年龄等基线资料比较差异均无统计学意义(P>0.05),而研究组尿酸(uric acid,UA)、氨基末端脑钠肽前体(N-terminal pro-B type natriuretic peptide, NT-proBNP)则高于对照组(P<0.05),左室射血分数(left ventricular ejection fraction,LVEF)低于对照组(P<0.05)。见表1。
2.2 HF患者血浆中H19表达水平升高 与对照组(1.00±0.14)相比,研究组HF患者血浆中H19表达水平(1.83±0.36)明显升高(t=15.920,P<0.001),ROC曲线分析显示,曲线下面积为0.874,H19对HF的诊断特异度、敏感度分别为98.00%、77.22%。见图1。

表1 两组临床资料分析
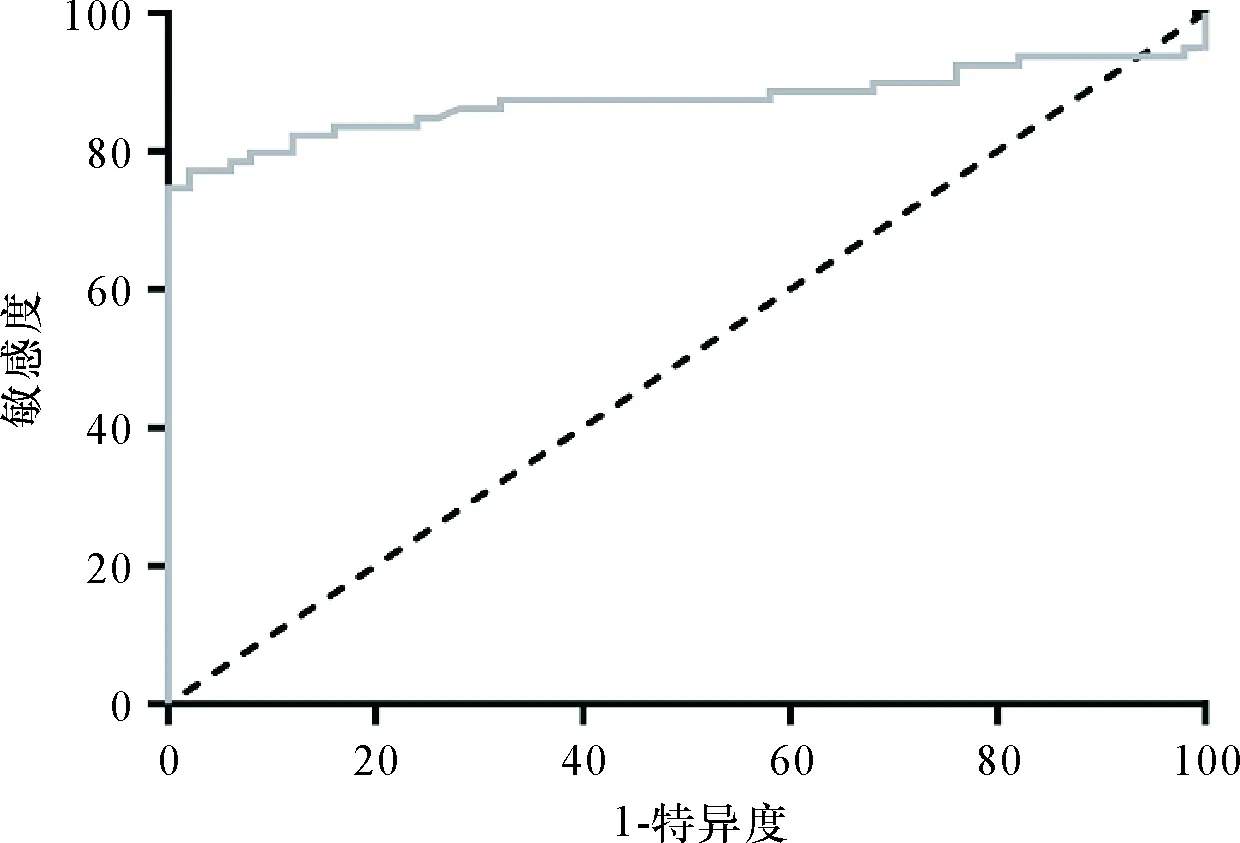
图1 ROC曲线分析H19预测HF的敏感度和特异度
H19与HF患者临床特征的关系见表2。血浆H19与BMI(r=0.13,P=0.03)、LDL-C(r=-0.25,P=0.02)、UA(r=0.38,P<0.01)、NT-proBNP(r=0.51,P<0.01)、LVEF(r=-0.73,P<0.01)以及高血压(r=0.16,P=0.03)有关,与其他临床特征无关。进一步多因素logistic回归分析显示,即使经过年龄、性别、BMI、LDL-C、UA、NT-proBNP、LVEF和高血压等因素的调整,血浆H19升高仍是HF的独立危险因素(OR=1.09,95%CI=1.014~1.186,P=0.01)。
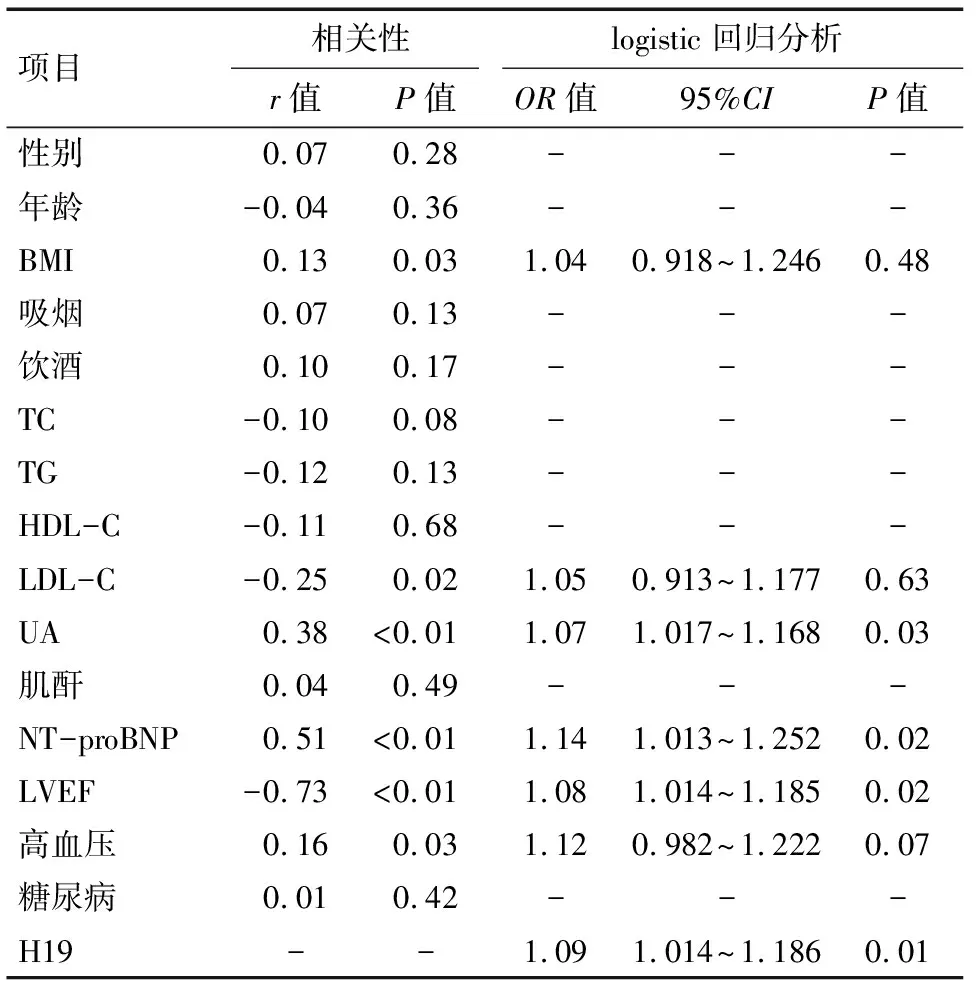
表2 H19与HF患者临床特征的关系
2.3 沉默H19抑制心肌细胞凋亡 转染24 h后,在心肌细胞中,H19明显降低(P<0.05)。细胞凋亡实验结果显示,在H2O2的处理下,抑制H19能够降低心肌细胞凋亡(P<0.05)。转染24 h后,在心肌细胞中过表达TGF-β1后的H19仍然保持在正常水平,这证明了TGF-β1/Smad3信号通路不能调控H19的表达(P>0.05),同时发现,抑制H19的表达水平后,TGF-β1与Smad3在蛋白水平上具有明显的低水平表达,这说明H19可能具有TGF-β1/Smad3信号通路的调控能力(P<0.05)。见表3。

表3 H19对心肌细胞凋亡和TGF-β1/Smad3信号通路的影响
2.4 激活TGF-β1/Smad3信号通路对心肌细胞凋亡的作用 转染24 h后,在心肌细胞中,TGF-β1表达升高(P<0.05),另外,过表达TGF-β1促进了Smad3的表达水平。细胞凋亡实验结果显示,在H2O2的处理下,TGF-β1过表达导致心肌细胞凋亡率升高(P<0.05)。见表4。

表4 TGF-β1/Smad3信号通路对心肌细胞凋亡的影响
2.5 激活TGF-β1/Smad3信号通路部分恢复了沉默H19对心肌细胞凋亡的抑制作用 在H2O2的处理下,心肌细胞凋亡水平有所上升(P<0.05),沉默的H19基因的抑制了过表达的TGF-β1/Smad3信号通路对凋亡水平的调控。这一实验说明H19具有对TGF-β1/Smad3信号通路的调控能力。见表5。

表5 H19通过TGF-β1/Smad3信号通路对心肌细胞凋亡的影响
3 讨论
在本研究中,我们分析了H19在HF中的临床意义以及对心肌细胞凋亡的影响机制,我们发现,H19在HF患者表达水平升高,并对HF具有一定的诊断价值,而且,我们通过体外细胞实验发现H19通过激活TGF-β1/Smad3信号通路促进心肌细胞凋亡。
随着临床对于HF的预防以及治疗手段的进展,HF患者的病死率正在逐年下降[13]。但在全球范围内,仍然有17%~45%的住院HF患者在入院后1年内死亡,大多数在入院后5年内死亡,产生的临床治疗费用对公众健康来说是一个沉重的负担[14]。因此寻找HF的生物标志物,制定个性化的治疗方法来调高患者生存率具有重要意义。H19在冠心病中常表达升高,并且与冠心病的易感性有关[15-16]。本研究发现,在HF患者中H19出现表达水平上升,并且对HF具有一定诊断价值,其曲线下面积为0.874,并且H19升高是HF的独立危险因素。在Greco等[17]的研究中也显示,在非终末期HF患者心肌组织中,H19表达明显升高,并且与心肌肥厚有关。但在糖尿病心肌病患者中,H19表达水平降低,并参与心肌细胞自噬作用的抑制[18]。因此,我们认为还需要更多的研究以及临床样本来证实我们的结论。
TGF-β1/Smad3信号通路在HF发展过程中被激活[19],所以抑制TGF-β1/Smad3信号通路被认为是治疗慢性HF一个有希望的靶点[20-21],许多研究报道TGF-β1/Smad3信号通路受lncRNA的调控[22- 23],最近一项研究报告表明,H19也能够激活TGF-β1/Smad3信号通路[24]。在本研究中,我们发现沉默H19能够抑制TGF-β1/Smad3信号通路与心肌细胞的凋亡。值得注意的是,过表达TGF-β1仅部分恢复了沉默H19对心肌细胞凋亡的抑制作用。因此,H19也可能与其他细胞因子相互作用,调节心肌细胞凋亡。
H19在HF中呈高表达,通过激活TGF-β1/Smad3信号通路促进心肌细胞的凋亡,参与HF的发展。
利益相关声明:文章所有作者共同认可论文不存在利益冲突。
作者贡献说明:王军珂、李宁参与实验设计、实施研究,王军珂论文撰写,王军珂、司增梅、宋彦洁、王迎春参与数据采集、统计分析,李宁对论文的知识性内容作批评性审阅,指导论文。
