地榆皂苷Ⅰ对脓毒症大鼠急性肺损伤的保护作用及机制研究 Δ
2023-03-17包代琴刘奕言张紫森佘汉谭磊李涛毛庆祥刘良明陆军特色医学中心麻醉科重庆40004陆军特色医学中心野战外科研究部战伤休克与输血研究室创伤烧伤与复合伤国家重点实验室重庆40004
包代琴 ,刘奕言 ,张紫森 ,佘汉 ,谭磊 ,李涛 ,毛庆祥 ,刘良明 (.陆军特色医学中心麻醉科,重庆 40004;.陆军特色医学中心野战外科研究部战伤休克与输血研究室/创伤、烧伤与复合伤国家重点实验室,重庆 40004)
脓毒症是由机体对感染反应失调引起的危及生命的器官功能障碍[1]。肺是脓毒症后易受损的靶器官之一,在病程早期便可出现严重的急性肺损伤,这是导致组织缺血、缺氧,进而诱发多器官功能障碍甚至衰竭的重要原因[2]。目前临床缺乏针对脓毒症肺损伤的保护措施,研究肺损伤的防治措施对脓毒症的救治具有重要意义。
地榆是蔷薇科植物地榆Sanguisorba officinalisL.的干燥根,为我国传统中药,具有广泛的药用价值,其化学成分丰富,包含酚类、黄酮类、三萜类等多种化学成分,具有凉血止血、解毒敛疮及抗菌等多种功效[3]。地榆皂苷属于地榆三萜皂苷类化合物,根据化学结构式的不同分为地榆皂苷Ⅰ和地榆皂苷Ⅱ[4]。研究发现,地榆皂苷Ⅰ因其抗氧化、抗病毒、抗出血和抗肿瘤等特性在多种疾病中均发挥重要作用[5―6]。近年来针对皂苷类的研究发现,地榆皂苷Ⅰ作为潜在的药物活性物质,具有刺激免疫细胞增殖和细胞因子分泌的功能[7];其因具有抗氧化和下调炎症介质白细胞介素1β(interleukin 1 beta,IL‑1β)和基质金属蛋白酶 2(matrix metalloproteinase 2,MMP‑2)转录水平的作用,而被用于美容类抗皱产品[8]。此外,地榆皂苷Ⅰ还能诱导基因P53介导的G2/M细胞周期阻滞和细胞凋亡,从而抑制乳腺癌细胞增殖[9]。然而,地榆皂苷Ⅰ对脓毒症后急性肺损伤是否有保护作用,目前尚不清楚。网络药理学是运用生物信息学的方法,通过对药物与基因、蛋白质‑蛋白质互作(protein‑protein in‐teraction)数据进行集成分析,从而指导研究者更好地对中药单体治疗疾病的具体机制进行研究。因此,本研究运用网络药理学的方法来预测地榆皂苷Ⅰ治疗脓毒症的潜在靶点,并通过盲肠结扎穿孔(cecum ligation and puncture,CLP)术建立脓毒症大鼠模型,验证地榆皂苷Ⅰ对脓毒症大鼠急性肺损伤的保护作用及机制。
1 材料
1.1 实验动物
健康成年SD大鼠192只,雌雄各半,体质量(200±20) g,由陆军特色医学中心实验动物中心提供,实验动物生产许可证号:SCXK(渝)20170002,使用许可证号:SYXK(渝)20170002。大鼠自由饮食,实验前禁食12 h。
1.2 主要药物与试剂
地榆皂苷Ⅰ(批号D‑022,纯度98%)购自成都瑞芬思生物科技有限公司;伊文思蓝(货号E2129)购自美国Sigma公司;肿瘤坏死因子 α(tumor necrosis factor‑α,TNF‑α)、IL‑6酶联免疫吸附试验(ELISA)试剂盒(货号分别为E‑EL‑R2856c、E‑EL‑R0015c)均购自武汉伊莱瑞特生物科技股份有限公司;兔源紧密连接蛋白1(tight junction protein 1,ZO‑1)抗体、兔源血管内皮钙黏蛋白(vascular endothelial cadherin,VE‑cadherin)抗体(货号分别为ab190085、ab231227)均购自英国Abcam公司;山羊抗兔IgG二抗(货号DkxGt‑003‑ERHOX)购自美国LI‑COR公司;戊巴比妥钠(货号57‑33‑0)购自上海依赫生物有限公司;林格氏液(货号RYX010)购自青岛捷世康生物科技有限公司;多巴胺、头孢呋辛钠(货号分别为M62581‑20MG、C3747‑1G)均购自上海璧合生化科技有限公司;苏木素染液、伊红染液(货号分别为H69840、AG1100)均购自上海吉至生化科技有限公司;β‑肌动蛋白抗体(β‑actin,货号LM‑0061R)购自上海联迈生物工程有限公司。
1.3 主要仪器
Allegra 64R型高速冷冻离心机购自美国Beckman Coulter公司;Odyssey型双色红外线激光成像系统购自美国LI‑COR公司;spark型多功能微孔板检测仪购自奥地利Tecan公司;BV51W1型微循环显微镜购自日本Olympus公司;GEM3500型全自动血气分析仪(货号GEM3500)购自上海朗逸医疗器械有限公司。
2 方法
2.1 网络药理学分析
2.1.1 脓毒症的靶点筛选 通过PubChem数据库(http://pubchem.ncbi.nlm.nih.gov/)搜索地榆皂苷Ⅰ的英文关键词“ziyuglycoside Ⅰ”,得到其3D结构,导入Swiss‑TargetPrediction 数据库(http://www.swisstargetpredic‐tion.ch/)[10],得到相关的预测靶点。
2.1.2 脓毒症‑地榆皂苷Ⅰ共同靶点筛选 通过Gene Cards数据库(https://www.genecards.org/)[11]搜索关键词“脓毒症”,得到其相关靶点。通过Venny在线绘图工具(https://bioinfogp.cnb.csic.es/tools/venny/index.html)绘制脓毒症与地榆皂苷Ⅰ的靶点交集图。
2.1.3 脓毒症‑地榆皂苷Ⅰ靶点的PPI网络构建 通过将Venny图取交集得到的靶点数据输入到String数据库(https://string‑db.org/)[12],利用Cytoscape 3.7.1软件绘制PPI网络图[13]。
2.1.4 基因本体功能富集分析和京都基因与基因组百科全书通路富集分析 通过David数据库(https://david.ncifcrf.gov/)[14]对脓毒症与地榆皂苷Ⅰ靶点交集进行基因本体(gene ontology,GO)功能富集分析和京都基因与基因组百科全书(Kyoto encyclopedia of genes and ge‐nomes,KEGG)通路富集分析,以P≤0.05进行功能条目和信号通路筛选。
2.2 实验验证
2.2.1 分组、造模与给药 将192只SD大鼠按随机数字表法分为4组:假手术组(Sham组)、脓毒症组(Sep组)、常规治疗组(CT组)和地榆皂苷Ⅰ治疗组(ZgⅠ组),每组48只。本文采用CLP术制备SD大鼠脓毒症模型,以30 mg/kg戊巴比妥钠经腹腔进行麻醉,大鼠对针刺感无反应后,将其置于绑鼠板,沿腹中线剪开皮肤约2 cm。Sham组只进行探查操作,不进行盲肠结扎和穿孔。Sep组、CT组、ZgⅠ组用无菌镊探查盲肠后用无菌手术缝线(4#)于回盲瓣下方近盲肠端1/4处结扎盲肠,使用20G无菌针头于盲肠远端近结扎处穿孔,此时针头从进针处贯通盲肠,挤出肠道内容物约0.2 mL,按解剖结构将结扎盲肠与肠道内容物一同还纳腹腔并用无菌手术缝线(1#)逐层缝合切口。术后每组按25 mL/kg剂量腹腔注射无菌生理盐水。CLP术后 12 h 插管监测大鼠平均动脉压,当平均动脉压下降30%或以上,认为造模成功[15]。CT组大鼠在CLP术后12 h经股静脉输注35 mL/kg林格氏液,同时予以1.75 mg/kg血管活性药物多巴胺及100 mg/kg抗生素头孢呋辛钠。ZgⅠ组大鼠在CLP术前1 h经鼠尾静脉注射10 mg/kg地榆皂苷Ⅰ[实验前,将100 mg地榆皂苷Ⅰ溶于1 mL 二甲基亚砜(DMSO)得到100 mg/mL地榆皂苷Ⅰ溶液],术后12 h在常规治疗的基础上股静脉输注10 mg/kg地榆皂苷Ⅰ(取地榆皂苷Ⅰ溶液溶于500 μL无菌生理盐水后经尾静脉注射给药,保证DMSO最终浓度低于10%,减轻DMSO对动物的毒性)。治疗结束后,结扎大鼠股静脉,分层缝合肌肉和皮肤,放回动物房单笼观察。本实验剂量依据均参考前期预实验结果。
2.2.2 大鼠动脉血气及血清炎症因子水平检测 分别采用全自动血气分析仪和ELISA试剂盒检测。Sep组大鼠于术后12 h,Sham组、CT组和ZgⅠ组大鼠于治疗结束后3 h,将大鼠麻醉固定,取大鼠腹主动脉血1 mL,检测动脉氢离子浓度指数(hydrogen ion concentration,简称pH值)、动脉血氧分压(partial arterial oxygen pressure,PO2)、二氧化碳分压(partial pressure of carbon dioxide,PCO2)水平。另取大鼠股静脉血2 mL,室温下静置2 h,1 000×g离心10 min,取上层血清,检测大鼠血清炎症因子TNF‑α、IL‑6水平。
2.2.3 肺湿/干质量比计算 取材时间同“2.2.2”项下,将大鼠麻醉固定并处死,打开胸腔,取左肺上叶,用滤纸吸干肺组织表面血液,并称质量,而后放置在锡箔纸上。50 ℃烤箱烘干72 h后再次称质量,计算湿/干质量比,作为评价肺水肿情况的指标。
2.2.4 肺组织病理形态观察 采用苏木素‑伊红(HE)染色。取材时间同“2.2.2”项下,在大鼠吸气末夹闭并结扎气管,使肺充盈,打开胸腔,经心脏灌注等渗生理盐水直至肺组织几乎不见血色,后用4%多聚甲醛继续灌注。取下肺组织,用4%多聚甲醛固定后,石蜡包埋并切片。将肺组织石蜡切片置于60 ℃烤箱,于二甲苯和梯度酒精中脱蜡并水化。苏木素染细胞核,伊红染细胞质,脱水封片后使用微循环显微镜观察各组大鼠肺组织病理形态并拍照。
2.2.5 肺血管通透性观察 采用伊文思蓝染色。取材时间同“2.2.2”项下,经颈静脉插管按60 mg/kg剂量注射伊文思蓝,注射后30 min沿腹白线打开腹腔,结扎下腔静脉,剪开腹主动脉,经颈静脉缓慢灌注50 mL生理盐水,此时肺组织基本不见血色,取完整肺组织并处死大鼠。用冷PBS漂洗表面血液,滤纸吸干组织表面水分,立即肉眼观察肺血管通透性并拍照。
2.2.6 肺静脉ZO‑1、VE‑cadherin蛋白表达的检测 采用Western blot法检测。取材时间同“2.2.2”项下,取肺静脉组织,提取组织总蛋白。经电泳分离蛋白,转膜,脱脂牛奶封闭,孵育ZO‑1一抗、VE‑cadherin一抗、β‑actin一抗(稀释度分别为1∶1 000、1∶2 000、1∶6 000),4 ℃冰箱过夜。次日TBST洗膜3次,每次5 min,室温孵育山羊抗兔二抗(稀释度1∶20 000),采用双色红外线激光成像系统曝片。采用Image J软件分析蛋白条带灰度值,以目的条带灰度值与β‑actin条带灰度值的比值表示目的蛋白的表达水平。
2.2.7 大鼠72 h存活情况 每组按随机数表法随机选取16只SD大鼠,CLP术后12 h造模成功开始,记录大鼠的72 h存活时间,并计算72 h存活率。
2.3 统计学分析
采用SPSS 19.0统计软件进行统计学处理。计量资料以±s表示,多组间比较采用单因素方差分析,组间两两比较采用LSD‑t检验;存活情况采用Kaplan‑Meier生存曲线分析。检验水准α=0.05。
3 结果
3.1 网络药理学分析结果
3.1.1 地榆皂苷Ⅰ潜在靶点预测 使用PubChem数据库获得地榆皂苷Ⅰ的SDF格式化学结构,导入SwissTarget‐Prediction数据库,筛选得到地榆皂苷Ⅰ靶点共100个,按照概率进行排序,选取排名前10位的基因和靶点,见表1。
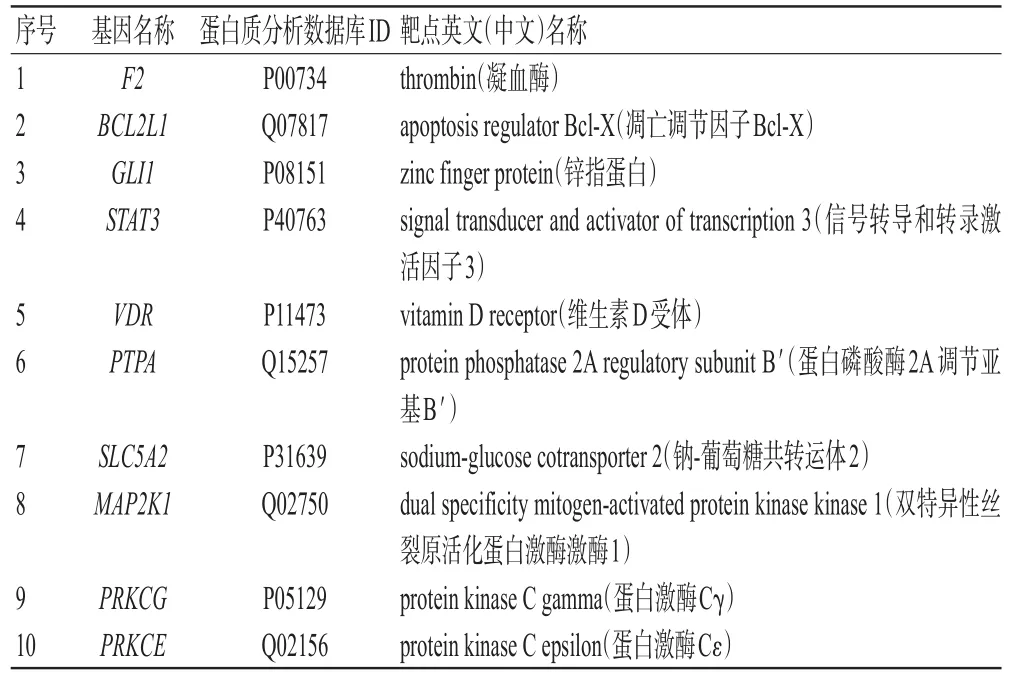
表1 地榆皂苷Ⅰ靶点预测排名前10位的基因和靶点
3.1.2 脓毒症‑地榆皂苷Ⅰ靶点的筛选结果 从Gene Cards数据库中获得与脓毒症相关的靶点共1 854个。100个地榆皂苷Ⅰ靶点与1 854个脓毒症相关靶点筛选出共同靶点47个,为地榆皂苷Ⅰ治疗脓毒症的潜在靶点,详见图1A。
3.1.3 脓毒症‑地榆皂苷Ⅰ靶点的PPI网络构建结果 将47个交集靶点导入String数据库,获得脓毒症‑地榆皂苷Ⅰ靶点PPI网络图,详见图1B。结果显示,PPI网络共包括47个节点和314条边,其中节点平均度为10.6,平均局部聚集系数为0.558。

图1 脓毒症‑地榆皂苷Ⅰ靶点网络
3.1.4 GO功能富集和KEGG通路富集分析结果 将地榆皂苷Ⅰ和脓毒症交集的47个共同靶点通过David数据库进行GO功能富集分析和KEGG通路富集分析,根据P≤0.05共筛选出245个GO功能条目和117个KEGG信号通路,详见图2。GO功能富集分析结果显示,活性氧族代谢正向调控 (positive regulation of reactive oxygen species metabolic process)、损伤修复(would healing)、内皮细胞增殖调控(regulation of endothelial cell prolifera‐tion)、细胞激活(cell activation)、血管发生(blood vessel development)、氧化 应激反应(response to oxidative stress)等生物学过程参与其中。KEGG通路富集分析结果显示,细胞凋亡(apoptosis)、缺氧诱导因子1信号通路(HIF‑1 signaling pathway)、紧密连接(tight junction)等多条信号通路参与其中。根据以上网络药理学结果预测,地榆皂苷Ⅰ可能通过改善脓毒症后血管内皮细胞间连接、保护肺血管屏障功能,来减轻脓毒症急性肺损伤。

图2 地榆皂苷Ⅰ治疗脓毒症的GO功能富集和KEGG通路富集分析图(排名前10位)
3.2 实验验证结果
3.2.1 大鼠动脉血气及血清炎症因子检测结果 大鼠动脉血气检测结果显示,与Sham组比较,Sep组大鼠pH值、PO2水平显著降低,PCO2水平显著升高(P<0.05);与Sep组比较,CT组大鼠pH值、PO2水平显著升高,PCO2水平显著降低(P<0.05);与CT组比较,ZgⅠ组大鼠pH值、PO2水平显著升高,PCO2水平显著降低(P<0.05),接近Sham组水平。血清炎症因子检测结果显示,与Sham组比较,Sep组大鼠血清TNF‑α、IL‑6水平显著升高(P<0.05);与Sep组比较,CT组大鼠血清IL‑6水平显著降低(P<0.05);与CT组比较,ZgⅠ组大鼠血清炎症因子TNF‑α、IL‑6水平显著降低(P<0.05),接近Sham组水平。结果见图3、图4。

图3 各组大鼠动脉血气检测结果
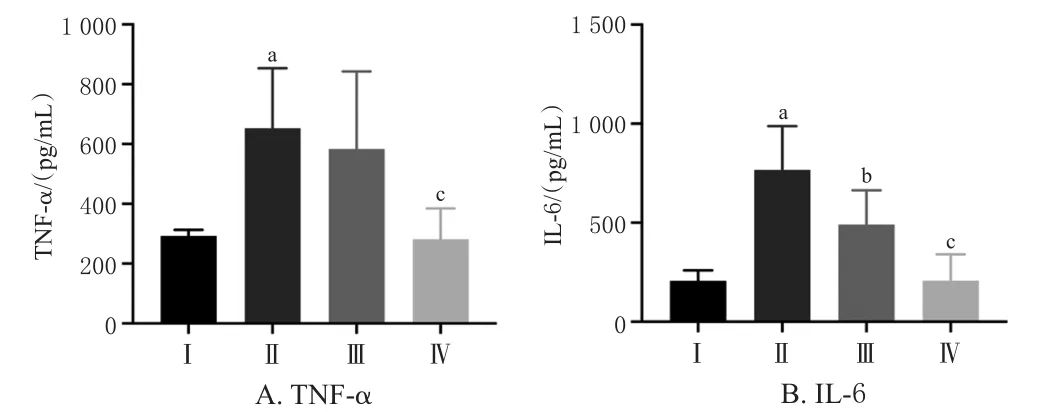
图4 各组大鼠血清炎症因子检测结果
3.2.2 肺湿/干质量比计算结果 与Sham组比较,Sep组大鼠肺湿/干质量比显著升高(P<0.05);与Sep组比较,CT组大鼠肺湿/干质量比显著降低(P<0.05);与CT组比较,ZgⅠ组大鼠肺湿/干质量比显著降低(P<0.05),接近Sham组水平。结果见图5。

图5 各组大鼠肺组织湿/干质量比结果
3.2.3 肺组织病理变化结果 HE染色结果显示,Sham组大鼠肺泡轮廓清晰可见,结构完整,肺泡壁厚度正常,未见炎性细胞浸润;与Sham组比较,Sep组大鼠肺泡出现大范围破裂,肺泡壁增厚并伴有水肿,有明显炎性细胞浸润;与Sep组比较,CT组大鼠肺组织病理结构无明显改善;与CT组比较,ZgⅠ组大鼠肺泡破裂情况明显减少,肺泡结构几乎恢复正常,肺泡壁厚度降低,炎性细胞浸润明显降低。结果见图6。

图6 各组大鼠肺组织病理形态显微图(HE染色,×200)
3.2.4 肺血管通透性观察结果 伊文思蓝染色结果显示,Sham组大鼠肺表面光滑、折光度好,仅有少量蓝色斑点,伊文思蓝渗漏极少;与Sham组比较,Sep组大鼠肺表面颜色暗淡,有大量伊文思蓝渗出,左下肺呈明显深蓝色;与Sep组比较,CT组大鼠肺表面颜色和伊文思蓝渗出无明显改善;与CT组比较,ZgⅠ组大鼠肺表面色泽明显改善,伊文思蓝渗漏点大幅减少,提示地榆皂苷Ⅰ治疗可明显改善脓毒症大鼠肺血管通透性。结果见图7。

图7 各组大鼠肺组织血管通透性观察结果(伊文思蓝染色)
3.2.5 肺静脉ZO‑1、VE‑cadherin蛋白表达检测结果 与Sham组比较,Sep组大鼠肺静脉ZO‑1、VE‑cadherin的蛋白表达水平显著降低(P<0.05);与Sep组比较,CT组大鼠肺静脉ZO‑1蛋白表达水平显著升高(P<0.05);与CT组比较,ZgⅠ组大鼠肺静脉ZO‑1、VE‑cadherin表达水平显著升高(P<0.05),接近Sham组蛋白表达水平。结果见图8。

图8 各组大鼠肺静脉ZO‑1、VE‑cadherin蛋白表达结果
3.2.6 大鼠72 h存活结果 Sep组大鼠72 h存活率为12.5%(2/16),存活时间较Sham组大鼠显著缩短(P<0.05);CT组大鼠72 h存活率为25.0%(4/16),存活时间与Sep组大鼠比较差异无统计学意义(P>0.05);ZgⅠ组大鼠72 h存活率为31.2%(5/16),存活时间较CT组大鼠显著延长(P<0.05)。结果见图9。

图9 各组大鼠72 h存活率和存活时间结果
4 讨论
脓毒症是一种由感染引起的生理、病理和生化异常综合征,严重脓毒症可导致多器官功能障碍综合征。迄今为止,炎症诱导的细胞因子激活和大量活性氧簇形成被认为是脓毒症的主要致病机制[2]。流行病学调查显示,肺被认为是脓毒症最早累及的器官,约半数脓毒症休克患者伴随急性肺损伤或者急性呼吸窘迫综合征,其特征是肺部炎症、肺水肿、低顺应性和由于肺血管通透性增加引起的肺毛细血管渗漏[16―17]。基于中药在脓毒症治疗中突出的疗效,近年来应用中西医结合方法治疗脓毒症相关肺损伤是我国医学研究的重要课题之一,寻找能有效治疗脓毒症的中药单体和复方制剂,成为目前的研究热点。离体实验中,研究人员发现地榆皂苷Ⅰ在发挥显著自由基清除能力时(10~50 μg/mL)无细胞毒性,同时还能在转录水平显著抑制MMP‑1的表达[18―20]。在体实验中,研究人员发现含地榆皂苷Ⅰ的护肤霜能显著拮抗紫外线辐射诱导的裸鼠光老化,且能在转录水平显著抑制IL‑1β、MMP‑2、MMP‑9的表达,发挥减轻炎症和减慢胶原蛋白降解速率的作用[21]。但目前尚未见地榆皂苷Ⅰ应用于脓毒症治疗的研究。
本研究通过构建“药物‑靶点‑疾病‑通路”网络模型,结合GO功能富集分析发现,活性氧簇代谢正向调控、损伤修复、内皮细胞增殖调控、细胞激活、血管发生、氧化应激反应等生物学过程参与其中;再结合KEGG通路富集分析发现,在相关信号通路中,主要有细胞凋亡、紧密连接、缺氧诱导因子1信号通路等多条信号通路参与其中。
血管内皮细胞具有多种生理功能,参与机体凝血、免疫、物质转运和生物活性物质释放等多项重要的生命活动[22―23]。脓毒症后血管内皮受损,血管渗漏导致血管内液体外渗,致使组织水肿和有效循环量下降,损伤组织和器官功能,并最终发展为多器官功能障碍[24―25]。因此,血管通透性增加作为脓毒症重要的病理生理过程,是导致多器官功能损伤和高死亡率的重要原因之一。血管通透性主要与内皮细胞屏障完整性相关联,脓毒症后血管内皮紧密连接结构破坏,是导致血管渗漏的主要原因[26]。
本研究网络药理学结果预测,地榆皂苷Ⅰ治疗脓毒症可能与紧密连接、血管功能等有关。因此,本研究观察了地榆皂苷Ⅰ对脓毒症后动物肺血管渗漏及动物存活的影响。与CT组比较,ZgⅠ组大鼠肺血管渗漏明显改善,肺静脉紧密连接蛋白ZO‑1和钙黏蛋白VE‑cadherin表达显著恢复;同时,肺功能接近正常水平,肺病理结构明显改善,炎症细胞浸润明显减少,肺水肿明显减轻,血清炎症因子水平显著下降,大鼠72 h存活率明显提高,存活时间显著延长。
综上所述,地榆皂苷Ⅰ通过增强紧密连接信号通路,调控肺血管紧密连接蛋白ZO‑1及钙黏蛋白VE‑cadherin表达水平,从而减轻脓毒症后肺血管渗漏,改善动物存活率,提高存活时间。
