生、酒五味子对失眠小鼠神经‑内分泌‑免疫网络的影响及机制 Δ
2023-03-17王瑞英李惠珍刘亚丽朱根华艾志福宋永贵江西中医药大学中医药防治认知障碍脑疾病江西省重点实验室中药药效防治精神障碍脑疾病评价江西省中医药管理局重点研究室抑郁症中医证候动物模型江西省中医药管理局重点研究室南昌000南昌医学院药效与安全性评价江西省卫生健康重点实验室抗炎类中药药效与质量评价江西省中医药管理局重点研究室南昌000江西古香今韵大健康产业有限公司南昌009南昌大学第一附属医院血液净化中心南昌000
王瑞英 ,苏 丹 ,李惠珍 ,刘亚丽 ,朱根华 ,杨 明 ,艾志福 ,罗 涛 ,薛 冰 ,宋永贵 [.江西中医药大学中医药防治认知障碍脑疾病江西省重点实验室/中药药效(防治精神障碍脑疾病)评价江西省中医药管理局重点研究室/抑郁症中医证候动物模型江西省中医药管理局重点研究室,南昌 000;.南昌医学院药效与安全性评价江西省卫生健康重点实验室/抗炎类中药药效与质量评价江西省中医药管理局重点研究室,南昌 000;.江西古香今韵大健康产业有限公司,南昌 009;.南昌大学第一附属医院血液净化中心,南昌 000]
随着工作和生活压力越来越大,睡眠障碍已成为现代人不可忽视的健康隐患,全世界有30%~40%的人有睡眠问题[1]。长期的失眠会给人体造成活动障碍,使人体的记忆力退化,甚至会引起老年痴呆等疾病[2]。中医以其独特的视角,早在《黄帝内经》中已对人的睡眠生理有了较完整的认识,在2 000多年的临床实践中,探索出了独具特色、安全性高、效果良好的药物。中药五味子始载于《神农本草经》,具有敛肺滋肾、生津敛汗、涩精止泻、宁心安神的功效[3]。五味子临床应用极为广泛,其单体、木脂素、提取物均具有改善失眠的作用[4―6]。同时,五味子与其他药物组合,可治疗各种类型的失眠,失眠经典方剂天王补心丹及养心安神丸中均含有五味子[7―8]。
由于中药具有多成分、多靶点、多通路的协同调控作用,作用机制复杂,关于生、酒五味子对失眠的具体影响尚不清楚,需要进一步探究。近年来的研究显示,睡眠时相与神经‑内分泌‑免疫网络的间接调控密不可分[9]。神经‑内分泌‑免疫网络学说将神经、内分泌、免疫三大系统相互之间的调节关系作为动态性整体进行全面系统研究,并以细胞因子、激素、神经递质作为信息分子来实现人体整体功能的调控[10]。本实验通过神经‑内分泌‑免疫网络探索生、酒五味子改善睡眠的作用机制,以期为五味子防治睡眠障碍性疾病提供理论基础。
1 材料
1.1 动物
雄性C57BL/6小鼠50只,3周龄,体质量(10±2) g,购自河南斯克贝斯生物科技股份有限公司,动物生产合格证号:SCXK(豫)2020‑0005。小鼠饲养于江西中医药大学实验动物科技中心,动物使用许可证号:SYXK(赣)2017‑0004。小鼠于12 h光暗周期、室温20~22 ℃、相对湿度45%~65%的安静环境中饲养,可自由饮水和进食。本实验通过江西中医药大学动物伦理实验委员会批准,伦理号:JZLLSC20210061。
1.2 主要药物及试剂
木兰科植物五味子Schisandra chinensis(Turcz.)Baill.的干燥成熟果实购自长春市一品根源参茸特产有限公司,经江西中医药大学岐黄国医书院主管药师吴蜀瑶鉴定为北五味子。地西泮片(批号H31021151,规格2.5 mg)购自上海上药信谊药厂有限公司。时钟基因Bmal1、生物钟基因Clock、周期基因Per2、内参甘油醛‑3‑磷酸脱氢酶(GAPDH)由武汉赛维尔生物科技有限公司设计;兔源肿瘤坏死因子 α(tumor necrosis factor‑α,TNF‑α)抗体(批号60291‑1‑Ig)购自美国Proteintech 公司;异硫氰酸荧光素标记的羊抗兔免疫球蛋白G(IgG)二抗(批号Ezz‑AB‑1055)购自武汉伊莱瑞特生物科技有限公司;兔源白细胞介素1β(interleukin 1β,IL‑1β)抗体(批号ab300499)购自美国Abcam公司;去甲肾上腺素(noradrenaline,NE)对照品(批号51‑41‑2,纯度98%)购自中国药品生物制品检定所;对乙酰氨基酚(acetamino‐phen,ACE)对照品、γ‑氨基丁酸(gamma‑aminobutyric acid,GABA)对照品、多巴胺(dopamine,DA)对照品、谷氨酸(glutamic acid,Glu)对照品、5‑羟色胺(5‑hydroxy‐tryptamine,5‑HT)对照品、皮质醇(cortisone,CORT)对照品、甲状腺素对照品(批号分别为B20338、B21979、B25300、S10067、S38336、B21001、S20192,纯度分别为99%、99%、98%、98%、98%、98%、98%)均购自上海源叶生物科技有限公司;牙科水泥及其自凝水溶剂均购自上海玉研科学仪器有限公司;抗荧光淬灭封片液、4′,6‑二脒基‑2‑苯基吲哚(DAPI)染色液(批号分别为16D26C36、16I29C76)均购自于武汉博士德生物工程有限公司。
1.3 主要仪器
XR‑XZ301S型SMART 3.0动物行为学视频分析系统购自上海欣软信息科技有限公司;63001型旷场实验检测箱购自深圳市瑞沃德生命科技有限公司;ABI GeneAmp®9700型聚合酶链式反应(PCR)扩增仪购自瑞士Roche公司;TCS SP8型激光共聚焦显微系统购自德国Leica公司;68003型脑立体定位仪购自深圳市瑞沃德生命科技有限公司;UltiMate 3000型超高效液相色谱仪购自日本岛津公司;Triple TOF 5600型串联飞行时间质谱仪购自美国Sciex公司;小鼠脑电、肌电记录监测系统购自美国Pinnacle公司。
2 方法
2.1 生、酒五味子提取物的制备
生五味子提取物的制备:将五味子干燥成熟果实用8倍量的水每次提取2 h,共提取3次,在真空中浓缩成浸膏,在冷冻干燥机中干燥浸膏,在4 ℃冰箱中储存备用。酒五味子按照如下传统工艺进行制备:取五味子干燥成熟果实,加黄酒(每100 kg生品五味子加黄酒20 kg)拌匀,稍闷,置蒸器内(密封)蒸至上大汽,当五味子表面显示紫黑色后,放入干燥箱中60 ℃彻底干燥后获得酒五味子;将制得的酒蒸五味子用8倍量的水每次提取2 h,共提取3次,在真空中浓缩成浸膏,在冷冻干燥机中干燥浸膏,在4 ℃冰箱中储存备用。
2.2 分组、造模与给药
50只小鼠随机分为空白组、模型组、地西泮组(阳性对照)、生五味子组、酒五味子组,每组10只。除空白组外,其余4组小鼠按0.47 mg/kg腹腔注射甲状腺素溶液进行造模。当小鼠出现活动次数增加、易激惹、昼夜节律缺失、白天与夜晚活动不间断等行为表示造模成功[11]。每天造模结束后,生五味子组、酒五味子组小鼠分别灌胃生、酒五味子溶液各0.85 g/(kg·d)[12],地西泮组小鼠灌胃地西泮1 mg/(kg·d)[13],空白组和模型组小鼠给予等体积的生理盐水,所有小鼠每日灌胃1次,共持续35 d。
2.3 小鼠一般状态观察
每日观察小鼠外观(毛发色泽、光亮度、稀疏程度)、神态(精神状态、意识状态、反应灵敏度)、活动、食欲等一般状况。
2.4 小鼠自主活动测试
灌胃给药第35 d后进行旷场实验,将小鼠放置于旷场实验检测箱的中心区域进行测试,测试时间4 min,前1 min为适应期,记录3 min内小鼠总活动距离及直立次数。
2.5 小鼠睡眠时相监测
将小鼠麻醉,用脑立体定位仪固定,充分暴露颅骨,钻孔,将与记录电极连接的不锈钢螺丝钉植入颅骨相应位置及背部颈肌。在12 h/12 h的明暗光照条件下,采用小鼠脑电、肌电记录监测系统录小鼠的脑电、肌电信号。记录结束后,根据统一设定的标准扫描记录的信号,自动判别出觉醒期(wake)、非快速眼动睡眠期(non‑rapid eye movement,NREM)和快速眼动睡眠期(rapid eye movement,REM),计算出各自所占时间比。
2.6 实验取材
各组小鼠完成睡眠时相监测后,用0.5%戊巴比妥钠经腹腔注射麻醉小鼠,断头取脑,冰上分离小鼠脑视交叉上核(suprachiasmatic nucleus,SCN)组织,一部分置于液氮速冻,并于24 h内移至-80 ℃冰箱保存备用,另一部分置于4%多聚甲醛溶液中固定备用。
2.7 小鼠脑SCN组织中神经递质含量检测
2.7.1 脑SCN组织样本的制备 称取“2.6”项下小鼠脑SCN组织,按质量体积比1∶2加入预冷生理盐水制成脑匀浆后,取匀浆液 100 μL,加入 360 μL 乙腈和 20 μL ACE(内标)。在4 ℃以15 000 r/min 离心15 min,吸取上清液100 μL于进样小瓶中,放入冰箱保存,用于超高效液相色谱‑串联质谱分析。
2.7.2 色谱条件 色谱条件为Welch C18柱(1.7 mm×100 mm,1.7 μm),流动相为 0.01%甲酸水溶液(A)‑乙腈(B),梯度洗脱(0.001~1 min,2%B;1~4 min,2%B→30%B;4~10 min,30%B→90%B;10~10.1 min,90%B→100%B;10.1~13 min,100%B;13~13.1 min,100%B→5%B)。进样量为2 μL,柱温为40 ℃。
2.7.3 质谱条件 以正离子多反应检测模式进行扫描。各神经递质及内标质谱参数信息见表1。
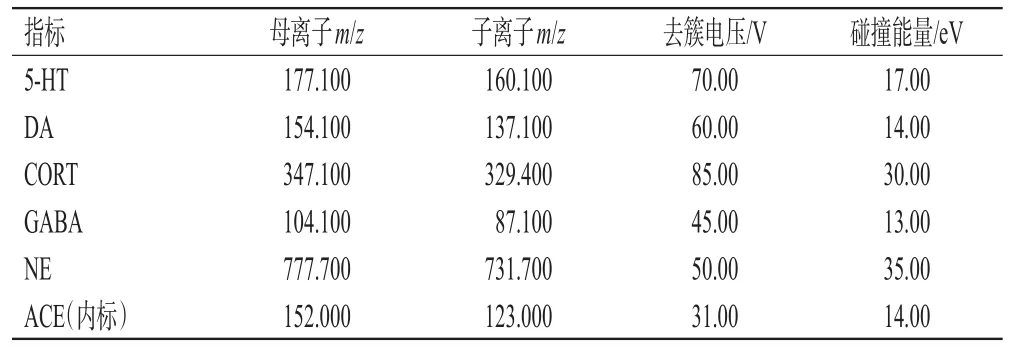
表1 小鼠脑SCN组织中各神经递质及内标质谱参数
2.8 小鼠脑SCN组织中IL‑1β、TNF‑α表达检测
取“2.6”项下4%多聚甲醛溶液中固定的小鼠脑SCN组织,依次进行石蜡包埋、切片、脱水,加入IL‑1β一抗、TNF‑α一抗(稀释度分别为1∶500、1∶100),孵育过夜,次日用磷酸盐缓冲液(PBS)冲洗;加入异硫氰酸荧光素标记的羊抗兔IgG二抗(稀释度为1∶100),室温孵育15 min;加入DAPI染液染色,PBS冲洗,防荧光猝灭剂封片。每张切片随机选取5个高倍(×400)视野,使用Image J软件对免疫荧光图片进行处理并计算荧光强度,荧光强度=该区域荧光强度总和/该区域面积。绿色荧光代表目的蛋白的表达,蓝色荧光代表DAPI。
2.9 小鼠脑SCN组织中Bmal1 1、Clock、Per 22 mRNA表达的检测
采用实时荧光定量PCR检测。取“2.6”项下-80 ℃冻存的小鼠脑SCN组织,先用Trizol提取总RNA,并检测总RNA浓度及纯度。取总RNA适量,反转录成cDNA后进行PCR扩增。反应条件为:94 ℃,30 s,然后分三步反应,即94 ℃、5 s,55 ℃、15 s,72 ℃、10 s,进行42个循环,用以检测Per2、Bmal1、ClockmRNA的表达。采用2-ΔΔCt法计算目的基因的相对表达水平,并以GAPDH为参照基因,各基因引物序列及产物长度见表2。

表2 引物序列及产物长度
2.10 统计学方法
所有数据均采用统计软件GraphPad Prism 6.0处理,计量资料以±s表示,组间比较采用单因素方差分析,进一步两两比较使用LSD‑t检验。检验水准α=0.05。
3 结果
3.1 生、酒五味子对小鼠一般状态的影响
空白组小鼠精神状态良好、动作反应灵敏,比较温和,饮食和饮水正常,毛发色泽光亮,昼夜节律正常。与空白组比较,模型组小鼠精神状态相对萎靡,对外界刺激敏感,容易激怒和受惊,饮食量和饮水量增加,体质量降低,毛发粗糙无光泽,昼夜节律出现不规律现象。与模型组比较,生五味子组、酒五味子组和地西泮组小鼠精神状态较好,饮食量和饮水量降低(接近空白组),毛发色泽有少量不光泽,昼夜节律相对得到改善。
3.2 生、酒五味子对小鼠自主活动的影响
与空白组比较,模型组小鼠总活动距离、直立次数均显著降低(P<0.01)。与模型组比较,地西泮组小鼠总活动距离、直立次数均显著增加(P<0.01);酒五味子组、生五味子组小鼠的直立次数均显著增加(P<0.05)。结果见图1。
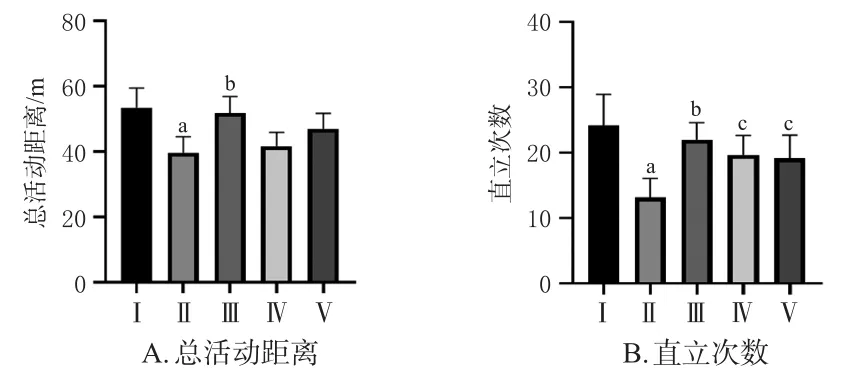
图1 各组小鼠自主活动相关指标检测结果(±s,n=10)
3.3 生、酒五味子对小鼠睡眠时相的影响
与空白组比较,模型组小鼠wake所占时间比显著上升(P<0.05),NREM、REM所占时间比显著下降(P<0.01或P<0.05)。与模型组比较,地西泮组、酒五味子组小鼠wake所占时间比显著下降(P<0.05),地西泮组、酒五味子组、生五味子组小鼠NREM所占时间比显著升高(P<0.01或P<0.05)。结果见图2。
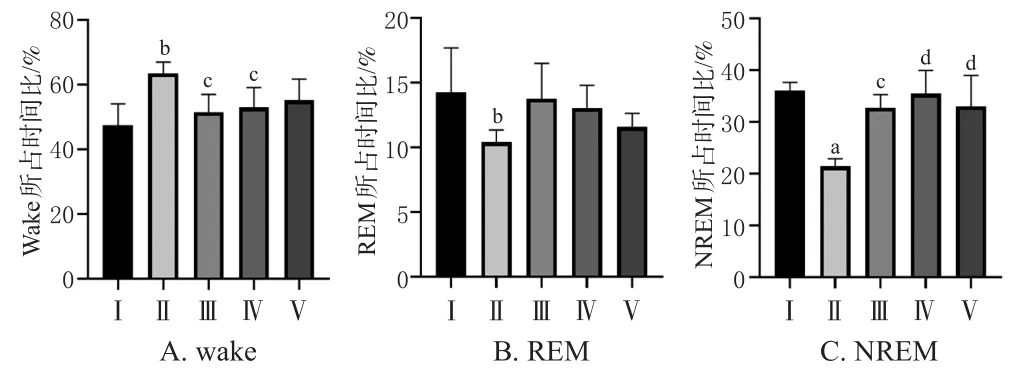
图2 各组小鼠睡眠时相的检测结果(±s,n=10)
3.4 生、酒五味子对小鼠脑SCN组织中神经递质含量的影响
与空白组比较,模型组小鼠脑SCN组织中5‑HT含量显著降低(P<0.05),NE、DA、CORT含量均显著升高(P<0.01)。与模型组比较,地西泮组和酒五味子小鼠脑SCN组织中GABA、5‑HT含量均显著升高(P<0.01或P<0.05),酒五味子组小鼠脑SCN组织中DA、CORT含量显著降低(P<0.01),生五味子组小鼠脑SCN组织中CORT含量显著降低(P<0.01);地西泮组小鼠脑SCN组织中DA、CORT、NE含量均显著降低(P<0.01)。结果见图3。
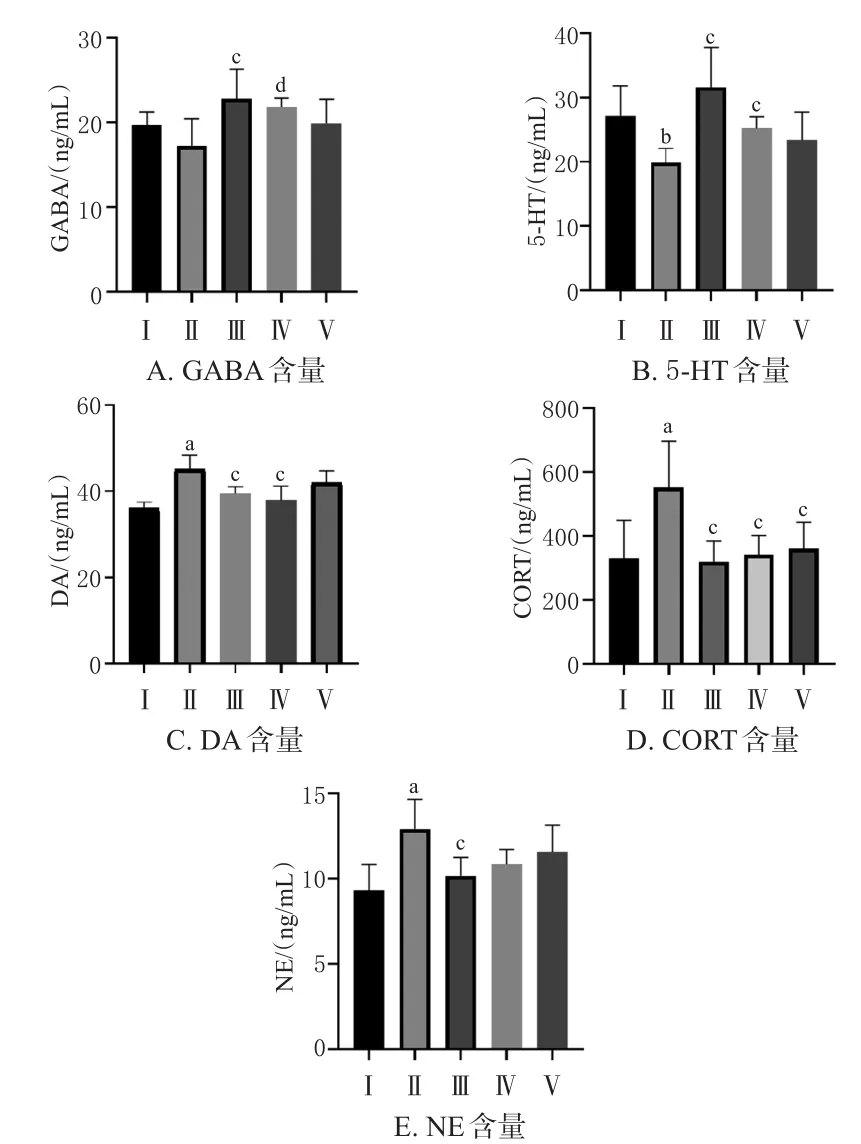
图3 各组小鼠脑SCN组织中神经递质含量的检测结果(±s,n=10)
3.5 生、酒五味子对小鼠脑SCN组织中IL‑1β、TNF‑α表达的影响
与空白组比较,模型组小鼠脑SCN组织中IL‑1β、TNF‑α的绿色荧光表达较强,荧光强度均显著升高(P<0.01)。与模型组比较,地西泮组、酒五味子组小鼠给药后绿色荧光表达减弱,荧光强度均显著降低(P<0.05或P<0.01)。结果见图4~图6。
图4 各组小鼠脑SCN组织中TNF‑α表达的显微图(免疫荧光,×400)
图5 各组小鼠脑SCN组织中IL‑1β表达的显微图(免疫荧光,×400)
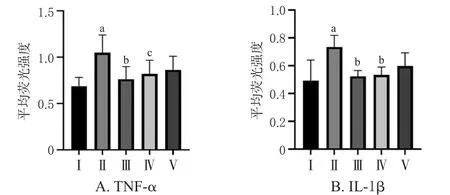
图6 各组小鼠脑SCN组织中TNF‑α、IL‑1β荧光强度结果(±s,n=10)
3.6 生、酒五味子对小鼠脑SCN组织中Bmal 11、Clock、Per2 2 mRNA表达的影响
与空白组比较,模型组小鼠脑SCN组织中Bmal1、ClockmRNA相对表达水平均显著升高(P<0.01),Per2mRNA相对表达水平显著下降(P<0.05)。与模型组比较,地西泮组和酒五味子组小鼠脑SCN组织中Bmal1、ClockmRNA相对表达水平均显著降低(P<0.05),地西泮组小鼠脑SCN组织中Per2mRNA相对表达水平均显著升高(P<0.01)。结果见图7。
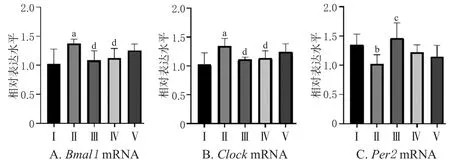
图7 各组小鼠脑 SCN 组织中 Bmal1 1、Clock、Per2 2 mRNA表达结果(±s,n=10)
4 讨论
五味子,又名山花椒、玄及、会及等,为中医临床常用中药材[14],《神农本草经》列其为上品,《医林纂要》中记载“宁神,除烦渴,止吐衄,安梦寐”。酒五味子为五味子经黄酒蒸制而成的炮制加工品,最早记载于宋代《圣济总录》,曰“用酒三升浸三日取出焙干”[15]。五味子酒制旨在借酒行药势,增强其滋肾功效,常用于心肾虚损、心悸失眠。
目前,大部分促睡眠药物的药效评价采用戊巴比妥钠翻正反射实验,其关键的判断指标为翻正反射消失,但手动翻正动物这一操作对实验数据有一定主观影响[16]。脑电图是评价睡眠效率的金指标。NREM和REM是睡眠时相中的2个重要阶段,这2类睡眠的数量决定了睡眠的质量[17]。本研究通过睡眠时相发现,模型组小鼠NREM和REM所占时间比显著减少,给予生、酒五味子治疗后,NREM和REM所占时间比显著增加。这表明生、酒五味子可通过增加NREM和REM所占时间比延长睡眠时间。
失眠,并非单一因素所致,涉及神经、免疫、内分泌等多种因素。神经、免疫、内分泌系统之间借助于神经递质、免疫细胞因子、内分泌激素等连接成一个复杂的网络体系,共同发挥抑制或促进睡眠的作用。失眠会显著引起神经‑内分泌系统的下丘脑‑垂体‑肾上腺(hypothalamic‑pituitary‑adrenal,HPA)轴变化[18],睡眠障碍与HPA轴过度活跃有关[19]。与睡眠主要相关的神经递质5‑HT可以直接支配下丘脑室旁核分泌促肾上腺皮质激素释放激素,影响HPA轴功能,GABA的增加则会抑制促肾上腺皮质激素释放激素的释放;此外,HPA轴上的促肾上腺皮质激素在DA和组胺浓度增加时,会促进其释放[20]。本实验结果显示,一方面,酒五味子可以显著提高失眠小鼠脑SCN组织中GABA、5‑HT的含量,降低DA、CORT含量。另一方面,经生、酒五味子治疗后,反映HPA轴兴奋程度的CORT含量显著降低,表明二者可通过降低CORT含量,负反馈调节HPA轴而促睡眠。综合来看,生、酒五味子的促睡眠作用与对神经‑内分泌系统的调控密不可分。同时,神经‑内分泌系统还受免疫系统的调控,通过免疫细胞产生的多种细胞因子和激素样物质反作用于神经‑内分泌系统,进而调控睡眠。参与该调控的细胞因子有六大类,其中TNF‑α、IL‑1β与睡眠调控紧密相关[10]。本实验结果显示,生、酒五味子均可降低小鼠脑SCN组织中TNF‑α和IL‑1β的表达,结合其对REM和NREM所占时间比的延长,提示生、酒五味子的促睡眠作用不仅涉及神经‑内分泌系统,还与免疫调节相关,其中潜在的神经‑内分泌‑免疫多靶点作用有待后续进一步探究。
此外,本实验还发现给予生、酒五味子后,位于下丘脑SCN的兴奋性调节基因Clock、Bmal1的mRNA相对表达水平显著下降,维持睡眠稳态的基因Per2的mRNA相对表达水平显著升高。有研究报道称,生物钟相关基因Clock、Bmal1可以引起神经兴奋性减弱,同时影响神经递质的释放,伴随多巴胺能神经元活性减少[21],导致睡眠时间延长。但生、酒五味子改善睡眠是否与生物钟有关及其具体机制,还有待后续进一步研究。
综上所述,生、酒五味子对失眠小鼠有一定的治疗效果,其机制可能与调控失眠小鼠神经‑内分泌‑免疫网络相关生物学指标有关。
