水稻种子活力性状全基因组关联分析研究进展
2023-03-17周嘉润沈玉婷孙曼嘉黄伟聪郑奕雄万小荣
杨 彬,周嘉润,沈玉婷,孙曼嘉,吕 凡,黄伟聪,郑奕雄,万小荣
(仲恺农业工程学院/广州市特色作物种质资源研究与利用重点实验室,广东广州 510225)
水稻直播栽培技术因其具有节省劳力、成本低和易于规模化等优点,近年来在我国得到大量的推广[1]。然而,直播稻生产上常面临种子发芽或成苗不整齐、幼苗长势差等问题,严重影响了水稻产量和品质[2]。种子是农业最基本也是最关键的生产资料,高质量种子对于保障粮食生产尤为重要[1]。种子活力是评鉴种子质量的重要指标之一[1-2]。种子活力是指种子在田间条件下具备快速萌发、整齐发芽及发育成健壮幼苗的潜力[3-4]。水稻直播栽培技术对种子活力这一重要播种性状具有较高的要求,需要选用在不同胁迫条件下仍具有高种子活力的水稻品种[5]。因此,挖掘种子活力相关基因并解析其遗传调控机制,对今后选育适合直播的高活力水稻品种具有重要意义。
1 水稻种子活力的衡量指标
通过查阅相关文献,水稻种子活力常用的评价标准包括种子萌发期相关性状、幼苗早期生长相关性状、逆境抗性相关性状及生理生化相关性状等4类。研究人员通过鉴定得以上指标,基于连锁分析的方法鉴定到大量的水稻种子活力相关数量性状基因座(quantitative trait loci,QTLs)。
1.1 种子萌发期相关性状
种子萌发期相关性状包括发芽率、发芽指数、活力指数、成苗率、胚根长及胚芽长等。例如,Wang等以粳稻大关稻、籼稻IR28及其构建的150个重组自交系(recombinant inbred lines,RILs)为试验材料,通过鉴定萌发3 d的发芽率和发芽指数等指标,定位到10个种子活力相关QTLs[6];Liu等以粳稻韭菜青、籼稻IR26及其构建的150个RILs为试验材料,分别在不同发育阶段(抽穗后38、42 d)收获种子,并鉴定种子在3 d的发芽率和发芽指数等指标,定位到33个种子活力相关QTLs[7];Xie等以籼稻珍汕97、明恢63及其构建的120个RILs为试验材料,通过鉴定萌发2 d和3 d的胚根长和胚芽长等指标,定位到8个种子活力相关QTLs[8];Dimaano等以杂草稻WTR-1、籼稻Y-134及其构建的167个BC1F5群体为试验材料,通过调查萌发2 d和7 d的发芽率等指标,定位到43个种子活力相关QTLs[9]。
1.2 幼苗早期生长相关性状
幼苗早期生长相关性状包括芽长、根长、苗长(高)、胚芽鞘长、中胚轴长、芽鲜/干质量、根鲜/干质量及苗鲜/干质量等。例如,Abe等以粳稻Kakehashi、Dunghan Shali及其构建的250个RILs为试验材料,通过考察萌发14 d的苗高,检测到4个幼苗活力相关QTLs[10];Zhang等以籼稻93-11、PA64s及其构建的132个RILs为试验材料,通过鉴定萌发15 d的芽长、根长、苗鲜质量和苗干质量等指标,定位到65个幼苗活力相关QTLs[11];Singh等以籼稻Swarna、粳稻Moroberekan及其342个回交3代子3代(BC3F4)为试验材料,通过鉴定8 d和20 d的苗高、根长、根鲜质量和芽鲜质量等指标,检测到6个幼苗活力相关QTLs[12];Xu等以籼稻CG133R、粳稻Javanica22及其构建的166个RILs为试验材料,通过鉴定萌发5、10、15、20、25 d的苗高、根长、根鲜质量和芽鲜质量等指标,对多个幼苗活力连锁的分子标记进行表型验证与位点组合分析[13]。
1.3 逆境抗性相关性状
逆境抗性相关性状包括逆境条件下种子萌发期相关性状、幼苗早期生长相关性状及成活率等。例如,Wang等以粳稻韭菜青、籼稻IR26及其构建的150个RILs为试验材料,通过鉴定盐胁迫条件下 5 d 和10 d的发芽率等指标,定位到16个萌发期耐盐相关QTLs[14];Liu等利用籼稻GC2、粳稻IL112及其构建的F2∶3群体,通过鉴定低温胁迫条件下幼苗的成活率,检测到7个幼苗耐冷相关QTLs[15];Jiang等以粳稻沈农625、丽江新团黑谷及其构建的144个RILs为试验材料,通过鉴定低温胁迫条件下6 d的发芽率,检测到11个低温发芽相关QTLs[16];Najeeb等以杂草稻WTR-1、毫安弄及其构建的230个近交系(introgression lines,ILs)为试验材料,通过鉴定低温胁迫条件下2、4、6 d的发芽率及10、13、16 d 的根长和芽长等指标,定位到27个低温发芽相关QTLs[17];Jahan等以籼稻Basmati、Pokkali及其构建的129个F3为试验材料,通过鉴定铝胁迫条件下发芽率、发芽指数、根长、芽长及活力指数等指标,检测到46个萌发期和幼苗期耐铝相关QTLs[18]。
1.4 生理生化相关性状
生理生化相关性状包括α-淀粉酶活性、还原糖含量、根系活力和叶绿素含量等。例如,Cui等以籼稻珍汕97、明恢63及其构建的241个RILs为试验材料,通过测定α-淀粉酶活性、还原糖含量和根系活力等指标,定位到14个幼苗活力相关QTLs[19];同时,崔克辉等利用上述同一套材料测定了叶绿素a含量和总叶绿素含量,定位到3个幼苗活力相关QTLs[20]。
2 GWAS研究概述
全基因组关联分析(genome-wide association study,GWAS)是近些年用于解析动植物复杂数量性状的一种常见方法。GWAS是基于海量的单核苷酸多态性(single-nucleotide polymorphisms,SNPs)标记,以连锁不平衡(linkage disequilibrium,LD)为基础,在全基因组范围内系统地研究群体特定性状与SNPs之间关联的手段[21]。
2.1 GWAS研究的优点
相较于传统的连锁分析,GWAS具有诸多优势[22-23]。第一,连锁定位需要通过双亲进行多代杂交构建出分离群体,研究的时间和人力成本高,而GWAS所利用的自然变异群体,研究周期大幅度降低;第二,连锁定位所用的分子标记在全基因组范围内密度小、分辨率低,初定位检测出的QTLs区间较大,而基于高密度SNPs的GWAS能快速实现精细定位;第三,连锁分析只能检测到每个基因座上最多的2个等位变异类型,而GWAS能鉴定到群体内同一位点上所有的等位变异类型[24]。
2.2 GWAS研究的技术路线
GWAS研究的流程一般包括下述6个步骤[25]。(1)关联群体种质资源收集:选择的群体需具备一定的数量,具有广泛的遗传多样性,这对后续的关联位点检测至关重要;(2)关联群体SNPs分型:SNPs是在动植物基因组上广泛存在的遗传变异,是GWAS研究中最常使用的分子标记,一般利用基因芯片技术和重测序技术对关联群体SNPs进行分型;(3)群体结构及亲缘关系评价:由于关联群体内可能含有多个亚群,亚群间的等位基因型频率存在差异,可能会导致后续的GWAS出现假阳性位点,通过群体结构及亲缘关系分析可降低假阳性率;(4)GWAS:结合基因型数据和表型数据,选择合适的关联分析模型,如一般线性模型(general linear model,GLM)、混合线性模型(mixed linear model,MLM)等进行GWAS,检测显著关联位点;(5)显著关联位点的候选基因筛选:根据LD衰减距离,划定显著关联位点的候选基因所在基因组区域,进一步利用基因注释、同源基因分析、转录组学相关表达谱数据和单倍型分析筛选获得关键候选基因;(6)基因功能验证:利用构建的基因过表达转基因株系、基因干涉转基因株系、基因点突变株系和差异单倍型转基因回补株系对关键候选基因进行功能验证。
3 水稻种子活力GWAS研究进展
近年来,随着基因组测序技术的更新迭代,测序成本逐渐降低,GWAS广泛应用于解析水稻表型多样性遗传变异基础。目前,GWAS已在水稻种子活力相关基因的挖掘方面取得一定的研究进展。
3.1 种子萌发期相关性状和幼苗早期生长相关性状GWAS
Wang等通过鉴定307个水稻品种第14天的侧根数、根长和芽长等性状,利用GWAS检测到6个显著关联位点,并通过基因表达分析和测序比较分析对位于11号染色体上的位点qTIPS-11进行候选基因筛选,明确1个编码糖基水解酶的基因为该位点的关键候选基因,命名为Tips-11-9;进一步利用转移DNA(T-DNA)插入突变体进行验证,发现Tips-11-9突变体的根系活力显著低于野生型[26]。Guo等通过鉴定200个水稻品种萌发2 d的发芽率及7 d的发芽率、发芽指数及活力指数等性状,利用GWAS检测到19个显著关联位点,其中有6个位点与前人报道的种子活力相关QTLs共定位;此外该研究以粳稻02428和籼稻YZX构建的192个RILs为试验材料,通过鉴定上述4个性状,利用连锁分析定位到12个QTLs,其中有7个位点与前人报道的种子活力相关QTLs共定位;比较发现,有6个位点在GWAS和连锁分析共定位;结合种子萌发期转录组数据,进一步筛选获得7个关键候选基因Os06g0108600、Os06g0110200、Os06g0253100、Os06g0282000、Os07g0583600、Os07g0592600和Os09g0432300[27]。Zhao等通过对178个水稻品种的根长进行表型鉴定,利用GWAS在3、6、7、11号染色体上检测得到qRL3、qRL6、qRL7和qRL11等4个位点,其中有2个位点与前人报道的根系活力相关QTLs共定位;通过转录组分析、单倍型分析及基因表达分析进一步对其中一个主效位点qRL11进行候选基因筛选,确定1个编码吲哚乙酸糖基转移酶的基因(OsIAGLU)为该位点的关键候选基因;基因功能分析研究发现,OsIAGLU通过调控生长素、茉莉酸、脱落酸和细胞分裂素等多种激素水平来控制水稻根系生长[28]。Li等通过对174个水稻品种3 d的发芽率进行鉴定,利用GWAS在3、8、11号染色体上检测到qGR3.1、qGR3.2、qGR8和qGR11等4个位点,这些位点均与前人报道的种子活力相关QTLs共定位;通过转录组分析和单倍型分析进一步对其中一个主效位点qGR11进行候选基因筛选,确定1个编码2-酮戊二酸/苹果酸转运蛋白的基因(OsOMT)为该位点的关键候选基因;基因功能分析研究发现,OsOMT通过调控氨基酸水平、糖酵解代谢和三羧酸(TCA)循环来控制水稻种子活力[29]。Menard等通过检测684个水稻品种在室内环境下 5 d 的芽长、根长、根表面积、中胚轴长和胚芽鞘长和在田间环境下不同播种深度(4、8、10 cm)下30 d的中胚轴长、幼苗出苗率、地上部干质量、根干质量和侧根数等活力相关性状,利用GWAS检测到超过 1 000 个显著关联的SNPs;比较发现,在7号染色体的短臂上存在1个主效位点,该位点在中胚轴长、出苗率和地上部干质量等3个性状中共定位[30]。Yuan等通过对贮藏不同时间的252个水稻品种的发芽率进行鉴定,利用GWAS在1号和9号染色体上检测到3个显著关联位点,同时结合粳稻日本晴和籼稻9311构建的染色体片段置换系对位于1号染色体上的位点进行精细定位,确定该位点的候选基因为OsGH3-2,该基因编码1个吲哚乙酸氨基化合成酶;基因功能研究发现,该基因通过调控脱落酸通路和胚胎晚期富集蛋白来控制水稻种子老化[31]。Yang等在2年环境下通过对263个水稻品种萌发3、5、7 d 的发芽率和发芽指数进行表型分析,利用GWAS定位到19个种子萌发相关QTLs,其中有14个QTLs与前人报道的种子活力相关QTLs共定位,有11个QTLs位于选择消除区域;利用种子萌发期转录组和功能SNPs位点分析进一步对其中一个稳定表达的位点qSG11.1进行候选基因筛选,确定1个编码丙酮酸激酶基因OsPK5为该位点的关键候选基因;基因功能分析研究发现,OsPK5通过参与调节赤霉素、脱落酸及糖酵解代谢等通路来控制水稻种子萌发[32]。Peng等通过对202个水稻品种的成苗率进行鉴定,利用GWAS检测1个位于3号染色体的显著关联位点qSP3,该位点的峰值SNP位于一个编码含Cupin结构域蛋白基因OsCDP3.10的编码区内;基因功能研究发现,该基因通过影响甲硫氨酸、谷氨酸、组氨酸和酪氨酸等氨基酸水平及过氧化氢含量来调控种子活力[33]。Sun等鉴定了510个水稻品种的中胚轴长度,利用GWAS在5号染色体上检测到1个与中胚轴长度显著关联的位点,并在峰值SNP附近发现1个参与油菜素内酯信号通路的基因OsGSK3,该基因编码1个类 GSK3/SHAGGY 蛋白激酶;基因自然变异分析发现,OsGSK3基因编码区的错义SNP与OsGSK3激酶活性存在关联;分子试验证明了油菜素内酯通过抑制OsGSK3对细胞周期蛋白CYC U2的磷酸化来促进水稻中胚轴的伸长,而独脚金内酯信号通路相关基因SLs/D3通过降解磷酸化的CYC U2来抑制中胚轴的伸长[34]。
3.2 种子萌发期和成苗期逆境抗性相关性状GWAS
Wang等通过对137个水稻品种的低温发芽力进行鉴定,利用GWAS分别在10号和11号染色体上获得48、55个低温发芽候选基因;进一步通过基因注释、序列比较分析和单倍型分析证实了2个关键候选基因(Os10g0371100和Os11g0104240)可能与低温发芽力相关联[35]。Wang等通过对187个水稻品种的低温发芽力进行鉴定,利用GWAS共检测到53个低温发芽相关QTLs,其中有20个QTLs 与前人报道的位点共定位;进一步对一个编码A20/AN1型锌指蛋白(胁迫相关蛋白)的候选基因OsSAP16进行功能验证发现,在低温环境下该基因功能的缺失降低了水稻种子的萌发,而过量表达则增强了种子的萌发;基因表达分析发现,极端材料中OsSAP16的表达水平在低温条件下存在显著差异[36]。Yang等对375个水稻品种的低温发芽力进行鉴定,利用GWAS共检测到11个低温发芽相关QTLs;与前人报道的QTLs比较发现,有3个新的基因(QTLsqLTG_sRDP2-3/qLTG_JAP-3、qLTG_AUS-3和qLTG_sRDP2-12)在该研究中首次报道;位于10号染色体的QTLqLTG_sRDP2-10a贡献率最高,并利用单片段代换系验证了该QTLs的真实性;进一步通过基因表达分析和序列比对分析,预测了LOC_Os10g22520和LOC_Os10g22484可能为低温发芽主效QTLqLTG_sRDP2-10a的关键候选基因[37]。Yang等对200个籼稻品种的低温发芽力进行鉴定,利用GWAS共检测到159个与低温发芽显著关联的位点,分布在水稻12条染色体上;比较发现,有23个位点在不同环境下稳定表达,并预测到了569个与低温发芽相关的候选基因,结合转录组测序分析筛选获得179个关键候选基因;进一步利用20个极端材料对其中一个显著关联位点的序列分析发现,3个差异表达基因Os07g0585500、Os07g0585700和Os07g0585900的自然变异和低温发芽表型相关联[38]。Wang等对339个水稻品种芽期耐冷性状进行鉴定,利用GWAS检测到4个与芽期耐冷相关的显著关联位点,分布在水稻1、2、3号染色体上,其中qCTB-1-1与调控耐冷性状miRNAOsa-miR319b共定位,而其他3个位点为新位点;进一步在qCTB-1-2位点筛选得到1个候选基因OsRab11C1,该基因编码1个Rab蛋白;转基因验证发现,与野生型比较,突变OsRab11C1基因可以显著提高水稻芽期耐冷性,而过表达OsRab11C1则显著降低了芽期耐冷性;基因功能分析发现,OsRab11C1可能通过抑制脱落酸信号通路和脯氨酸合成来调控水稻芽期耐冷性[39]。Su等在无氧环境下对209个水稻品种的胚芽鞘长度和胚芽鞘直径进行鉴定,利用GWAS检测到26个显著关联的SNPs位点,其中5个位点与前人报道的位点共定位;进一步利用转录组测序技术筛选获得4个关键候选基因,分别是Os01g0911700(OsVP1)、Os05g0560900(OsGA2ox8)、Os05g0562200(OsDi19-1)和Os06g0548200[40]。Shi等在盐胁迫下对478个水稻品种的萌发期胁迫敏感指数进行鉴定,利用GWAS检测到包含22个显著SNPs的11个位点,其中位于1、5、6、11、12号染色体上的7个位点与前人报道的胁迫相关位点或基因共定位,例如高亲和性硝酸盐转运蛋白OsNAR2.1和OsNRT2.2;单倍型分析鉴定到了OsNRT2.2稀有优异单倍型,且发现了该基因在水稻亚群存在分化[41]。Castano-Duque 等在旱季和雨季环境下分别对 1 500、2 700个水稻品种在无氧条件下的发芽率进行鉴定,利用GWAS鉴定到1个候选基因CLASSY1(OsCLSY1),该基因参与了RNA介导的DNA甲基化途径;在淹水条件下,突变体clsy1的苗高显著高于野生型,表明在水稻发芽和幼苗建成阶段,RNA介导的DNA甲基化途径在响应淹水胁迫中至关重要[42]。
基于GWAS鉴定的水稻种子活力相关基因详见表1。
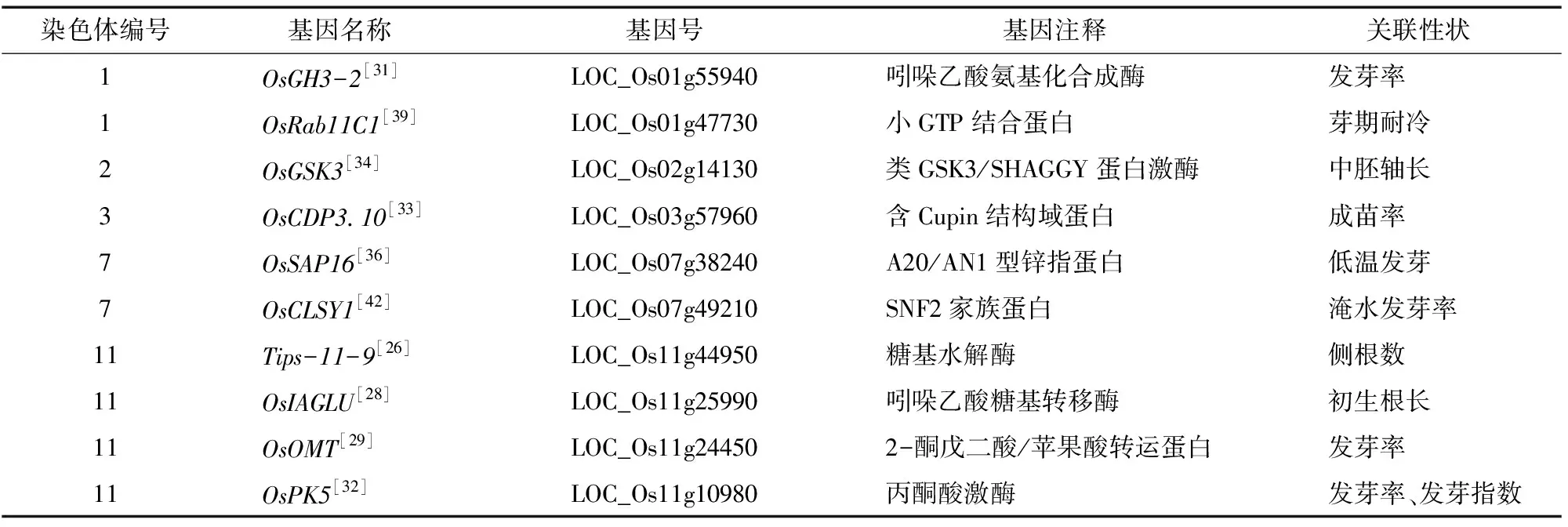
表1 基于GWAS鉴定的水稻种子活力相关基因
4 研究展望
尽管现阶段利用GWAS解析水稻种子活力相关性状的自然变异取得了一定的进展,但还存在一定的局限性。第一,种子活力性状受环境影响较大,很多研究并未在多年多个环境下进行种子活力检测;第二,GWAS研究中获得的位点可能出现假阳性,并未用其他技术手段对获得的位点进行辅助验证,比如可构建双亲群体进行连锁分析,结合GWAS鉴定关键位点;第三,遗传验证缺少证据,GWAS研究中对候选基因进行验证往往构建基因突变体株系、基因过量表达转基因株系和基因干扰转基因株系等,而未对差异单倍型进行遗传回补验证。
高活力的种子具有更高的生产潜力及生长优势,对保障粮食高产、稳产和优质生产具有重要意义。因此,科研人员需要在现有基础上进一步开展高活力水稻种质资源收集与鉴定、高活力优异等位变异挖掘与育种利用、种子活力相关基因定位及种子活力相关基因不同等位变异的功能解析,以期为未来培育高活力水稻新品种提供重要基础。
