酵母表达系统制备的猪圆环亚单位疫苗效果评估
2023-03-16段进坤陈爽刘涛赵玉龙
段进坤,陈爽,刘涛,赵玉龙*
(1.天津瑞普生物技术股份有限公司 天津 300308;2.瑞普(保定)生物药业有限公司 河北保定 071000;3.河北省兽用生物制品技术创新中心 河北保定 071000)
猪圆环病毒是目前已知的最小动物病毒之一,基因组大小仅约1.7kb,属于圆环病毒科,圆环病毒属,单股环状DNA 病毒[1]。PCV目前可分为3 个基因型:PCV1、PCV2 和PCV3。其中PCV1 不具有致病性,广泛存在于猪源细胞培养物中;PCV3 是最近刚在美国发现的一种新的基因型,可引起心脏和多系统炎症;PCV2 致病性最强,是引起断奶仔猪多系统衰竭综合症(PMWS)等一系列圆环病毒病(PCVD)的病原[2],每年给全球养猪业带来巨大的经济损失。
接种疫苗预防PCV2 发生是防控疾病的有效方法。PCV2 商品化疫苗主要包括全病毒和PCV1-2 嵌合病毒灭活疫苗和Cap 亚单位疫苗[3]。PCV2 病毒较难培养,主要在PK15 细胞系中感染扩增,病毒滴度低,培养成本高[4],全病毒灭活疫苗常存在病毒含量偏低,免疫效果不尽理想。而通过现代生物学技术体外表达cap 蛋白,可在短时间内获得大量、廉价的cap 蛋白。不同于一般的亚单位疫苗,体外表达的PCV2 cap 蛋白可自我组装成类病毒颗粒(VLPs),免疫原性强,生物安全性高,免疫效果要优于全病毒灭活疫苗。PCV2 cap 蛋白已经在多种表达系统中成功表达,如昆虫-杆状病毒、哺乳动物细胞、大肠杆菌、酵母菌、乳酸菌等[5-9]。其中,利用马克斯克鲁维酵母(kluyveromyces marxianus,KM)系统的表达水平最高,可高达2g/L[10]。
酵母表达系统因其表达水平高,易培养,外源蛋白活性高,无内毒素残留等优势,在生物医药和酶制剂等领域被广泛使用。马克斯克鲁维酵母是一种安全、可食用的酵母,已得到欧盟和美国FDA的食品安全认证,中国卫生计生委批准了马克斯克鲁维酵母作为新食品原料。马克斯克鲁维酵母还具有生长快速、耐温、碳源利用谱系广,分泌表达能力强、外源蛋白表达量高等优点。因此,马克斯克鲁维酵母在基因工程疫苗、工业酶等外源蛋白的制备方面具有良好的工业应用潜力。
1 材料与方法
1.1 主要实验材料及实验动物
表达PCV2 cap 的重组马克斯克鲁维酵母(KM-PCV2)由复旦大学提供;配制圆环疫苗所需的IMS1313 佐剂购自SEPPIC 公司;圆环竞品疫苗为某进口圆环疫苗产品;14~20 日龄PCV2 抗原和抗体双阴性仔猪购自秦皇岛某猪场;猪圆环病毒2-dCap-ELISA 抗体检测试剂盒购自北京金诺百泰生物技术有限公司。
1.2 KM-PCV2 重组酵母菌高密度发酵
挑取KM-PCV2 新鲜克隆,接种于200mL YD 培养基中。30℃,220rpm 培养18~24h,制备一级种子。一级种子按照1:10 的稀释比例接种到2L 含有葡萄糖、硫酸铵、磷酸二氢钾和硫酸镁等成份的合成培养基中,30℃,220rpm 培养16~18h,制备二级种子。二级种子按1:20 比例接种到含30L 底料的100L 发酵罐中进行发酵,发酵过程中通风并搅拌,补料采用全料流加方式,溶解氧控制在20%~30%,控制温度在30℃,pH 值在5.5 左右,每隔6h 取样测定菌体密度,发酵时间为60h。
1.3 KM-PCV2 重组cap 蛋白纯化
发酵液离心后收集菌体,先用PBS 重悬清洗两遍,然后用结合缓冲液(20mM 磷酸钠、100mM 氯化钠、0.01%吐温80;pH 6.8)重悬菌体至100 OD600,使用低温高压均质机破菌(1,800br,2 次)。破菌液经12,000rpm 转速离心30min,收集上清。加入等体积的结合缓冲液后将pH 值调节至6.8,用于后期纯化。
取100mL 阳离子交换树脂填充到层析柱中,先用超纯水冲洗1h,然后用结合缓冲液冲洗10 倍柱体积。取400mL 制备好的上样液按10mL/min 的流速上样。上样结束后先用结合缓冲液冲洗约3倍柱体积,然后用120mL 洗脱缓冲液洗脱(含1M 氯化钠的结合缓冲液)目的蛋白。洗脱液经300kD 膜包超滤置换后保存于4℃冰箱,用于下一步配苗。
1.4 PCV2 亚单位疫苗配制
先用生理盐水将PCV2 cap 蛋白溶液稀释至120μg/mL,然后按1:1 体积比加入IMS1313 佐剂,混合均匀。
1.5 仔猪免疫实验
从养殖场筛选3~4 周龄圆环抗原抗体双阴性健康仔猪15 头,平均为分为3 组。第一组为对照组,不免疫;第二组为商品疫苗免疫组,颈部肌肉注射1mL 竞品圆环疫苗;第三组为实验组,颈部肌肉注射1mL 酵母源圆环疫苗。免疫后2 周、3 周、4 周和5 周采血分离血清,使用商品化ELISA 试剂盒检测PCV2 抗体效价。
2 结果
2.1 KM-PCV2 高密度发酵
采用无机盐合成培养基进行重组酵母菌的高密度发酵,60h 菌体浓度可达到500g/L。发酵过程中菌体的生产情况见图1。
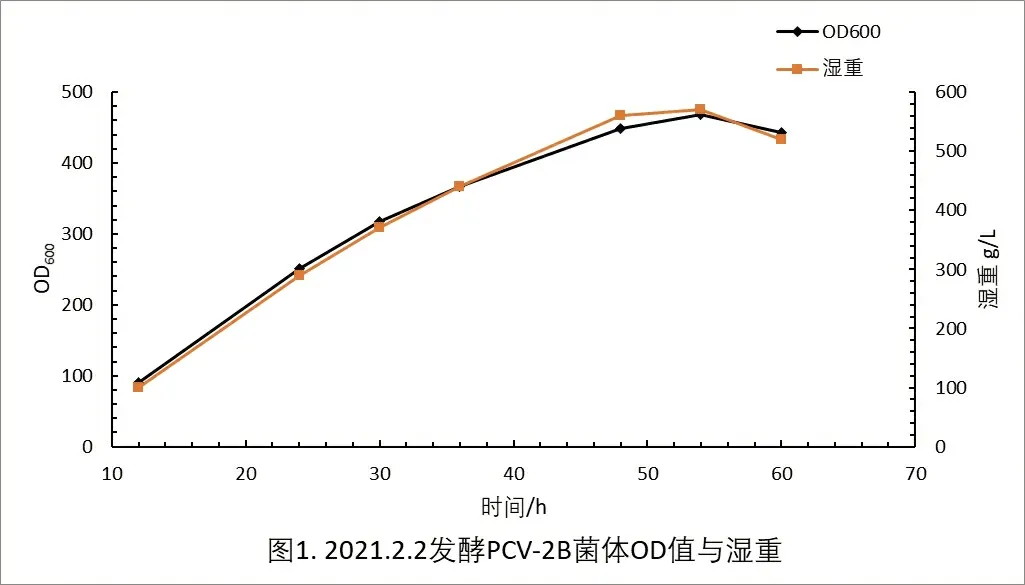
图1 KM-PCV2 重组酵母菌高密度发酵
2.2 PCV2 cap 蛋白纯化
重组酵母发酵液经破菌,离心,层析,超滤等纯化流程后,得到高纯度的圆环蛋白溶液,蛋白纯度达到95%以上(图2)。通过电镜观察,纯化的PCV2 cap 蛋白能高效组装成病毒样颗粒(图3)。
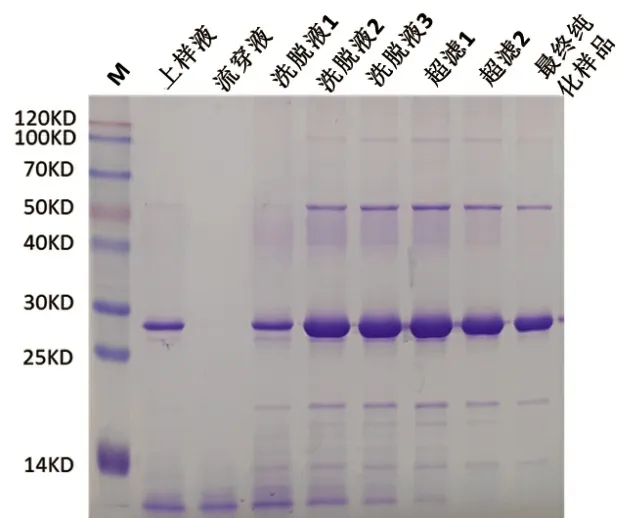
图2 PCV2 cap 蛋白纯化
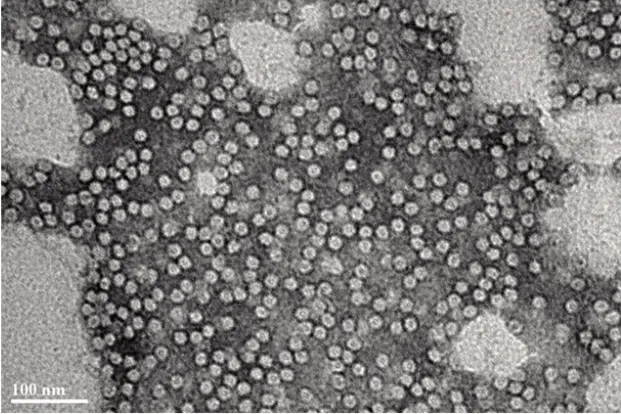
图3 VLP 电镜观察
2.3 仔猪免疫实验
免疫3~4 周龄的圆环抗原抗体双阴性仔猪,免疫后的2~5 周,血清中特异性的圆环抗体滴度逐渐升高,且酵母源圆环疫苗的抗体水平要高于竞品圆环疫苗组(图4)。
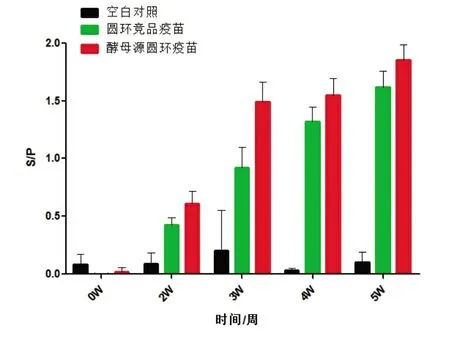
图4 免疫仔猪血清中的圆环抗体检测
3 讨论
圆环亚单位疫苗出色的免疫保护效果已经得到了市场的充分验证,但现有的圆环cap 蛋白主要是由昆虫-杆状病毒系统表达制备,因生产成本高、蛋白表达水平低、生产过程繁琐等因素限制,无法大规模推广应用。应用我国自主知识产权的KM 酵母表达系统表达PCV2 cap 蛋白,蛋白表达水平高于昆虫-杆状系统近20 倍,且生产工艺简单,生产成本低。
由KM 酵母表达的PCV2 cap 蛋白可自我组装成病毒样颗粒,前期研究已验证了KM 酵母源PCV2 亚单位疫苗能在小鼠中刺激产生高水平的血清IgG 抗体,攻毒后能显著降低脾脏和肺脏中的病毒含量。在此研究中,我们在仔猪上验证了疫苗的免疫效果。说明KM 酵母源PCV2 亚单位疫苗是一款安全、有效且成本可控的良好动物疫苗。
酵母细胞壁较厚且坚硬,不易破碎。现有工艺利用高压均质机破碎酵母,效率不高,且破菌过程中会产生大量的微小颗粒,造成样品浊度高,不利于后期澄清及纯化。因此后期需要对菌体裂解工艺进行深入研究,或对重组酵母菌进行遗传改造,实现外源蛋白的高效分泌表达。
