制备条件对CuFe双金属催化剂混合醇合成的影响
2023-03-15钱炜鑫马宏方张海涛应卫勇
钱炜鑫,田 婧,黄 乐,马宏方,张海涛,应卫勇
(华东理工大学 化工学院 大型工业反应器工程教育部工程研究中心 化学工程联合国家重点实验室,上海 200237)
Fischer-Tropsch反应是将煤气化或生物质气化产生的合成气(CO+H2)转化为不同碳数的液体清洁燃料的过程[1-3],产物包括不同碳链长度的烃类、醇类及少量的酸、酯等。其中,C2+混合醇相对于同碳数的烃类具有更高的经济附加值,是重要的化工基础原料。适量提高C2+混合醇的选择性对于改善Fischer-Tropsch工艺的经济性及实现工业化具有重要意义[4-5]。为提高C2+混合醇选择性,需要对传统的Fischer-Tropsch合成催化剂进行改性[6-8],其中较为有效的是对Fe基催化剂进行Cu改性[9-11],以促进Fischer-Tropsch合成反应过程中醇类的生成。Cu,Fe双活性位的形成及协同作用,一方面有助于碳链的增长,另一方面也对含氧化合物尤其是醇类的生成产生促进作用,可有效提高C2+混合醇的选择性[12]。对于负载型CuFe双金属催化剂而言,要促进CuFe双活性位的形成,需使其在载体表面形成有序排布,并高度分散,这与催化剂制备过程及制备条件紧密相关。通过液相还原法制备CuFe双金属催化剂,硝酸盐中的金属离子被强还原剂在液相环境中还原为金属单质颗粒,并负载于多孔载体表面,液相分散剂的种类及用量会很大程度上影响载体表面活性金属颗粒的分散和排布,孔道结构及表面性质也会发生改变,从而影响催化剂反应活性及产物分布[13]。
本工作采用液相还原法制备了CuFe双金属催化剂,并对制备温度、分散剂用量、分散剂种类及pH等制备条件对催化剂反应性能的影响进行了研究。结合XRD、低温Ar吸附-脱附和H2-TPR等表征方法,对不同制备条件下所得到的催化剂孔道结构、还原性能、晶相形态及反应性能进行了探讨,获得了催化剂结构及反应性能间的构-效关系,优化了制备条件。
1 实验部分
1.1 主要试剂及原料
载体CeO2:棒状,宽约12 nm,长约150~200 nm,实验室自制;Cu(NO3)2·3H2O、Fe(NO3)3·9H2O、乙二醇(EG)、聚丙烯酸(PAA):分析纯,上海麦克林生化科技有限公司;无水乙醇、还原剂(硼氢化钠):分析纯,上海泰坦科技股份有限公司。合成气:63.4%(φ)H2,31.6%(φ)CO,5.0%(φ)N2,液化空气有限公司。
1.2 催化剂的制备
采用液相还原法,在液相环境中通过还原剂作用将金属盐离子还原为金属单质并负载于颗粒载体上。其中,载体CeO2采用水热反应法合成[14-16],为棒状载体。在1.5 L三口烧瓶中加入300 mL的液相分散剂,并置于冰水浴(0 ℃)中,加入2 g载体,开启磁力搅拌使载体在液相中均匀分散。加入一定量的 Cu(NO3)2·3H2O 和 Fe(NO3)3·9H2O配制硝酸盐溶液,n(Cu)∶n(Fe)=3∶1。通入N2置换装置中的O2,并持续搅拌1 h。将一定量的还原剂溶解在去离子水中,并缓慢、匀速滴加到上述硝酸盐溶液中,同时持续通入N2,继续搅拌1 h。待滴加完毕后,硝酸盐中的Cu,Fe金属离子同时被还原为单质,并在载体上负载,形成黑色的悬浮液。采用离心分离并用去离子水和无水乙醇反复洗涤至分离后的清液pH接近中性,得到催化剂前体。将上述催化剂前体置于卧式管式炉中,调节温度至100 ℃,并通入N2,干燥8 h后切换温度至400 ℃,N2气氛下焙烧4 h。持续通入N2,冷却催化剂至30 ℃后,切断N2并缓慢通入1%(φ)O2+99%(φ)Ar的钝化气对催化剂表面进行钝化处理,持续5 h以上,得到负载型CuFe双金属纳米催化剂[14,17-18]。
不同制备条件下CuFe催化剂的制备,只需在制备过程改变相应条件即可,其他条件不变。其中,催化剂试样CuFe-300和CuFe-RT分别为分散剂(EG)添加量为300 mL,制备温度为冰水浴和室温条件下制备的催化剂;催化剂试样CuFe-150为EG添加量150 mL,制备温度为冰水浴条件下制得;催化剂试样CuFe-EG为以EG为液相分散剂制得;催化剂试样CuFe-PAA-5为以300 mL EG+5 g PAA为分散剂制得;催化剂试样CuFe-PAA-10为以300 mL EG+10 g PAA溶液为分散剂制得;催化剂试样CuFe-PAA-5N为以300 mL EG+5 g PAA溶液为分散剂且pH控制在约9.0的条件下制备;催化剂试样CuFe-PAA为以5 g PAA+300 mL去离子水为分散剂制得。上述各催化剂试样的载体均为CeO2。
1.3 催化剂的表征
D/Max 2550型X射线衍射仪:日本理学公司;ASAP 2020型低温Ar吸附-脱附分析仪:Micrometeritics公司;AutoChemⅡ 2920型化学吸附仪:Micrometeritics公司,TCD检测;Agilent 725ES型电感耦合等离子体原子发射(ICP-AES)光谱仪:Agilent公司。
1.4 催化剂反应性能测试
催化剂反应性能测试在内径为12 mm的固定床反应器(φ16 mm×2 mm×560 mm,北京欣航盾仪器有限公司)中进行。采用合成气对催化剂进行还原,还原条件为:350 ℃,常压,3 600 mL/(g·h),V(H2)∶V(CO)=2。还原结束后,催化剂在合成气气氛下降温至200 ℃后调节至所需反应温度。合成气经净化器脱除其中少量的O2及羰基化合物后进入反应管参与反应,反应条件为:260 ℃,3.0 MPa,3 600 mL/(g·h),V(H2)∶V(CO)=2。生成的产物及未反应物经热阱和冷阱分别冷却其中的高沸点和低沸点产物后,未冷凝尾气进入Agilent公司Agilent 7890A型气相色谱仪进行在线检测,其中CO,CO2,H2,N2,CH4等惰性组分通过5A分子筛填充柱及HP ProPack Q型毛细管柱分离,TCD检测,烃类产物通过HP-AL/S型毛细管柱分离,FID检测。冷阱中的产物经静置后分离成油相和水相,热阱中的高沸点组分溶于CS2中,和油相产物均通过另一台同型号气相色谱仪进行分析,DB-1型毛细管柱,FID检测,面积归一化法;水相通过DB-WAX型毛细管柱分离,FID检测,外标法。
2 结果与讨论
2.1 制备温度及分散剂用量的影响
表1为催化剂的低温Ar吸附-脱附及ICPAES表征结果。
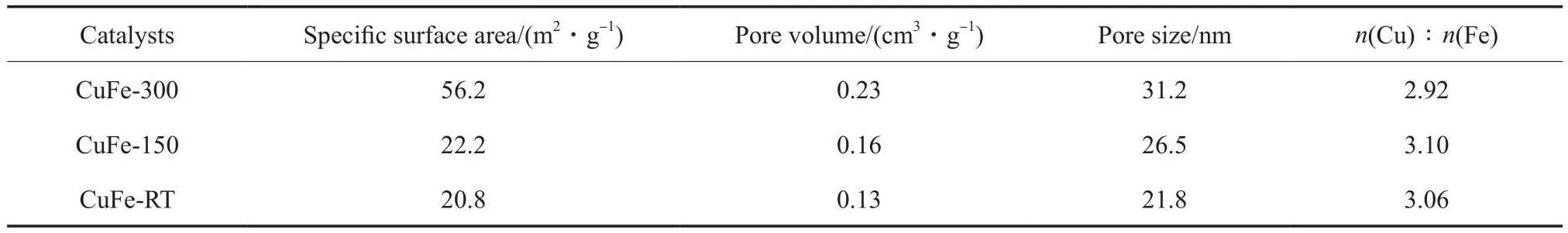
表1 CuFe双金属催化剂的织构特性及ICP-AES表征结果Table 1 Texture properties of CuFe catalysts and characterization results by ICP-AES
由表1可知,在冰水浴和EG用量300 mL的条件下,CuFe双金属催化剂拥有最大的比表面积(56.2 m2/g),且孔体积和孔径较大。当制备温度改为室温、分散剂用量减少为150 mL时,CuFe催化剂的比表面积明显减小,表明制备温度和分散剂用量对催化剂颗粒的分散性产生了影响。氧化铁及氧化铜的液相还原过程为放热反应,反应热的移除及较低的制备温度有助于还原过程的发生,但不利于颗粒的生长,使催化剂表面形成更小的纳米颗粒,而分散剂的添加则有利于还原后金属纳米颗粒的分散,有助于提高催化剂比表面积。由此可见,较低的制备温度及较大的分散剂用量有助于提高CuFe双金属催化剂上活性金属的分散。由ICPAES表征结果可知,三种催化剂的n(Cu)∶n(Fe)处于2.92~3.10之间,这与催化剂制备时加入的n(Cu)∶n(Fe)=3∶1较接近,可见Cu,Fe组分在催化剂制备过程中基本负载于颗粒载体上。
图1为催化剂的XRD谱图。由图1可知,谱图中出现 Cu(2θ=43.3°,50.4°,74.1°,JCPDS#89-2838)、CuO(2θ=35.5°,38.6°,JCPDS#80-0076)、Cu2O(2θ=36.4°,42.4°,JCPDS#78-2076) 以 及Fe3O4(2θ=30.1°,35.4°,JCPDS#82-1533)的特征衍射峰[19]。其中,Cu的衍射峰强度最高,Fe3O4的特征衍射峰强度较弱,未见Fe的衍射峰,可能是由于Fe含量较低,且晶粒尺寸较小导致。三种催化剂上Cu及其氧化物的特征衍射峰有明显差异。其中,催化剂试样CuFe-RT和CuFe-150具有较强的Cu2O衍射峰,而单质Cu的特征衍射峰强度相对较弱,这说明较高的制备温度和较少的分散剂用量不利于Cu2O到Cu的还原,使得催化剂试样CuFe-RT和CuFe-150上的Cu组分更多以Cu2O形式存在。
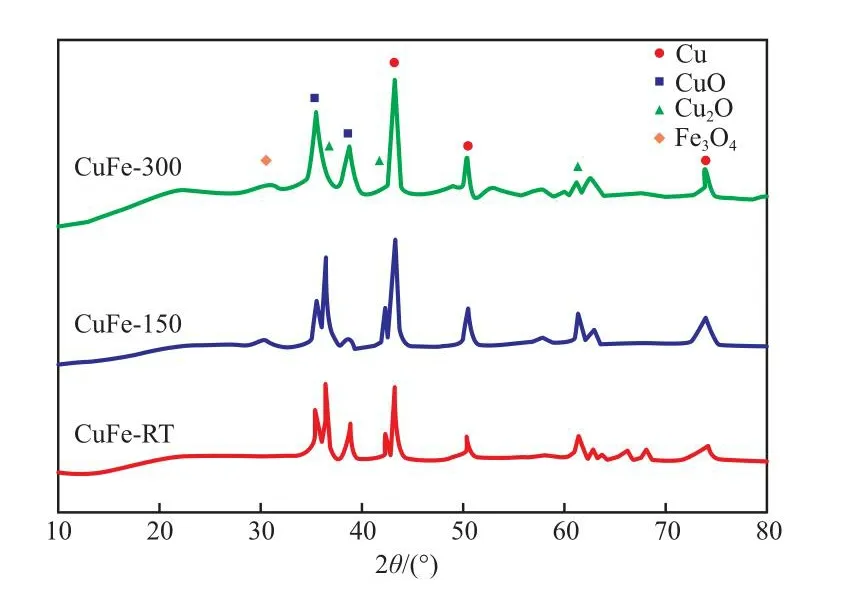
图1 催化剂的XRD谱图Fig.1 XRD patterns of catalysts.
图2为催化剂的H2-TPR曲线。由图2可知,三种催化剂试样均存在两个主还原峰,其中,低温还原峰位于100~300 ℃,为CuO还原成Cu2O及Cu的耗氢峰,高温还原峰位于300~550 ℃,为Fe2O3及Fe3O4的还原耗氢峰。CuO的还原峰和Fe3O4的还原耗氢峰均向高温偏移,表明活性金属氧化物较难还原,这主要是由于较高的制备温度和较少的分散剂用量不利于活性金属的分散,导致催化剂试样CuFe-RT和CuFe-150在制备过程中活性金属颗粒较大,增大了还原的难度,这与低温Ar吸附-脱附表征结果一致。同时,不同Cu物种组成也会对催化剂的低温还原峰位置产生影响。由XRD表征结果可知,催化剂试样CuFe-300相对于CuFe-RT和CuFe-150含有更多的CuO组分,在H2气氛下升温还原过程中相对Cu2O更易被还原,还原耗氢峰位置趋于较低温度,其次是CuFe-RT和CuFe-150,这与H2-TPR结果一致。
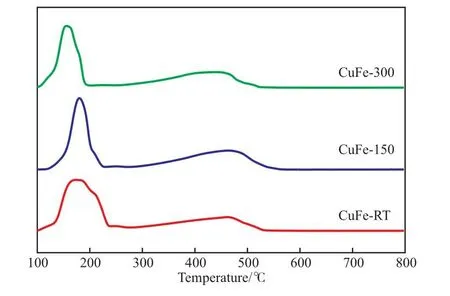
图2 催化剂的H2-TPR曲线Fig.2 H2-TPR profiles of catalysts.
不同制备温度及分散剂用量条件下制备的CuFe双金属催化剂的高碳醇合成(HAS)反应性能测试结果见表2。由表2可知,在不同制备温度及分散剂用量条件下制备的三种催化剂试样中,与催化剂试样CuFe-RT和CuFe-150相比,催化剂试样CuFe-300拥有最高的CO转化率,说明较多的分散剂用量、较低的制备温度有助于提高催化剂的反应活性,这与催化剂试样CuFe-300相对较好的活性金属分散度及较大的比表面积相对应。就产物选择性而言,催化剂试样CuFe-300上的总醇选择性较高,同时在醇分布中,C2+醇含量也占到73.8%(w),可见在较高的分散剂用量及冰水浴的制备温度下,经合成气还原后的活性金属在载体上负载时具有更好的分散度,这对于反应活性及HAS起到了一定的促进作用。而H2-TPR表征结果也显示,催化剂试样CuFe-300上的Cu,Fe氧化物更易还原,说明催化剂试样CuFe-300的活性金属颗粒具有更为良好的分散性和反应活性,这与反应性能测试结果一致。
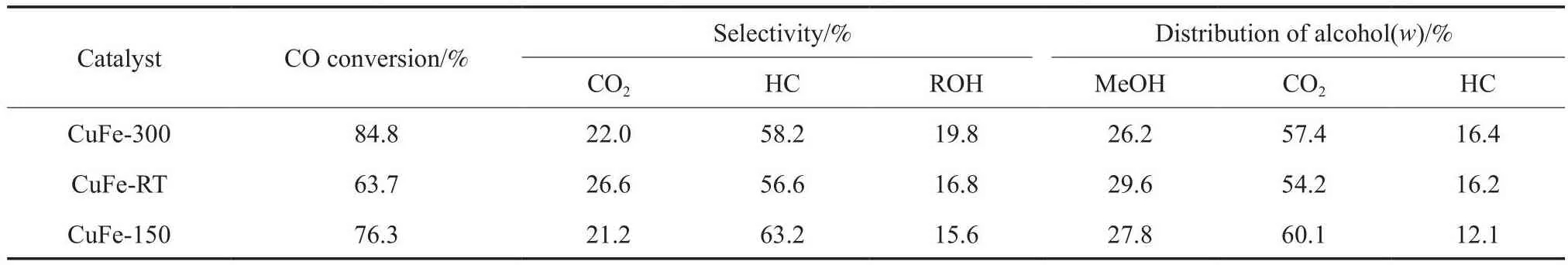
表2 制备温度及分散剂用量对CuFe双金属催化剂上HAS反应性能的影响Table 2 Effects of preparation temperature and disperser amount on high carbon alcohol synthesis reaction on CuFe catalyst
2.2 液相分散剂及pH的影响
2.1节对制备温度及分散剂用量的研究确定了冰水浴及300 mL分散剂用量较优,在此基础上,对分散剂种类及pH对CuFe双金属催化剂反应性能的影响进行了研究。使用不同分散剂制备的CuFe双金属催化剂的孔道结构及组成见表3。由表3可知,EG和PAA作为分散剂对于Cu,Fe金属离子起到一定的分散作用,两者同时添加时,相比单独添加EG或PAA,所制备的催化剂具有更大的比表面积,可见对金属离子起到了更好的分散作用。另外,相对EG作为分散剂,采用PAA时,催化剂比表面积、孔径和孔体积略有增大。由ICP-AES结果可知,采用不同分散剂制备的催化剂的n(Cu)∶n(Fe)处于2.88~3.12之间,与制备时的n(Cu)∶n(Fe)=3∶1较接近,可见Cu,Fe组分在载体上负载良好,流失较少。
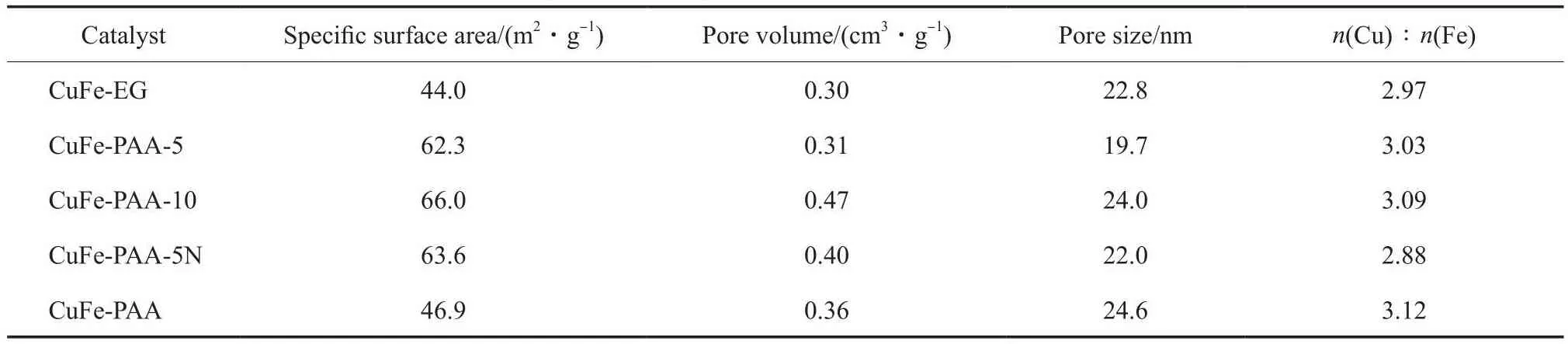
表3 催化剂的织构特性及ICP-AES表征结果Table 3 Texture properties of catalyst samples and characterization results by ICP-AES
图3为不同分散剂制备CuFe催化剂的XRD谱图。由图3可知,CeO2晶相所对应的衍射峰较为明显,位于 2θ=28.6°,33.1°,47.5°,56.3°,59.1°,69.4°,76.7°,79.7°处(JCPDS#34-0394),可见各催化剂试样均呈现较好的晶相结构。此外,2θ=35.5°,38.6°处的特征衍射峰所对应的物质为CuO(JCPDS#80-0076),且三种催化剂试样CuFe-EG,CuFe-PAA-5,CuFe-PAA上的CuO衍射峰相对较为明显,说明CuO在这三种催化剂上具有较好的晶相结构或颗粒较大。另外,谱图中未观察到明显的Fe衍射峰(与图1相同),这可能是由于Fe含量较低或分散度较好所造成。
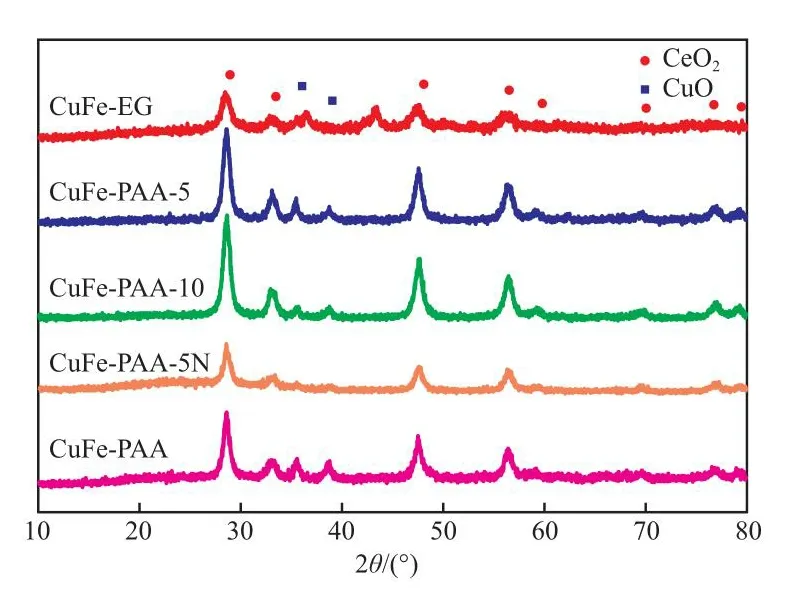
图3 不同分散剂制备CuFe催化剂的XRD谱图Fig.3 XRD patterns of CuFe catalyst prepared by different dispersants.
图4为不同分散剂制备的CuFe催化剂H2-TPR曲线。由图4可知,位于100~250 ℃的峰为CuO的还原耗氢峰,300 ℃以上的峰为铁氧化物的还原耗氢峰。相对于使用PAA作为分散剂或者两种分散剂混用的情况,以EG为分散剂制备的催化剂试样CuFe-EG的低温还原峰温度明显较低,表明它表面的CuO组分更易被还原,这可能与它较为均匀的金属分散状态有关,而Cu,Fe组分的均匀分散对于Fischer-Tropsch反应的活性及C2+混合醇的生成是有利的。对于高温还原峰,催化剂试样CuFe-EG较为明显,且还原耗氢峰位置较高。混用分散剂的几个催化剂试样高温还原峰不明显,可能是由于PAA分子在催化剂表面的包覆导致不易被还原。此外,PAA与EG分子间也可能存在聚合反应,更高分子量物质在活性金属表面的包覆也会抑制Cu,Fe物质的还原,导致催化剂反应活性降低。对比催化剂试样CuFe-PAA-5和CuFe-PAA-5N可知,pH的增大使CuO还原峰向高温方向移动,铁氧化物的还原峰更不明显,这可能与PAA和EG在低pH和高pH条件下的聚合作用机制不同所导致[20]。另外,PAA的高分子特性也会使得催化剂表面的活性组分难以还原,这也是导致添加了PAA作为分散剂的CuFe催化剂还原峰强度普遍低于以EG为分散剂的还原峰强度的原因[21]。
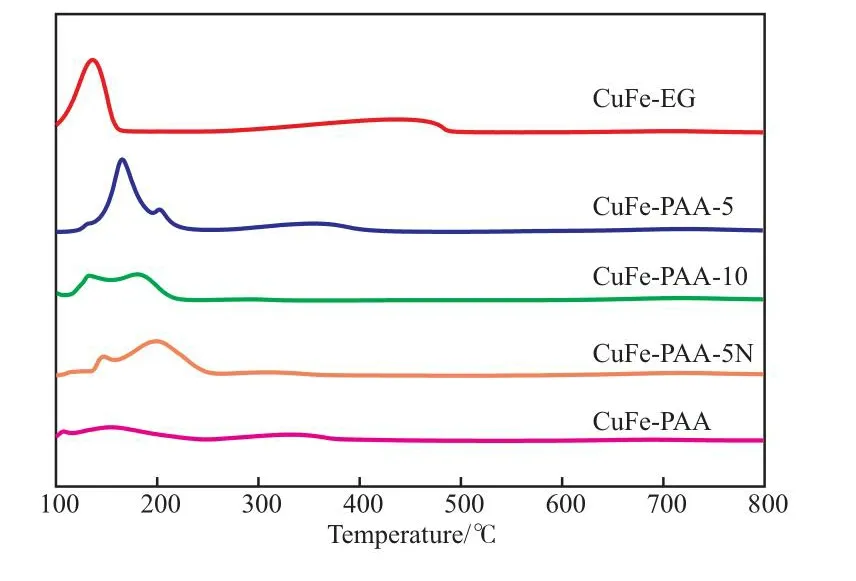
图4 不同分散剂制备的CuFe催化剂的H2-TPR曲线Fig.4 H2-TPR profiles of CuFe catalyst prepared by different dispersants.
采用不同分散剂制备的CuFe双金属催化剂反应性能测试结果见表4。由表4可知,采用两种分散剂混合的情况下,催化剂反应活性明显降低,这是由于催化剂表面Fe组分难以被还原所导致。以EG为分散剂所制备的催化剂试样CuFe-EG上CO转化率达到85.7%,相对PAA作为分散剂的催化剂而言,反应活性明显较高。对比催化剂试样CuFe-PAA-5和CuFe-PAA-5N可知,pH的增大不利于CuFe催化剂反应活性。此外,就产物而言,催化剂试样CuFe-PAA-5,CuFe-PAA-10,CuFe-PAA-5N在Fischer-Tropsch反应过程中没有明显的液相产物生成,可见链增长过程受到了极大抑制,这是由于PAA与EG分子间聚合所生成的聚合物对活性金属的包覆导致活性金属难以暴露在反应气氛下所导致。当只使用PAA作为分散剂时,大分子的包覆作用不是很明显,因此在催化剂试样CuFe-PAA上的反应活性有所降低,但仍能生成高碳产物。因此,当PAA与EG混合作为分散剂时,两者间的聚合作用生成的更高分子量大分子产物对活性金属形成包覆,而这些大分子物质在N2气氛下焙烧时不易去除,仍部分覆盖在催化剂表面活性位[21],抑制了反应活性,同时也不利于C2+混合醇的生成。而小分子分散剂EG则不但能起到较好的分散作用,且不会对活性位造成覆盖,焙烧时易去除,使Cu,Fe组分形成良好的分散分布,有助于高碳数醇类的生成,可作为液相还原法制备CuFe双金属催化剂的较优的液相分散剂使用。
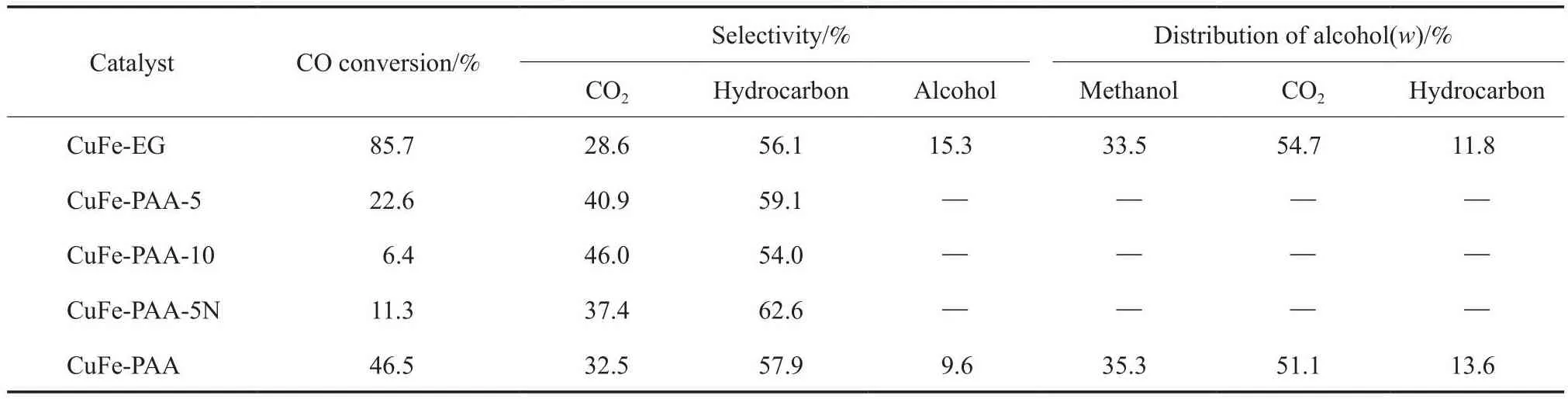
表4 不同分散剂制备的CuFe催化剂反应性能Table 4 Reaction performance of CuFe catalyst prepared by different dispersants
3 结论
1)对于CuFe双金属催化剂制备温度和分散剂用量的研究结果表明,较多的分散剂用量、较低的制备温度有助于获得相对较好的活性金属分散度及较大的比表面积,促进Cu,Fe活性组分间的协同效应,有效提高催化剂的反应活性及C2+混合醇选择性;对分散剂种类及pH的研究结果表明,pH保持中性及PAA的加入,提高了催化剂的比表面积,PAA的存在及其与EG之间的聚合效应造成对活性组分的部分覆盖,影响了活性组分在反应气氛下的暴露,从而降低了催化剂的反应活性及碳链增长,体现在CO转化率及长链产物选择性的降低。
2)综合考虑CO转化率、总醇选择性及C2+醇选择性,液相还原法制备CuFe双金属催化剂的条件为:液相分散剂EG,加入量300 mL,冰水浴,pH中性(7.0)。
