微秒时间分辨的工况电化学紫外可见吸收光谱测量系统
2023-03-15尉瑞芳李东峰尹恒王秀丽李灿
尉瑞芳,李东峰,尹恒,王秀丽,*,李灿,3,*
1中国科学技术大学化学物理系,合肥 230026
2中国科学院大连化学物理研究所催化基础国家重点实验室,辽宁 大连 116023
3中国科学院大学,北京 100049
1 引言
电催化在清洁能源利用、环境保护、能量转化及储存领域都具有重要作用1-4。电催化反应过程非常复杂,通常涉及到多电子、多质子的转移过程(如,水分解反应涉及四电子、四质子的产氧过程,以及两电子、两质子的产氢过程)。电催化反应动力学和机理研究,对电催化非常重要、非常挑战5。为了探究电催化反应的基元过程、中间物种、反应级数、反应速率等,研究者们使用多种原位/工况表征技术进行电催化动力学和机理研究。目前电催化中应用较多的原位/工况表征技术有:工况拉曼(Raman)6-8和工况红外(IR)9-11光谱实时研究反应中间物种以及电催化剂的结构变化;原位X射线吸收光谱(XAS)12,13、原位X射线光电子能谱(XPS)14以及原位电子顺磁共振谱(EPR)15,16实时研究催化剂价态和结构转变;原位X射线衍射(XRD)17,18实时研究催化剂晶相变化;电化学阻抗谱(EIS)19,20实时研究电催剂在电催化反应中涉及到的电子转移过程。
以上常用的原位/工况表征技术虽然可以实时研究反应中间物种和电催化剂的价态和结构变化,但是这些技术在电催化测试中均是(准)稳态测试。而电催化反应中很多重要的过程发生在毫微秒时间尺度,如:电催化剂在催化反应中反应中间物种的超快/快生成过程,反应中间物种的转化、参与反应的超快/快动力学过程,对这些动力学过程的直接研究和认识非常重要。因此,发展具有毫微秒时间分辨的工况表征手段对研究电催化机理非常重要,但是目前除了能间接识别物种瞬态转变过程的电化学阻抗谱以外,具有微秒时间分辨的电催化工况表征研究手段还几乎处于空白。近年来,研究表明原位/工况紫外可见(UV-Vis)吸收光谱可以实时监控反应中间物种的价态及浓度变化,成为研究电催化反应过程的有力手段13,16,21。但是目前报道的工况紫外可见吸收光谱一般是利用常规的紫外可见分光光度计测试得到,是在电化学的稳态条件进行的,所得光谱的时间分辨率大多在秒量级21-26。对于更短时间尺度(如毫微秒量级)上发生的瞬态动力学过程无法进行研究。
本工作致力于自主研发毫微秒时间分辨的工况电化学紫外可见吸收光谱技术,并利用发展的工况电化学紫外可见吸收光谱,研究水合铁(Fh)等电催化水氧化反应,认识水氧化反应的动力学和反应机理。
2 实验部分
2.1 催化剂制备
导电玻璃(FTO)的清洗:将切好的FTO (Nippon Sheet Glass Company,Japan)(1 cm × 2 cm),依次用丙酮(≥ 99.5%,国药集团化学试剂有限公司)、异丙醇(≥ 99.7%,国药集团化学试剂有限公司)、乙醇(≥ 99.7%,天津市大茂化学试剂厂)、去离子水(18.2 MΩ)各超声30 min后吹干备用。
水合铁电极的制备27:采用水热合成法,将两片洗好的FTO放入0.05 mol·L-1硝酸铁(≥ 98.5%,国药集团化学试剂有限公司)和0.375 mol·L-1硝酸钠(≥ 99.0%,天津市科密欧化学试剂有限公司)的混合水溶液中,溶液置于150 mL烧杯中并用保鲜膜密封,将其放置在100 °C的烘箱中水热30 min后即可得到所需的透光样品水合铁(Fh)。
氧化锰电极的制备14:采用电沉积法在FTO基底上制备氧化锰催化剂。在三电极体系中,以FTO为工作电极,铂为对电极,银/氯化银(Ag/AgCl)为参比电极,文中所用三电极体系的对电极和参比电极均保持不变。在10 mmol·L-1硫酸锰(≥ 99.0%,国药集团化学试剂有限公司)和0.1 mol·L-1高氯酸钠(ACS reagent ≥ 98.0%,Sigma-Aldrich)的混合水溶液中,以1.23 Vvs.Ag/AgCl的恒电位进行电沉积1 min,将所得的氧化锰样品放置过夜后,分别在300和600 °C各自热处理2 h,得到所需的透光样品二氧化锰(MnO2)和三氧化二锰(Mn2O3)。
磷酸钴电极的制备28:采用电沉积法在FTO基底上制备磷酸钴催化剂。在三电极体系中,以FTO为工作电极。在0.5 mmol·L-1六水合硝酸钴(≥ 99.0%,国药集团化学试剂有限公司)和0.1 mol·L-1磷酸钾缓冲溶液(0.051 mol·L-1磷酸二氢钾(≥ 99.5%,国药集团化学试剂有限公司)和0.049 mol·L-1磷酸氢二钾(≥ 99.0%,国药集团化学试剂有限公司))的混合水溶液中,在1.60 Vvs. RHE (下文中所用的偏压单位均是相对于可逆氢电极,简写为RHE,VRHE=VAg/AgCl+ 0.1981 + 0.0591 × pH)的恒电位下进行电沉积5 min,即可得到所需的透光样品磷酸钴(CoPi)。
2.2 电化学测试
利用三电极体系电化学测试,电解液为0.1 mol·L-1磷酸钾缓冲溶液(0.05 mol·L-1磷酸二氢钾和0.05 mol·L-1磷酸氢二钾),简写为KPi,pH = 6.81,或者0.1 mol·L-1KPi加0.5 mol·L-1亚硫酸钠(Na2SO3)(≥ 97.0%,天津市科密欧化学试剂有限公司)的混合溶液,pH = 7.58。工作电极为导电且透光性较好的样品,对电极为铂片,参比电极为银/氯化银(饱和氯化钾)参比电极。用电化学工作站(CHI 760C,上海辰华仪器公司)进行循环伏安法和阶跃电位的测试。正文中所有的电化学测试除了特别标明,其余均未进行iR矫正。
2.3 紫外可见吸收装置
探测光源:100 W钨灯(Bentham,IL 1),检测单元:单色仪(Zolix,Omni-λ300)和硅光电二极管(Hamamatsu),信号采集单元:示波器(Tektronix,TDS 2012C)和数据采集卡(National Instruments NI-6221)。
3 结果与讨论
3.1 原理策略
仪器工作原理:时间分辨的工况电化学紫外可见吸收光谱装置工作原理如图1。装置包括五个部分:电化学工作站、电路控制单元、三电极电化学池、紫外可见吸收光谱装置和计算机。电化学工作站用于对三电极施加电偏压;电路控制单元用于控制电偏压脉冲宽度及触发紫外可见吸收光谱信号的采集;三电极电化学池用于电化学测试;紫外可见吸收光谱装置用于探测电极透射光强度的变化;计算机用于控制电化学工作站和紫外可见吸收光谱装置的运行,以及数据的输入、处理和输出。基于该系统可以实现微秒时间分辨的工况电化学紫外可见吸收光谱信号的采集。
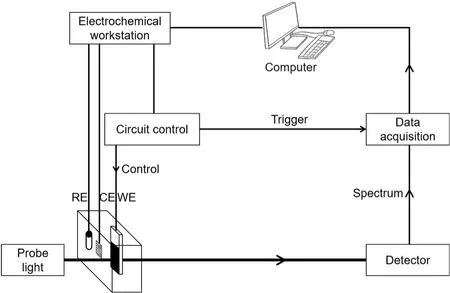
图1 时间分辨的工况电化学紫外可见吸收光谱装置工作原理Fig. 1 Schematic principle of time-resolved operando electrochemical UV-Vis absorption spectroscopy.
为了验证所发展的时间分辨工况电化学吸收光谱装置的可行性,我们首先通过测试来验证电路控制单元、电化学工作站和紫外可见吸收光谱装置输出信号的匹配性。以导电且透光性较好的Fh电催化剂进行电催化水氧化反应为例,首先对其在稳态电催化水氧化条件下中间物种积累以及转化过程进行研究。根据Durrant等29的报道,铁基电催化剂在400至550 nm区间有一个较宽的吸收带,对此本研究中选用吸光强度较大的543.5 nm作为探测波长,进行工况电化学紫外可见吸收光谱测试。根据Fh的电压-电流曲线(图2a)和塔菲尔曲线(图2b)分析,选取基线电位1.67 V,水氧化高电位选定在1.90 V。通过电路控制单元输出一个以10 s为周期,脉冲宽度为4 s的控制信号,将其和电化学工作站联用,电路开通4 s期间电位处于水氧化高电位(如:1.90 V),随后电路中断6 s。在该电化学信号循环施加到测试样品过程中同时采集紫外可见吸收光谱信号,即可获得相对应时间尺度的控制信号、电化学以及工况的紫外可见吸收光谱信号。如图2c所示,图中下面板为控制单元输出的电压幅值-时间图,中间面板为电化学工作站输出的电流-时间图,上面板为工况紫外可见吸收光谱采集的吸光度-时间谱图。通过对图2c中三个不同仪器输出的信号对比,可以发现该装置中联用的三个仪器(电路控制单元,电化学工作站,紫外可见吸收光谱装置)在时间响应上完全一致,有良好的匹配性。进一步考察该系统的微秒时间响应问题,如图2d所示,在20 μs脉冲偏压作用下,在2-3 μs即可检测到电流。结合我们使用的光谱探测系统的微秒时间分辨率30,31,本文发展的时间分辨工况电化学吸收光谱具有高达3 μs的时间分辨率。使用偏压中断为时间零点的微秒-秒的吸光度-时间曲线,直接证明了系统的微秒时间分辨率(图S1,Supporting Information)。进一步通过电路控制单元调控电脉冲宽度,实现时间分辨工况电化学动力学的直接研究(见后文结果及讨论)。
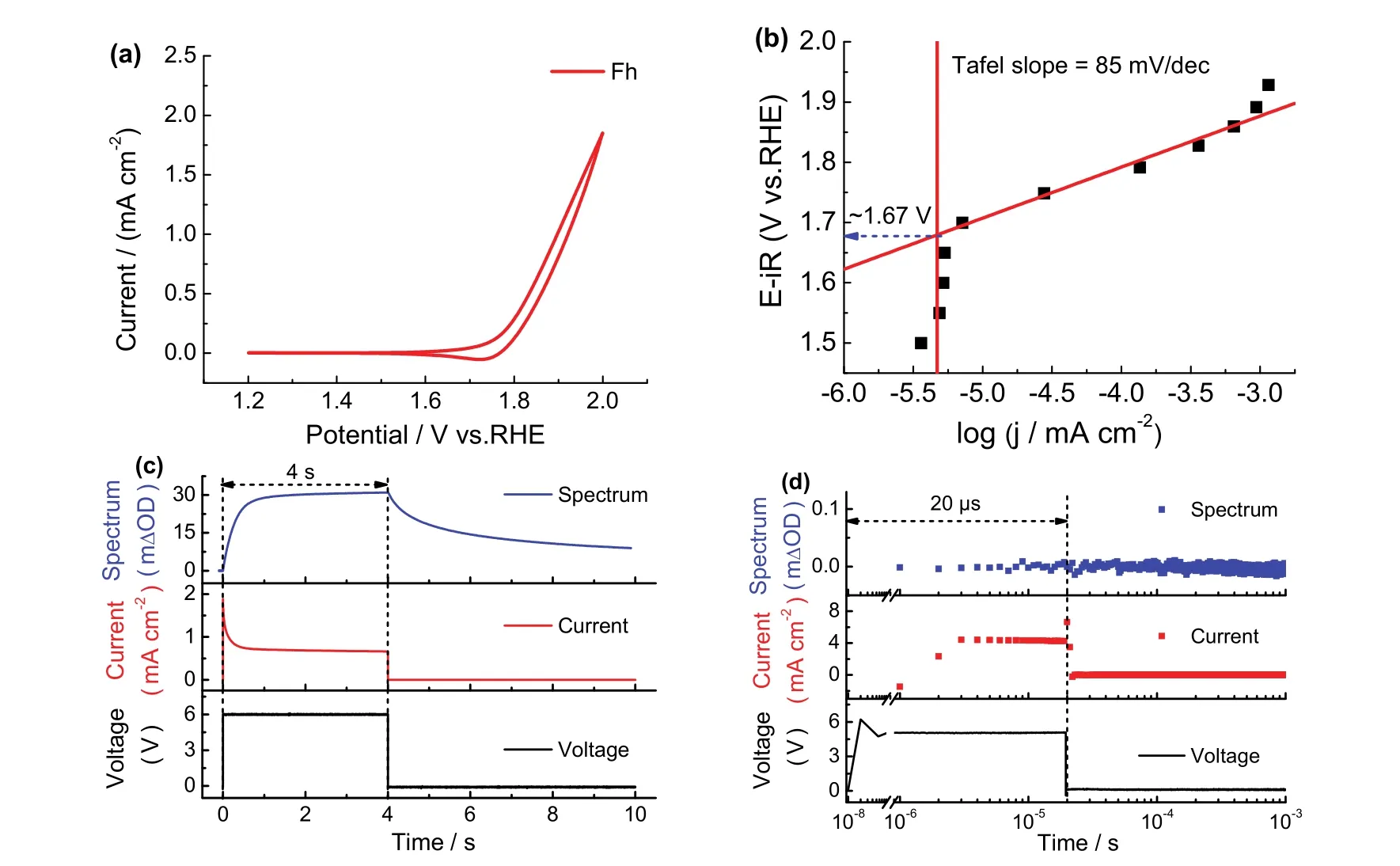
图2 水合铁(Fh)的(a)循环伏安曲线图和(b)Tafel曲线;(c)4 s电脉冲宽度和(d)20 μs电脉冲宽度下时间分辨的工况电化学紫外-可见吸收光谱装置输出的吸光度-时间谱图(上),电化学工作站输出的电流-时间图(中);电路控制单元输出的电压幅值-时间图(下)Fig.2 (a)Cyclic voltammetry curve and (b)Tafel curve of ferrihydrite (Fh); under (c)4 s bias pulse width and(d)20 μs bias pulse width, absorbance-time curve recorded with the time-resolved operando electrochemical UV-Vis absorption spectrometer (top panel); current-time curve recorded with the electrochemical workstation (middle panel);voltage amplitude-time curve applied with the circuit control component (bottom panel).
3.2 时间分辨的工况电化学紫外可见吸收光谱研究
基于以上装置,接下来对Fh电催化水氧化的反应机理进行研究。在自然光合作用的“Kok循环”32中改变光照脉冲次数会形成不同的产氧中间态,受此启发,在电催化水氧化中不同电脉冲宽度激发可能也会形成不同产氧中间态。因此,我们首先通过改变电压脉冲宽度的方式(如:4000、1600、160、16 ms)来改变工况紫外可见吸收光谱测试中物种积累的时间,以期直接观测不同反应中间物种的形成、转化和反应过程。如图3a所示,四条不同电脉冲宽度的吸收谱线表明,虽然在零时刻已经对Fh电催化剂施加了高偏压(1.90 V),但是在微秒到毫秒的时间尺度没有吸光度变化,而是在约1 ms后开始出现吸光度的增加。由于电化学工作站的电子转移过程在微秒时间尺度已经发生,而Fh的吸收光谱变化要在1 ms以后发生,说明电催化剂的氧化变价过程很慢,远远慢于电子转移过程。进一步分析Fh的氧化变价动力学,发现在4000 ms长脉冲宽度下的物种积累过程,可以利用双指数进行很好地拟合,说明氧化物种积累可分为两个过程,一个快速的物种积累过程(平均寿命:~0.27 s)和一个较慢的物种积累过程(平均寿命:~3.34 s),表明物种在外加偏压条件下至少存在两种连续的氧化过程。根据文献报道33,在中性条件下,对于铁基催化剂施加偏压产生的两个连续过程可能是从FeIII-OH到FeIV=O再到FeIII-OOH的过程。进一步通过缩短脉冲宽度使Fh中的物种浓度处于慢积累阶段(4000和1600 ms)或者快积累阶段(160和16 ms),发现物种浓度越低,偏压中断后积累物种的自发衰减速率越慢,可能是由于水氧化反应速率变慢引起的。
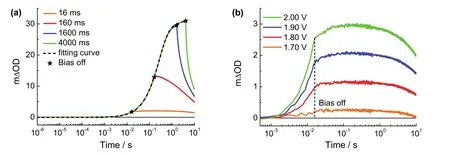
图3 (a)Fh催化剂同偏压下不同脉冲宽度时的工况时间分辨吸收光谱图;(b)Fh催化剂16 ms脉冲宽度下不同偏压的工况时间分辨吸收光谱图Fig.3 (a)Time-resolved operando absorption spectra of Fh with different bias pulse width;(b)time-resolved operando absorption spectra of Fh with different bias at the same pulse width of 16 ms.
另外,当脉冲宽度缩短至160 ms时,偏压中断后吸光度没有立即减少,而是继续增加一段时间后才降低,这种中断偏压后的物种反常积累现象在16 ms偏压脉冲宽度时更为明显。基于短脉冲的明显反常现象,我们选择在16 ms的脉冲宽度下,进一步改变水氧化高电位(1.70、1.80、1.90、2.0 V)进行时间分辨的工况电化学紫外可见吸收谱测试。如图3b所示,随着高偏压的增加,物种的反常积累现象在偏压中断后更加显著,表明中断偏压之后的物种积累过程与短时间(16 ms)内提取的电荷量直接相关。这样一个反常积累现象可能在电催化水氧化过程中起重要作用。这一现象的出现可能是由于水氧化过程中高价物种的形成速率慢于电化学工作站的电子提取速率。电化学工作站提取的电子可能是电极表面双电层内的电子,这一过程应主要发生在微秒时间尺度。随后电脉冲中断后,电荷重新分布诱导催化剂高价物种的形成,这个过程慢于电子向外电路的转移过程,从而出现反常的积累现象。
上述物种反常积累过程的出现,一方面可能源于Fh的真实信号响应,另一方面可能源于电路控制单元在短偏压脉冲结束后未能完全中断电路(即仪器响应)。为了排除仪器自身响应和确定信号源于Fh自身,本研究采用易于氧化的Na2SO3作为氧化反应的反应物34进行时间分辨的工况电化学紫外可见吸收光谱研究。根据图4a的电压-电流曲线选取基线电位(1.45 V)和水氧化高电位(1.90 V),随后在16 ms脉冲宽度下进行工况电化学紫外可见吸收光谱测试。如图4b所示,Na2SO3作为反应物情况下,施加16 ms短脉冲偏压引起的物种积累在偏压中断后立即被快速消耗,没有出现反常的物种积累现象。此现象充分说明,较短偏压脉冲宽度测试中,中断偏压后出现的反常物种积累信号源于Fh水氧化过程中的真实物种转化过程。对该短偏压脉冲宽度下测试的物种积累和衰减部分进行动力学分析,可以获得瞬态物种积累的浓度以及基元反应的中间转化信息,以及电催化剂和电解液之间的相互作用等动力学信息。而且本文中时间分辨的测量系统可以结合电化学阻抗谱,实现对物种转变动力学和电子转移动力学过程的全面分析,进一步揭示中间物种的演化过程。
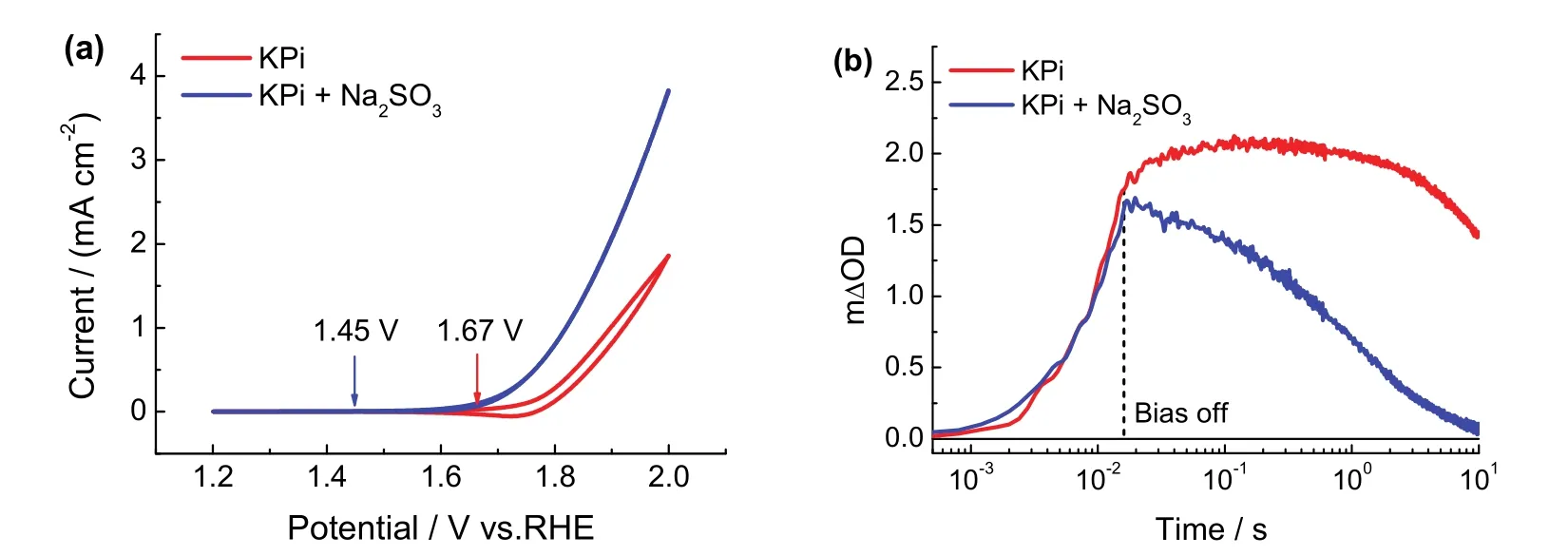
图4 Fh在KPi中有无Na2SO3条件下(a)循环伏安曲线图;(b)电化学工况时间分辨紫外可见吸收谱图Fig.4 (a)Cyclic voltammetry curves of Fh with or without Na2SO3 in KPi;(b)time-resolved operando electrochemical UV-Vis absorption spectra.
3.3 工况电化学紫外可见吸收光谱普适性研究
基于以上对Fh在16 ms偏压脉冲宽度下所得工况吸收光谱信号真实性的验证,进一步对该短脉冲宽度下的工况吸收光谱信号的普适性进行探究。选择几个常见的电催化水氧化催化剂(CoPi、MnO2和Mn2O3),在图5a的电压-电流曲线中选取各自的基线电位CoPi (1.63 V)、MnO2(1.50 V)、Mn2O3(1.45 V),在同样的水氧化高电位1.90 V偏压下进行工况电化学紫外可见吸收光谱测试。根据Durrant35和Naruta36等的报道,以上三个样品在543.5 nm附近均有较宽的吸收带,因此均可选择吸光强度较大的543.5 nm探测波长进行短偏压脉冲宽度的测试,所得工况吸收谱信号如图5b所示。其中Mn2O3的结果显示,偏压中断后没有出现物种的反常积累现象,而CoPi和MnO2同Fh的结果类似,在偏压中断后,短偏压脉冲宽度下积累的物种在偏压中断后没有立即被消耗,而是继续积累一段时间后才被消耗。此结果再次证实了通过该装置所获得的工况吸收谱信号是测试样品真实的物种转化信号,另外也证实了该工况电化学紫外可见吸收光谱测试适用于不同电催化剂的研究,具有较好的普适性。
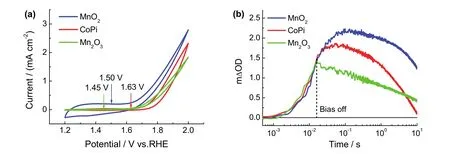
图5 MnO2,CoPi和Mn2O3电催化剂的(a)循环伏安曲线图和(b)工况电化学时间分辨紫外可见吸收光谱图Fig.5 (a)Cyclic voltammetry curves and (b)time-resolved operando electrochemical UV-Vis absorption spectra of MnO2, CoPi and Mn2O3 electrocatalysts.
4 结论
本研究在时间分辨紫外可见吸收光谱的基础上,通过引入电脉冲宽度可调的泵浦信号,使电脉冲信号和光谱信号在时间上同步,实现了时间分辨的工况电化学紫外可见吸收光谱测试,时间分辨率高达3 μs。利用该系统和方法对Fh等电催剂电催化水氧化反应动力学机理进行了研究,直接揭示了水氧化反应中间物种在不同时间尺度的形成、转化和反应过程。时间分辨的工况电化学紫外可见吸收光谱有助于深入理解电催化反应机理,指导设计合成新型高效的电催化剂。
Supporting Information:available free of chargeviathe internet at http://www.whxb.pku.edu.cn.
