胃腺癌进展及预后关键基因与免疫浸润分析
2023-03-15陈德合夏天红杜成周尚力凝李洪涛
陈德合,夏天红,王 杰,郭 刚,杜成周,尚力凝,陈 鹏,李洪涛
肿瘤是全球重大公共卫生问题,严重威胁着人类生命健康,其中在全球有57个国家(包括中国)肿瘤超过心血管疾病成为导致死亡的第一杀手[1-2]。胃癌是人类消化道发病率和病死率最高的肿瘤,仅2020年全球新发胃癌患者108.9万例,因胃癌死亡达76.9万例[3]。胃腺癌是胃癌的主要类型,起源于胃最表层或黏膜腺体,约占胃癌90%,发病原因可能与环境和遗传因素有关,但具体发病机制仍不清楚[4]。因此,寻找诊断、治疗和预后判断的新标志物对胃腺癌精准诊疗及预后改善尤为重要。随着生物、医学及科技领域的日新月异,蛋白质分子组学、高通量测序及生物信息学技术不断应用,使得精准诊疗成为可能。大数据时代的到来,公共医学数据库不断涌现,推动了医学的快速发展,进而为肿瘤基础医学和转化医学研究者贡献了大量基因组数据和其关联临床数据。本研究欲通过可视化的GEPIA 2.0肿瘤数据分析平台,对TCGA及GTEx中胃腺癌及癌旁组织的差异基因及预后相关基因进行分析,以期发现胃腺癌新的诊断标志物或潜在的治疗靶点。
1 资料与方法
1.1一般资料 利用GEPIA 2.0肿瘤数据分析平台,对TCGA和GTEx数据库中408个胃腺癌和211个癌旁组织样本RNASeq的数据进行可视化基因表达动态分析;运用FunRich(Version 3.1.3)软件进行GO和KEGG富集分析;接着通过GEPIA 2.0和StarBase v2进行关键基因表达与预后生存验证,确定有意义的关键基因;进而利用TIMER 2.0和TISIDB数据库探讨关键基因表达与免疫细胞浸润的相关性;最后构建预后风险模型进行Cox回归分析。
1.2研究方法
1.2.1基因差异表达分析及验证:在GEPIA 2.0平台中选择FUNCTIONS菜单下的Expression Analysis,然后选择Differential Genes。筛选条件:①Dataset (Cancer name)选择胃腺癌;②Differential Methods 选择 ANOVA;③| Log2FC | Cutoff: 1,q-value Cut off: 0. 01;④Gene/Isoform 选择 Gene;⑤Chromosomal Distribution 选择 Both;⑥比对GRCh38. p2(NCBI),得到差异基因和其染色体分布图。
1.2.2预后差异相关基因分析:在GEPIA 2.0平台中选择FUNCTIONS中的Expression Analysis,然后选择Survival Analysis 再选择Most Differential Survival Gens。筛选条件:①Datasets Selection 选择胃腺癌;②Gene/Isoform 选择Gene;③Methods 为 Overall Survival or Disease Free Survival;④Group Cutoff 为 Median;⑤得到预后总生存期(OS)和无病生存期(DFS)相关基因。
1.2.3韦恩图和GO、KEGG富集分析:通过韦恩图对胃腺癌差异基因与预后OS和DFS相关的基因做交集,得到交集基因后应用基因富集软件FunRich(Version 3.1.3)完成差异相关基因的GO和KEGG富集分析。
1.2.4差异基因表达和预后生存验证:通过GEPIA 2.0和StarBase v2对鉴定的差异基因进行表达和预后生存验证,确定胃腺癌差异表达且与预后相关的关键基因。
1.2.5关键基因表达与免疫细胞浸润水平、丰度相关性:通过TIMER 2.0和TISIDB数据库分析关键基因表达与免疫细胞浸润水平、丰度的相关性。
1.2.6单因素和多因素Cox回归分析:从TCGA数据库获得胃腺癌的RNAseq数据(level3)和相应的临床信息,进行单因素和多因素Cox回归分析,并通过“Forestplot”包分析每个变量。
2 结果
2.1差异表达基因 应用GEPIA 2.0对TCGA和GTEx数据库中408个胃腺癌和211个癌旁组织样本RNASeq的数据进行差异基因筛选,获得4644个差异表达基因,其中上调基因有3746个,下调基因有898个。上调前10位基因为CEACAM5、CEACAM6、RNU11、CLDN3、CST1、OLFM4、REG4、MUC3A、MUC13和CLDN4,见表1;下调前10位基因为PGA3、PGA4、PGA5、LIPF、GKN1、GIF、PGC、ATP4B、ATP4A和GKN2,见表2。差异表达基因主要染色体分布见图1。

表1 胃腺癌差异表达基因表达上调前10位基因

表2 胃腺癌差异表达基因表达下调前10位基因
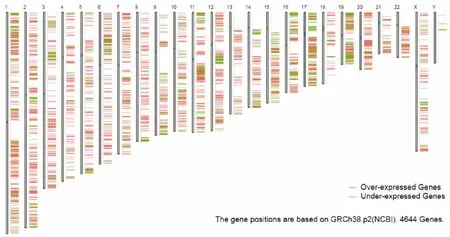
图1 胃腺癌差异表达基因主要染色体分布
2.2差异表达且与预后生存相关基因 通过韦恩图对胃腺癌差异基因与预后OS和DFS相关排序前500位基因分别做交集,通过统计得出GFRA3、APBB1、ABCA8、PLCXD3、FAM153B、CLRN3、CD300LG及ASF1B 8个差异表达基因与预后OS、DFS相关,见图2a;差异表达基因名称、编号及在胃腺癌与癌旁组织的表达情况及差异性详见表3。进一步通过GEPIA 2.0进行差异相关基因对比分析,探索8个差异相关基因在31种肿瘤癌与癌旁组织表达的差异热图,见图2b,通过对比热图发现不同肿瘤癌与癌旁组织差异相关基因表达不同,可能与肿瘤的组织特异性有关,为肿瘤的诊断和治疗提供了新的思路。

图2 胃腺癌差异表达基因与预后总生存期(OS)、无病生存期(DFS)相关基因韦恩图及在不同肿瘤中表达差异热图

表3 胃腺癌差异表达且与预后生存相关8个基因
2.3差异相关基因GO和KEGG富集分析 通过基因富集软件FunRich(Version 3.1.3)对8个差异相关基因进行GO分析发现这些基因主要富集的细胞组分 (cellular component, CC)13个,分子功能(molecular function, MF)6个,生物学过程(biological process, BP)7个;KEGG富集分析发现其涉及的通路有3条。CC中主要集中在细胞核(40.0%)、细胞膜(40.0%)、细胞质(40.0%)、膜内(40.0%)和膜外(20.0%) 等13个细胞组分。MF中主要涉及受体活性 (12.5%)、磷脂酶活性(12.5%)、辅助转运蛋白活性(12.5%)、分子伴侣活性(12.5%)和未知功能(37.5%)等6个功能簇。BP中主要包含信号传导(25.0%)、细胞通讯(25.0%)、新陈代谢(12.5%)、物质运输(12.5%)和未知生物学过程(37.5%) 等7个生物过程。KEGG富集分析结果表明,差异相关基因主要参与ABC家族蛋白介导的转运(50%)、核雌激素受体α网络(50%)和小分子的跨膜转运(50%)3条信号通路,见图3a~3d。

图3 胃腺癌差异相关基因GO及KEGG富集分析
2.4验证差异相关基因表达与预后关系 利用GEPIA 2.0和StarBase v2.0基因表达数据和临床信息,验证筛选到的8个差异相关基因在胃腺癌与癌旁组织的表达及预后分析,最终确定ABCA8、PLCXD3、CLRN3、CD300LG及ASF1B 5个为关键基因。①通过验证表明ABCA8、PLCXD3和CD300LG在胃腺癌组织低表达,CLRN3和ASF1B在胃腺癌组织高表达(P<0.01),见图4和图5。②通过验证表明在胃腺癌中ABCA8、PLCXD3和CD300LG低表达患者OS和DFS较长,CLRN3和ASF1B高表达患者OS和DFS较长(P<0.05),见图6和图7。
2.5胃腺癌关键基因表达与免疫细胞浸润相关性 通过肿瘤免疫在线研究工具TIMER 2.0和TISIDB数据库探讨5个关键基因表达与免疫细胞浸润水平、丰度相关性,发现5个关键基因表达与免疫细胞浸润水平、丰度具有相关性(r>0.3,P<0.01),见图8和9。

图4 GEPIA 2.0验证胃腺癌关键基因表达
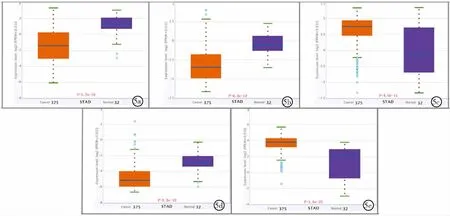
图5 StarBase v2.0验证胃腺癌关键基因表达
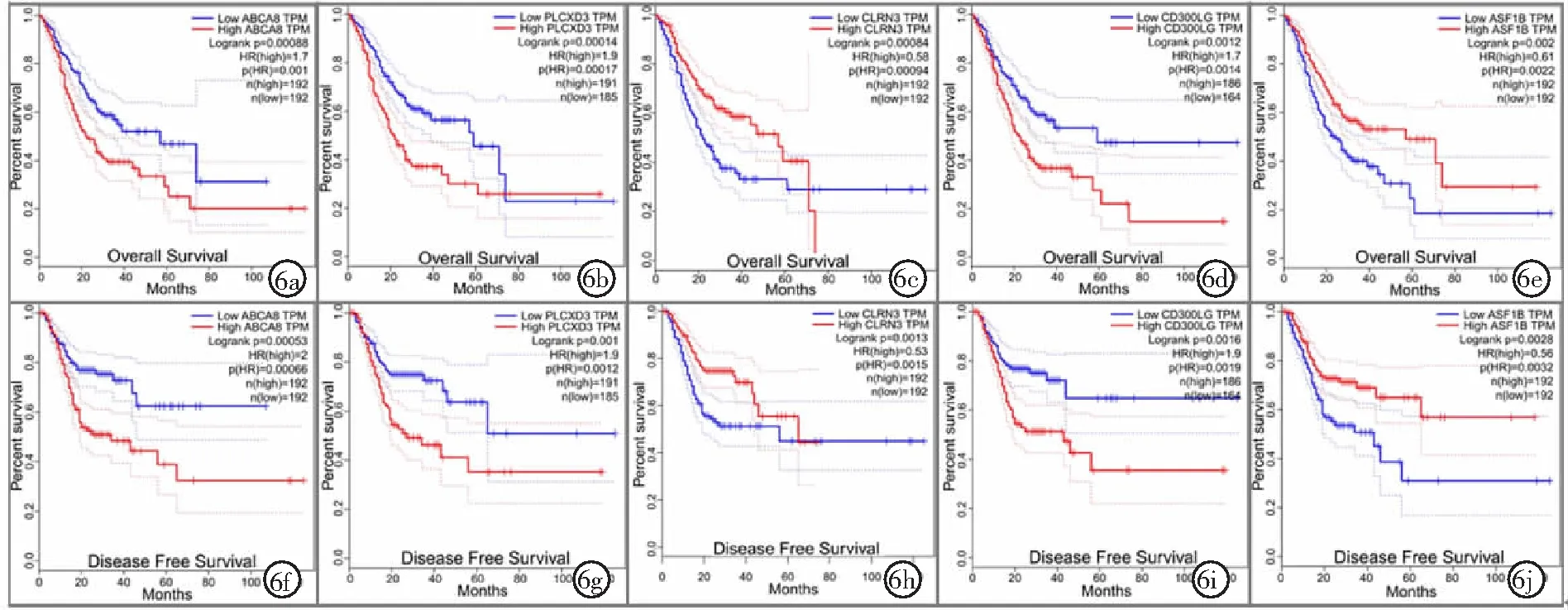
图6 GEPIA 2.0验证胃腺癌关键基因表达与预后关系
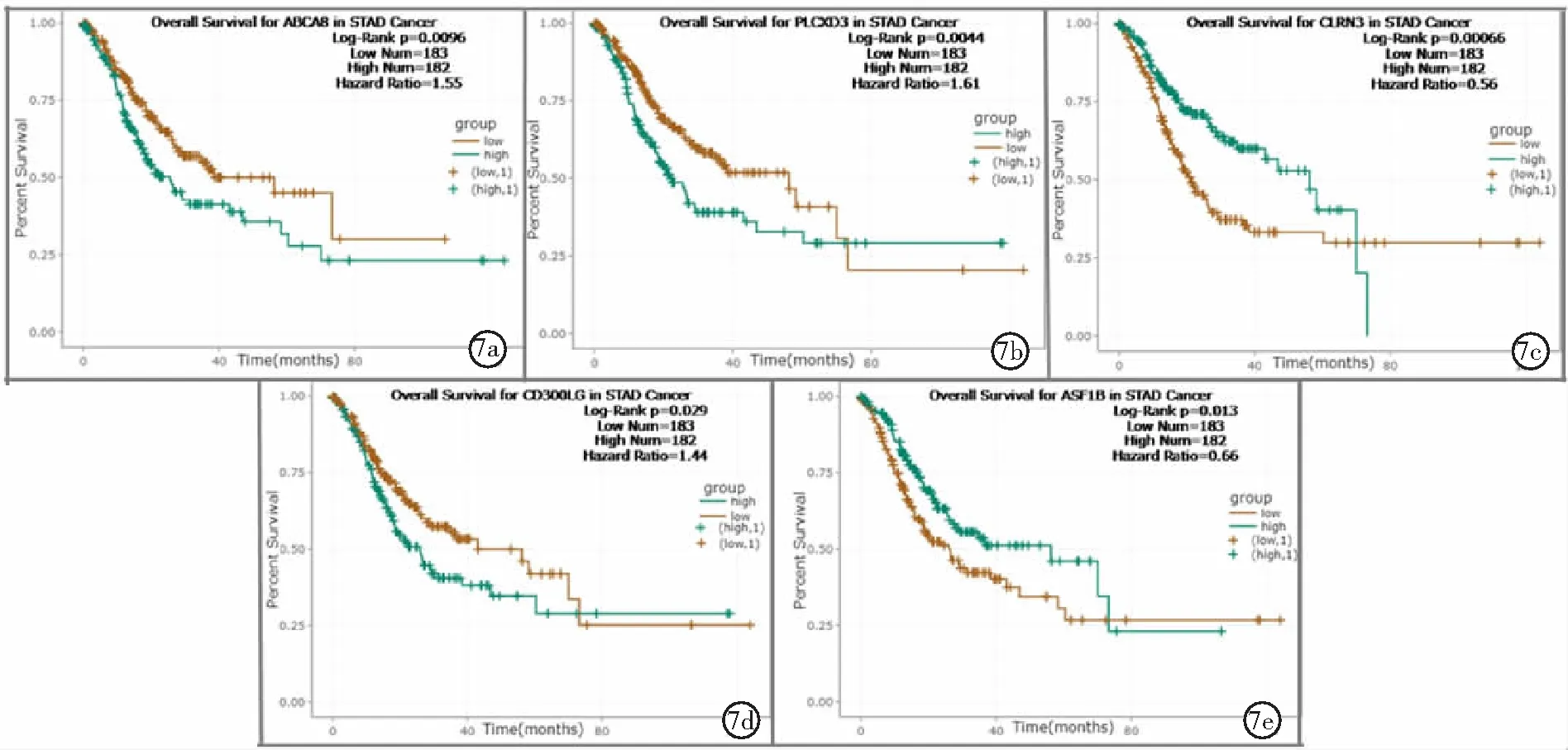
图7 StarBase v2.0验证胃腺癌关键基因表达与预后关系
2.6关键基因预后风险模型Cox回归分析 从TCGA数据库获得375个胃腺癌的RNAseq数据(level3)和相应的临床信息,构建关键基因预后风险模型,进行单因素和多因素Cox回归分析。单因素Cox回归分析显示5个关键基因(ABCA8、ASF1B、CD300LG、CLRN3、PLCXD3)、性别、pTNM分期及病理分级是胃腺癌预后的相关风险因素(P<0.05,P<0.01);多因素Cox回归分析显示性别、pTNM分期和病理分级是胃腺癌预后的独立风险因素(P<0.01),详见表4。
3 讨论
胃癌发病率男性是女性的2倍,在东亚和东欧发病率最高,其为发病率和病死率最高的三大癌症之一[3]。胃腺癌是胃癌的主要类型,可能由饮食习惯、激素水平、慢性胃炎及幽门螺旋杆菌感染等多种因素引起,现其发病机制仍不清楚。虽然早期胃癌患者术后5年生存率为90%,但胃癌患者发现时多位于晚期[5]。近年来胃癌诊治手段已经有了很大进展,但在我国胃癌的5年生存率仅为35.9%,远低于日本的60.3%和韩国的68.9%[6]。随着新的技术发展,尤其是分子生物学、基因芯片、生物信息技术及大数据等在医疗领域的应用,肿瘤的早期诊断和精准治疗成为当前研究的热点。胃腺癌的研究转向分子水平的发病机制、驱动基因、诊断标志物及靶向治疗的研究。因此,探讨与胃腺癌诊疗相关的分子标志物,对其预后改善具有重要意义。
本研究通过可视化肿瘤数据分析平台GEPIA 2.0进行差异基因和预后生存相关基因鉴定,并使用韦恩图筛选与肿瘤发生、发展及预后相关的关键基因,通过不同数据库验证及免疫浸润探讨、预后风险模型预测,最终确定ABCA8、PLCXD3、CLRN3、CD300LG及ASF1B 5个基因为胃腺癌进展与预后的关键基因,其表达与免疫细胞浸润具有相关性,且可作为预后风险模型的相关风险因素。
ABCA8位于人类第17条染色体长臂2区4带2亚带(17q24.2),属ABC转运蛋白超家族成员,编码的蛋白质可能调节脂质代谢并参与髓鞘的形成和维持,然而最近发现其在部分肿瘤中发挥重要的功能作用。有学者在肝细胞癌中发现ABCA8表达下调,其过表达后抑制肝细胞癌的生长和转移,且低表达患者预后OS较长[7],这与本研究结果相同。ZHANG等[8]也发现ABCA8在肝细胞癌中表达下调,而低表达患者生存时间显著缩短。另有文献报道ABCA8通过激活ERK信号通路不但促进人胰腺癌细胞的迁移和侵袭,而且还显著降低了人胰腺癌细胞在体外和体内对吉西他滨的敏感性[9-10],这与陈静等[11]发现在骨肉瘤细胞中ABCA8参与耐药的结果一致。近期有学者在对乳腺癌的研究中发现ABCA8可通过调控AMP活化蛋白激酶/哺乳动物西罗莫司靶点信号通路抑制乳腺癌细胞增殖[12]。我们通过生物信息分析发现ABCA8在胃腺癌中也异常表达,参与肿瘤的进展、预后,与CD4+、巨噬细胞、树突状细胞的免疫浸润水平相关性较高。
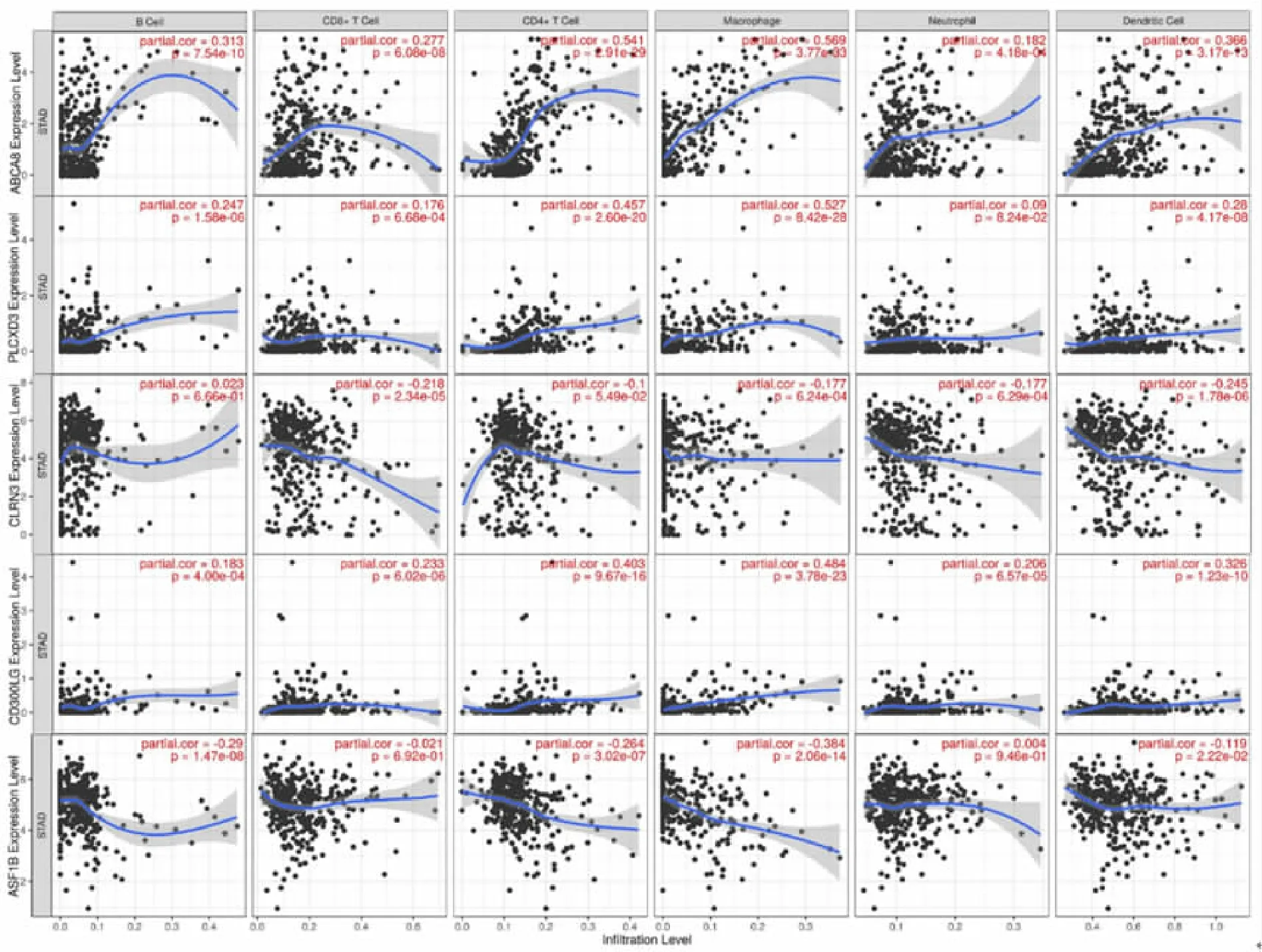
图8 TIMER 2.0数据库探讨关键基因表达与胃腺癌免疫细胞浸润水平相关性

图9 TISIDB数据库探讨关键基因表达与胃腺癌免疫细胞浸润丰度相关性
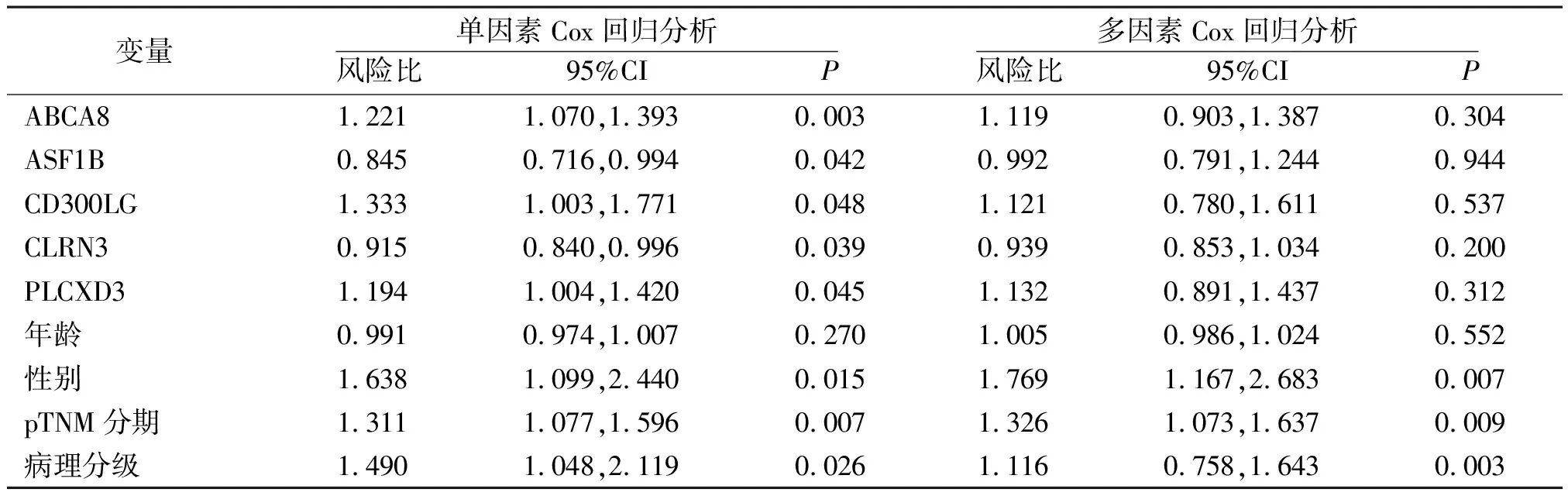
表4 胃腺癌患者关键基因预后风险模型单因素和多因素Cox回归分析
PLCXD3位于人类第5条染色体长臂1区3带1亚带(5q13.1),属磷酸肌醇特异性磷脂酶家族成员。此前,有研究发现胰腺β细胞中PLCXD3的低表达与关键胰岛素信号传导、胰岛素生物合成基因下调及葡萄糖感应降低有关,并且与代谢综合征风险相关[13-14]。近期有研究报道PLCXD3在尿路上皮癌中低表达[15],与本研究显示PLCXD3在胃腺癌中表达一致。此外,CHEN等[16]通过对胃腺癌转录组调控的综合基因组和表观基因组分析发现PLCXD3在侵袭性胃腺癌的发展中发挥了关键作用,免疫浸润分析其表达与CD4+、CD8+、巨噬细胞和中性粒细胞的富集水平呈正相关。本研究发现PLCXD3表达与CD4+、巨噬细胞、肥大细胞、激活B细胞和嗜酸粒细胞的浸润丰度相关性较高。
CLRN3位于人类第10条染色体长臂2区6带2亚带(10q26.2),编码一种细胞外泌体蛋白,主要富集在小肠、结肠、十二指肠、肝和肾等,现对其基因及蛋白研究甚少,其作用和功能尚不清楚。MALLANNA等[17]发现CLRN3在肝细胞分化的最后阶段高度富集。然而,ZENG等[18]研究分析证实CLRN3可能是子宫内膜癌的特定甲基化驱动基因,参与其发生机制,并且与OS显著相关。本研究首次发现CLRN3在胃腺癌中高表达,且高表达患者OS、DFS较长,与效应记忆CD8+、自然杀伤T细胞、1型T辅助细胞等免疫浸润丰度呈负相关。
CD300LG位于人类第17条染色体长臂2区1带3亚带1次亚带(17q21.31),编码一种包含单个免疫球蛋白V样结构域的Ⅰ型细胞表面糖蛋白。ZHAI等[19]发现CD300LG在肺癌中表达下调,可能导致免疫细胞杀伤功能受到抑制,导致癌细胞免疫逃逸;而另有报道显示CD300LG可提高细胞因子诱导杀伤的细胞毒活性[20]。此外,在乳腺癌[21]和急性髓系白血病[22]中也发现CD300LG表达下调。本研究首次发现CD300LG在胃腺癌中低表达,且低表达患者OS、DFS较长,与CD4+、巨噬细胞、树突状细胞、激活B细胞等免疫浸润丰度相关性较高。
ASF1B位于人类第19条染色体长臂1区3带1亚带2次亚带(19q13.12),属伴侣蛋白 H3/H4 家族的成员,编码的蛋白为细胞周期调节激酶类凌乱样激酶家族的底物,在调节染色质的核小体结构中发挥关键作用,其在肿瘤的表达与免疫浸润成为近年来研究的热点。OUYANG等[23]在肝细胞癌的研究中发现ASF1B高表达,高表达患者拥有低生存率,且与免疫细胞浸润显著相关。另外,在胶质瘤和胰腺癌中同样发现ASF1B表达显著升高,且是预后不良的因素[24-25]。本研究在胃腺癌患者中发现ASF1B高表达,且高表达患者预后较好,免疫浸润分析显示其表达与巨噬细胞、CD4+、B细胞等免疫浸润呈负相关。
总之,本研究基于TCGA、GTEx、GEPIA 2.0、StarBase v2.0、TIMER 2.0、TISIDB数据库及FunRich软件,以及从TCGA数据库获得胃腺癌的RNAseq数据(level3)和相应的临床信息,进行单因素和多因素Cox回归分析,发现ABCA8、PLCXD3、CLRN3、CD300LG及ASF1B 5个基因在胃腺癌中异常表达,且与预后相关,并与免疫细胞浸润具有相关性,可作为预后风险模型的相关风险因素,其中CLRN3和CD300LG是首次被报道在胃腺癌异常表达且参与肿瘤免疫细胞浸润。
