Ru掺杂MoS2对SO2F2和H2S气体吸附的第一性原理研究
2023-03-14张瑞恩陈林聪李欣然赵海龙符小桃范晓舟雷添翔
张瑞恩,陈林聪,李欣然,赵海龙,符小桃,范晓舟,雷添翔
(1.海南电网有限责任公司电力科学研究院,海口 570311;2.海南省电网理化分析重点实验室,海口 570311;3.华北电力大学,保定 071003)
0 引 言
SF6气体具有优异的物理化学性能、灭弧性能以及极强的绝缘性能,被广泛应用于电力行业中,比如气体绝缘组合电器(gas insulated switchgear, GIS)[1-3]。但在长期高压运行后,此类设备可能会产生绝缘缺陷,引起设备内部局部放电、火花放电或电弧放电等故障。SF6气体会发生分解并与微量氧气和水分二次反应生成SO2、SOF2和SO2F2,这不仅会降低SF6的绝缘性能,若这些有毒气体直接排放到大气中,还将对人类健康构成威胁[4-7]。在这些产物中,SO2F2和H2S占比较大。早期放电故障不易通过定期检查或离线检测等发现,而检测SO2F2和H2S可以有效反映放电故障的严重程度[4]。因此,检测SO2F2和H2S是判断SF6绝缘设备内部放电故障类型和严重程度的有效在线监测手段,为SF6气体绝缘设备的可靠运行提供保障。
MoS2作为二维(two dimension, 2D)层状纳米材料,具有良好的化学稳定性和热稳定性、高电子迁移率和稳定的半导体性能(其带隙为1.9 eV)[8-10],成为近年来类石墨烯二维材料的研究热点之一[11]。近期研究已经证明,与本征MoS2相比,过渡金属(transition metal, TM)掺杂的单层MoS2对气体分子的吸附性能大幅增强,因为掺杂原子可以有效调节MoS2表面的电子分配,在掺杂原子位置处发生电子密度局域化[12]。多项研究表明,掺杂TM的单层MoS2对CO和NO等常见气体具有快速的传感响应和高灵敏度[12-13]。研究者通过理论仿真研究了10种TM掺杂的MoS2对CO、NO、O2、NO2和NH3吸附性能的影响,发现与本征MoS2相比,掺杂表面对气体分子的化学活性和吸附性能有显著提高,吸附能可达3.12 eV[14]。另外,有研究表明Cu掺杂的单层MoS2对一些有毒气体具有化学吸附作用[12],这说明TM掺杂的单层MoS2(TM-MoS2)在气体传感应用中具有巨大潜力。
根据研究发现,TM掺杂的单层MoS2在吸附性能、化学活性和灵敏度方面比本征MoS2具有更优异的性能[14-16]。原因主要有两方面:1)TM原子掺杂引起的自由电子数量增加,可以提高单层MoS2的电导率;2)TM原子和气体分子之间的轨道杂化,可以使单层MoS2的气体吸附性能得到改善[17]。在众多TM元素中,钌(Ru)在气体相互作用中表现出很强的催化性能[18-20]。多项研究表明,单硫空位是非常常见的点缺陷结构,其中的硫空位可以被过渡金属原子替代填充[21-23]。因此可以预测,通过Ru原子空位掺杂的改性方式能提高单层MoS2吸附性能。本文基于第一性原理提出Ru掺杂的单层MoS2(Ru-MoS2)作为检测SF6的分解组分SO2F2和H2S的传感材料。通过吸附体系的几何构型、电子转移、态密度、能带结构,深入探索Ru-MoS2对SO2F2和H2S的气敏性能影响,阐明Ru-MoS2检测气体的气敏传感机制,为SF6分解组分的在线监测提供理论依据。
1 仿真模型的建立
基于密度泛函理论(density functional theory, DFT)的第一性原理,本文建立本征和Ru掺杂单层MoS2的模型,研究Ru-MoS2对SO2F2和H2S的气敏性能和传感机制。利用Materials Studio软件中的DMol3模块对单层Ru-MoS2的吸附模型进行几何优化计算,以保证模型结构的稳定性[24-26]。首先,建立SO2F2和H2S分子模型,进行几何优化以得到最稳定的分子结构,优化后气体分子结构如图1所示。然后从数据库中导出MoS2的最小晶胞,显示方式设置为球棍模型,取消模型的对称性,构建4×4×1的MoS2超晶胞结构模型并进行结构优化。然后建立Ru-MoS2晶面模型,几何优化后得到最稳定的掺杂结构。最后构建Ru-MoS2吸附优化后的气体分子模型,经优化后得到最稳定的吸附结构。
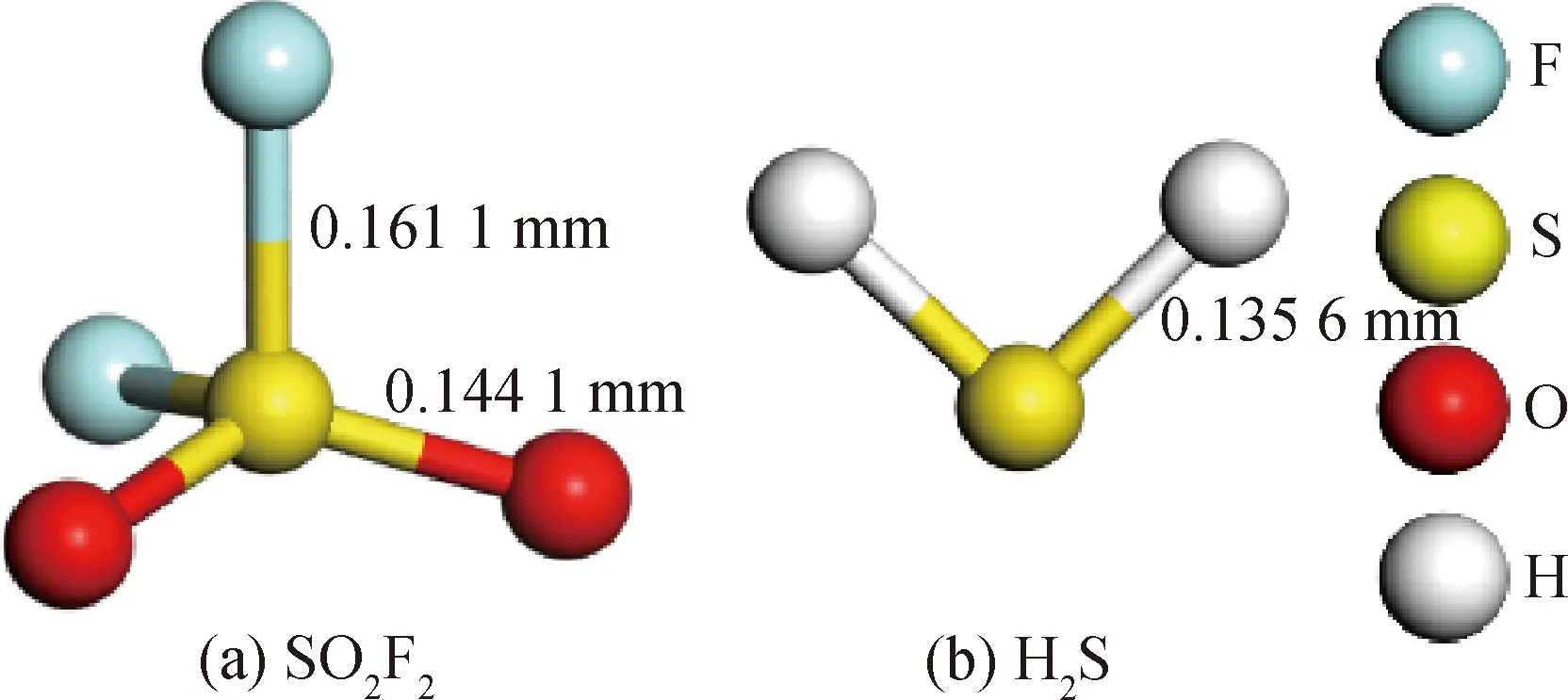
图1 气体分子的几何结构
本研究中所有的几何结构优化和计算均采用广义梯度近似(generalized gradient approximation, GGA)中的Perdew-Burke-Ernzerhof(PBE)泛函处理交换关联能[27-29]。考虑到范德瓦耳斯力对吸附效果的影响,本文采用GRIMME提出的DFT-D2方法来进行迭代过程的校正色散。在所有电荷密度和能量的计算中,布里渊区k点网格设置为10×10×1以提高计算的准确度[30]。迭代收敛的能量的最大差值、原子受力的最大值和原子的最大位移值分别设置为1×10-4Ha、2×10-3Ha/nm和5×10-3nm,自洽计算收敛条件、截止半径和展宽分别设置为10-6Ha、0.5 nm和0.005 Ha,以确保总能量的准确性。
4×4×1的MoS2超晶胞包含共32个S原子和16个Mo原子,真空区域设置为2 nm,以防止相邻单元之间的相互作用。根据先前的研究报告,优化的单层MoS2的晶格常数为0.318 nm。吸附体系中的吸附能(Ead)计算方式为:
Ead=ERu-MoS2/gas-ERu-MoS2-Egas
(1)
式中:ERu-MoS2/gas、ERu-MoS2和Egas分别为气体吸附体系、吸附前的Ru-MoS2和游离的气体分子的能量。若计算的Ead<0,则表示在气体吸附过程为放热反应,说明该反应能够自发进行,Ead的绝对值越大,说明吸附过程的总能量变化越大,表示晶面与气体分子之间的作用力越强。本研究采用Hirshfeld方法来分析气体分子与吸附表面之间的电荷转移(QT),并且仅讨论气体吸附的最稳定构型(most stable configurations, MSC)。
2 传感器吸附性能分析
2.1 Ru-MoS2及气体模型的结构分析
图1展示了两种气体SO2F2和H2S优化后的结构。从图1(a)可以看出,SO2F2分子中S—F和S—O的键长分别为0.161 1 nm和0.144 1 nm。由于H原子的半径小于F和O原子的半径,因此H2S分子中S—H的键长(0.135 6 nm)比图1(a)中SO2F2分子中S—F和S—O的键长短。
图2(a)和(b)分别展示了经优化后得到的Ru-MoS2的MSC和相关的差分电荷密度(electron density difference, EDD)的俯视图和正视图,以便更好地观察其结构和电子云。据研究表明,单硫空位是过渡金属二卤化物中最常见的点缺陷结构。在Ru-MoS2中,S空位比Mo空位的形成能低,因此,相比Mo空位来说,Ru原子更容易掺杂到S空位中。为确定Ru-MoS2的化学稳定性,计算了Ru原子和含S空位缺陷的单层MoS2间的Ead。根据计算结果,Ru-MoS2的结合强度(-4.78 eV)远大于本征MoS2,这表明其化学稳定性较本征MoS2大幅提高。本文利用Ru原子填充S空位,与相邻的Mo原子形成三个新的化学键,其键长均为0.264 7 nm。根据Hirshfeld法可以发现,Ru原子在Ru-MoS2体系中作为电子供体,在掺杂过程中,0.097 e从Ru原子转移到单层MoS2,其中Mo原子作为电子受体。如图2(b)所示,电子聚集主要集中在Mo原子和Mo—Ru周围,这说明了Mo—Ru的形成,而电子损失则主要集中在Ru原子周围。这些现象充分展现Ru原子与相邻原子间的电子杂化,这也与Hirshfeld分析结果一致。
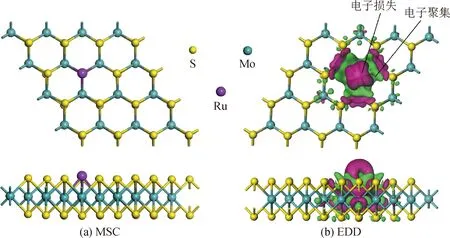
图2 Ru-MoS2的MSC和EDD
为进一步研究Ru原子掺杂对单层MoS2电子性能的影响,对Ru原子掺杂前后体系的能带结构(band structure, BS)、总态密度(total density of state, TDOS)和分波态密度(partial density of state, PDOS)进行了深入分析。多项研究表明,本征MoS2的带隙高达1.9 eV,具有显著的半导体特性,这意味着电子从价带跃迁到导带需要很大的能量。如图3(a)所示,由于Ru原子的掺杂,MoS2的带隙大幅降低至0.082 eV,说明单层MoS2的电导率升高。图3(b)展示了Ru原子掺杂单层MoS2的总态密度变化情况,Ru-MoS2的态密度相对本征MoS2向左移动,并且总态密度的形态与本征MoS2相似,这说明Ru原子的掺杂没有改变MoS2原本的晶体结构。另外,Ru-MoS2的费米能级附近产生了新的峰,说明电子更容易从费米能级左边跃迁到费米能级右边,即Ru原子的掺杂提高了单层MoS2的电导率。从图3(c)的分波态密度可知,Ru 4d和Mo 4d轨道在-6.25~1.9 eV处存在明显的重叠峰,表明轨道间存在强烈的杂化,也说明了Ru—Mo化学键的形成。
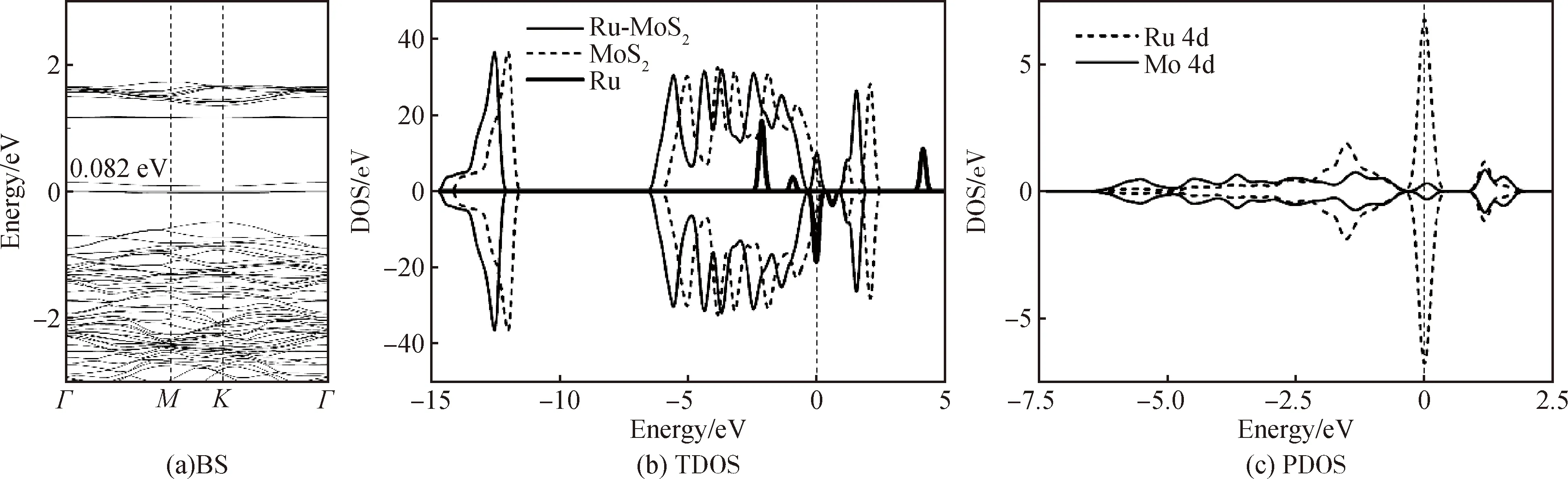
图3 Ru-MoS2体系的BS、TDOS和PDOS。BS中的值是带隙,DOS中的虚线是费米能级
2.2 Ru-MoS2对气体的吸附计算和结构分析
为探究Ru-MoS2对SO2F2和H2S的吸附性能,分别建立了其对两种气体的吸附模型,图4和5展示了两个吸附体系经优化计算得到的MSC和EDD。根据式(1)计算了SO2F2和H2S吸附体系的参数并列于表1中。其中,Ru-MoS2晶面与气体分子之间的QT表示气体被吸附后的电子携带数。QT为负值时表明气体分子从Ru-MoS2晶面接收电荷,说明气体吸附后,晶体电导率降低,电阻升高。QRu表示Ru原子在吸附体系中的携带电子数。

表1 Ru-MoS2吸附SO2F2和H2S的参数
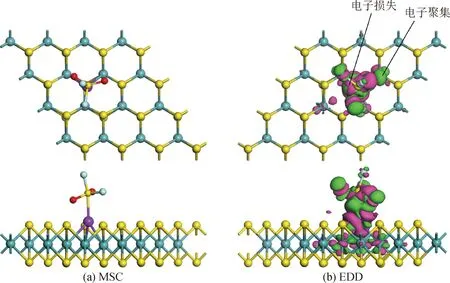
图4 Ru-MoS2/SO2F2体系的MSC和EDD
图4(a)为Ru-MoS2吸附SO2F2的MSC。可以发现,SO2F2分子被吸附在Ru-MoS2上,形成一个新的共价键,即Ru—S键,其键长为0.232 5 nm,这表明Ru原子和SO2F2分子之间存在很强的键合力。由图4(a)中的正视图可看出,在吸附SO2F2分子后,Ru原子的位置相比图2(a)发生了较明显的形变。由表1可知,SO2F2在Ru-MoS2上的吸附能为-1.52 eV,说明该吸附可以自发稳定进行,且吸附能大于临界值0.8 eV,该吸附被归为化学吸附,也反映了吸附作用的强烈。此外,SO2F2的吸附过程中QT为-0.237 e,说明0.237 e从Ru-MoS2转移到SO2F2分子,吸附体系的电导率降低。另一方面,Ru原子携带电子数为0.087 e,说明Ru原子在气体吸附过程中失电子,这与图4(b)中的电子杂化相一致。总之,在吸附过程中,Ru-MoS2的结构形变以及电子转移说明Ru原子掺杂可以促进Ru-MoS2与SO2F2分子之间化学反应的发生和电子的重新分配。
经优化后的Ru-MoS2吸附H2S气体分子的模型如图5所示。吸附后的H2S分子与晶面之间形成一个新的化学键,由于S原子的电负性较强,其离Ru原子较近,而H原子离Ru原子较远。Ru-MoS2吸附H2S分子的吸附能Ead为-2.11 eV,说明相比SO2F2,Ru-MoS2与H2S分子间具有更强的化学相互作用。根据Hirshfeld法计算得到QT为-0.159 e,表明H2S分子表现为电子受体,而Ru原子携带电子数为0.056 e,说明了Ru原子的失电子特性。如图5(b)所示,H2S分子和Ru原子间主要被电子损失区域所包围,这表明它们在气体吸附过程中失电子。而Ru—S键上大量的电子聚集区域说明Ru原子与S原子之间存在强烈的电子杂化并且反映了Ru—S键的形成,这与上述Hirshfeld分析结果一致。

图5 Ru-MoS2/H2S体系的MSC和EDD
2.3 Ru-MoS2对气体的吸附性能研究
图6显示了SO2F2和H2S吸附体系的能带结构和态密度,以更深入地探究Ru-MoS2晶面与气体分子间的相互作用。图6(a1)和(b1)分别为SO2F2和H2S吸附体系的能带结构。与Ru-MoS2体系相比,SO2F2和H2S体系中的带隙分别增加到0.086和0.091 eV,这说明吸附这两种气体后Ru-MoS2的电导率得到不同程度地降低,其中H2S吸附体系中电子跃迁难度更大,也说明Ru-MoS2对H2S气体分子的传感响应相较于SO2F2更强。
图6(a2)展示了SO2F2吸附系统的TDOS。从图中可以看出,TDOS曲线整体出现明显的右移,费米能级增大,电子跨越费米能级的难度增大,说明SO2F2吸附系统的电导率降低,这与能带分析的结果一致。吸附SO2F2气体分子后,SO2F2吸附系统的TDOS曲线与Ru-MoS2体系相比,在-9、-8.5、-7 eV附近出现了3个新峰。对照图6(a3)中的SO2F2的态密度图可知,SO2F2吸附系统的TDOS曲线的变化与吸附SO2F2有关。除此之外,气体吸附前后的曲线大部分一致,表现出Ru原子掺杂的强电子活性。由图6(a4)可知,SO2F2气体吸附前后波形的变化主要是由Ru 4d和S 3p之间的杂化引起的,Ru 4d轨道和S 3p轨道在-6.25~2 eV存在大量的重叠,说明了Ru和S原子间的强相互作用。
如图6(b2)所示,H2S吸附体系的TDOS曲线整体向左偏移,在-7.5 eV附近出现新的态密度峰,吸附H2S气体后Ru-MoS2晶面的态密度出现变化,说明H2S的吸附对单层的电荷分布有较大影响,导致晶面电导率发生变化,这是由于单层Ru-MoS2吸附了H2S气体分子,同时H2S分子的DOS曲线也相应产生形变。由图6(b4)可知,在H2S吸附体系中,由于Ru 4d轨道和S 3p轨道之间的杂化,在-7~1.5 eV具有明显的峰值重叠,其重叠区域大于SO2F2吸附系统中的Ru 4d轨道和S 3p轨道杂化的重叠区域,表明H2S体系中的轨道杂化程度更深,也说明Ru-MoS2吸附H2S气体分子的强度更大。

图6 SO2F2吸附体系(a1)~(a4)和H2S吸附体系(b1)~(b4)的BS和DOS。虚线是费米能级
综上所述,Ru-MoS2吸附SO2F2和H2S气体均为化学吸附,Ru-MoS2晶面吸附气体后导电性均降低,其中吸附H2S气体后导电性有更明显的降低,在实际的气体检测中材料对H2S气体的灵敏度更高。
2.4 Ru-MoS2的恢复性能研究
基于以上分析,可以发现Ru-MoS2对H2S和SO2F2分子的吸附性能都相当优异,均属于化学吸附,但相比于H2S,Ru-MoS2对SO2F2分子的吸附性能稍弱。因此,可以推断出H2S分子难以从Ru-MoS2上脱附,而SO2F2分子将更容易脱附。为了研究该气体传感器的可重复性,减少Ru-MoS2对气体解吸附的恢复时间(τ)对其潜在应用具有重要意义。恢复时间的理论计算公式如下所示:
τ=A-1e(-Ea/kT)
(2)
式中:A是尝试频率(1012s-1);T是温度;k是玻尔兹曼常数;Ea是势垒,在本文中等于Ead。由公式(2)可知,Ead越大,气体解吸附的难度会相应增加,而采取提高温度的方法可以有效地加速解吸附过程。因此,如图7所示,本文记录了不同气体在不同温度(298、448和598 K)下的恢复时间,根据温度对τ的影响来分析Ru-MoS2对气体的解吸附性能。

图7 两种气体吸附系统在不同温度下的恢复时间
如图7所示,在室温下,从Ru-MoS2上解吸附SO2F2和H2S相当困难,恢复时间随温度的升高而下降。可以发现,在598 K温度下,SO2F2吸附体系的恢复时间下降到6.40 s,这意味着Ru-MoS2这一气敏材料可以在598 K温度下重复使用。此外,由于SO2F2分子与Ru-MoS2的结合力较弱,SO2F2吸附体系在不同温度下的恢复时间都低于H2S体系。说明Ru-MoS2对H2S化学吸附更强。因此,对于SF6分解气体,Ru-MoS2是一种有前景的传感材料,可通过升高温度缩短恢复时间。
3 结 论
本文利用第一性原理探索Ru-MoS2对SF6分解产物中两种主要成分SO2F2和H2S的传感性能,以此判断该材料是否可以作为吸附这些气体的传感材料。对于该传感材料,Ru原子填充在单层MoS2的硫空位上,与相邻的Mo原子发生电子杂化。通过仿真计算可知,SO2F2和H2S吸附体系的Ead分别为-2.11和-1.52 eV,均归类为化学吸附。其中Ru-MoS2对H2S气体的吸附性能更强,BS和DOS分析进一步证实了这一点,同时本文也阐述了Ru-MoS2作为电阻式气体传感器在气体吸附时的传感机制。此外,本文计算了Ru-MoS2对SF6绝缘装置故障产生的SO2F2和H2S解吸附的恢复时间,展示了其在高温下的可恢复性。综上所述,Ru-MoS2对SF6分解气体SO2F2和H2S有很好的吸附性能,是一种很有前景的气体传感材料。
