胰腺实性假乳头状瘤肝脏转移 1例及文献复习
2023-03-14卢浩宁王智翔张小弟郑康
卢浩宁,王智翔,张小弟#,郑康
1西安医学院研究生处,西安 710068
2西安医学院附属陕西省核工业二一五医院普外科,陕西 咸阳 712000
胰腺实性假乳头状瘤(solid pseudopapillary tumor of the pancreas,SPTP)是一种较为罕见的低度恶性肿瘤,约占所有胰腺肿瘤的3%[1]。1959年Frantz首次发现并报道SPTP,近年来随着影像学技术的发展,对该病的认识及诊断有明显提升,SPTP的发病存在显著的性别差异,好发于青春期及育龄期女性,国内男女比为1∶5[2]。本文报道1例SPTP肝脏转移患者的病历资料并复习相关文献。
1 病历资料
患者女,46岁,以“发现胰腺占位2天”之主诉于2016年5月入院。入院前2天,体检发现胰腺体尾部占位性病变,无自觉不适。查体:体温36.5℃,脉率76次/分钟,呼吸频率20次/分钟,血压100/60 mmHg(1 mmHg=0.133 kPa),皮肤及巩膜无明显黄染,双肺呼吸音清,心率76次/分钟,律齐,各瓣膜听诊区未闻及病理性杂音。腹平坦,腹软,全腹无压痛,反跳痛阴性,未扪及包块,肠鸣音约4次/分钟。腹部CT:胰腺体尾部占位性病变,建议增强CT检查。实验室检查:白细胞4.33×109/L,血红蛋白124 g/L,血小板89×109/L,胆红素8.5 μmol/L,直接胆红素 5 μmol/l,总蛋白 51 g/L,白蛋白 33 g/L。肿瘤标志物:甲胎蛋白(alpha-fetal protein,AFP)3.6 ng/ml,癌胚抗原(carcinoembryonic antigen,CEA)1.34 ng/ml,糖类抗原 19-9(carbohydrate antigen 19-9,CA19-9)16.34 U/ml,糖类抗原 125(carbohydrate antigen 125,CA125)40.76 U/ml,糖类抗原72-4(carbohydrate antigen 72-4,CA72-4)0.87 U/ml。腹部B超:胰腺体尾部见5.5 cm×5.5 cm低回声包块,界清,形态规则,向外突起,周围有血流包绕,主胰管未见扩张。腹部增强CT:胰腺体尾部低密度病灶伴周围钙化,动脉期不均匀轻度强化,静脉期及延迟期病灶和包膜明显强化,脾动脉受压移位(图1),胃大弯及脾脏周围广泛侧支循环形成。积极术前准备,经多学科协作讨论后,在全身麻醉下行胰腺体尾部+脾脏切除术,手术顺利。术后病理:(胰腺体尾部)实性假乳头状瘤侵犯胰腺组织,伴神经侵犯并血管内瘤栓形成,胰腺断端未见肿瘤组织,周围淋巴结2枚未见转移,光镜下肿瘤细胞呈实性假乳头状(图2)。免疫组化:α-1抗胰蛋白酶(alpha1-anti-trypsin,AAT)(+),波形蛋白(vimentin,Vim)(+),β-联蛋白(β-catenin)核(+),突触素(synapsin,Syn)弱(+),细胞角蛋白7(cytokeratin 7,CK7)(-),嗜铬粒蛋白颗 A(chromogranin,CgA)(-),CD10弱(+)。术后血小板升高,经对症治疗后患者顺利出院。术后1个月,局部施行总剂量50 Gy放疗,定期复查。术后40个月复查增强CT示:肝脏多发低密度囊实性病灶,考虑SPTP肝脏转移(图3)。于2019年10月再次在全身麻醉下行肝脏转移瘤切除术,共切除转移瘤8枚。术后病理检查:(肝脏)SPTP多发转移。此后予以肝动脉栓塞化疗4次(氟尿嘧啶1 g+洛铂50 mg灌注,罂粟乙碘油20 ml栓塞1次;吡柔比星30 mg+洛铂25 mg灌注,吡柔比星10 mg+洛铂25 mg+罂粟乙碘油20 ml栓塞3次),随访至今,无瘤生存。

图1 SPTP肝脏转移患者的腹部增强CT图像
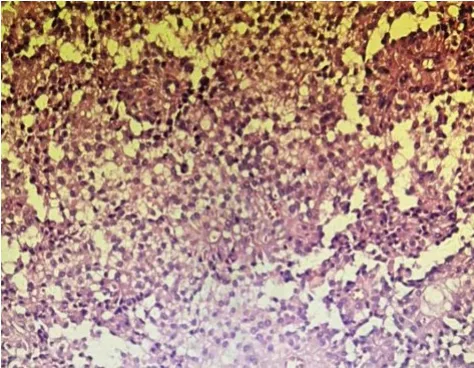
图2 SPTP肝脏转移患者的术后病理图片(苏木精-伊红染色,×100)
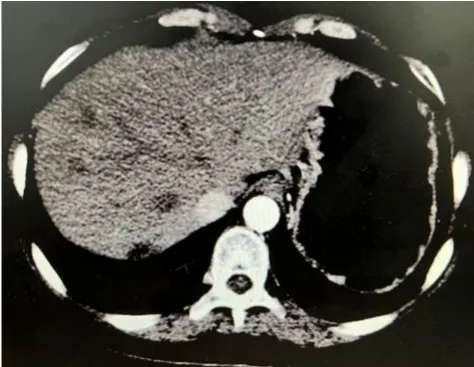
图3 SPTP肝脏转移患者的术后CT图像
2 讨论
SPTP的发病机制尚不清楚,主流观点认为其发病与WNT信号通路中β-catenin基因突变有关,联蛋白β1(catenin beta 1,CTNNB1)3 号外显子发生突变导致β-catenin磷酸化发生障碍,使其堆积在细胞核内与T细胞转录因子结合形成复合物,促使癌基因活化,导致该病发生[3]。
SPTP缺乏特异性症状,多数由体检发现或以腹部包块就诊,于成人胰腺体尾部多见,实验室检查肿瘤标志物无明显异常。CT是SPTP的主要术前诊断方法,“浮云征”可在囊性为主或囊实性比例相近的患者中出现[4],蛋壳状钙化是SPTP的典型表现,增强扫描实性成分及包膜发生强化。肿瘤包膜局灶不完整及边缘分叶状提示恶性征象,更易发生局部浸润或远处转移[5]。MRI鉴别SPTP瘤内出血、囊变及与周围组织的毗邻关系优于CT。
SPTP的诊断金标准仍是病理检查,镜下见均匀、单一肿瘤细胞围绕血管轴心构成“假乳头结构”[6]。SPTP的免疫组化呈多元化表达,可见AAT、Vim、β-catenin、Syn、神经元特异性烯醇化酶(neuron specific enolase,NSE)、CD10、CD56等,若Vim、β-catenin核阳性则很可能诊断为该病[4]。本例患者AAT(+),Vim(+),β-catenin核(+),Syn弱(+),CD10弱(+),符合SPTP诊断。10%~15%的SPTP患者可发生远处转移,肝脏是最常见的靶器官[7]。SPTP肝脏转移可在首次诊断或术后发现,影像表现与原发灶类似,但进展相对缓慢,转移灶多伴囊变,以囊实性肿块并假乳头结构为特点生长[8]。
手术是SPTP的首选治疗方法,手术治疗后患者的5年总生存率不低于95%[9],即使发生局部浸润或远处转移,术后仍可长期生存[10]。Yepuri等[11]研究发现,约2%的SPTP患者根治术后肿瘤复发,胰腺实质、血管、神经侵犯可能是影响预后的因素,即便没有以上征象,肿瘤也可表现为恶性。因此,预测SPTP的不良预后仍具挑战,对于复发或转移风险高的患者建议定期随访。手术后预防性局部放疗是否有助于减少局部复发尚无依据,本例患者放疗后未出现局部复发。肝脏是SPTP发生远处转移的常见靶器官,转移灶可与胰腺病灶同时诊断,也可术后复发,积极切除肝脏转移灶可使患者获得理想预后[12-13]。此外,辅助放疗、化疗或灌注化疗可使部分患者获益。本例患者原发灶及肝脏转移灶的诊断均符合上述病理研究及影像学特征,患者首次术后病理检查确诊为SPTP,定期复查,3年后发生肝脏转移,再次进行外科干预,此后予以经验性辅助治疗,截至目前无瘤生存,预后良好。
综上所述,SPTP是一种低度恶性肿瘤,肝脏是其远处转移的最常见部位,手术治疗是第一选择,此外局部放疗、常规化疗或灌注化疗可使患者获益。
