阿贝西利全程管理临床实践
2023-03-14邵彬李俏沈松杰郝晓鹏程琳郭宝良葛洁冀学宁吕铮马杰马力齐立强1石晶1史业辉1尹胜杰1王芳1徐玲1杨飏1杨华1张夕凉0张聚良1周金妹贺飞
邵彬,李俏,沈松杰,郝晓鹏,程琳,郭宝良,葛洁,冀学宁,吕铮,马杰,马力,齐立强1,石晶1,史业辉1,尹胜杰1,王芳1,徐玲1,杨飏1,杨华1,张夕凉0,张聚良1,周金妹,贺飞
1北京大学肿瘤医院暨北京市肿瘤防治研究所乳腺肿瘤内科,恶性肿瘤发病机制及转化研究教育部重点实验室,北京 100142
国家癌症中心/国家肿瘤临床医学研究中心/中国医学科学院北京协和医学院肿瘤医院2肿瘤内科,12乳腺外科,23药剂科,北京 100021
3中国医学科学院北京协和医院乳腺外科,北京 100730
4中国人民解放军总医院第一医学中心普通外科医学部,北京 100853
5北京大学人民医院乳腺中心,北京 100044
6哈尔滨医科大学附属第二医院乳腺外科,哈尔滨 150001
天津医科大学肿瘤医院7乳腺肿瘤一科,14乳腺内科,国家恶性肿瘤临床医学研究中心,天津市恶性肿瘤临床医学研究中心,乳腺癌防治教育部重点实验室,天津市肿瘤防治重点实验室,天津 300060
8大连大学附属中山医院肿瘤科,辽宁 大连 116001
9吉林大学第一医院肿瘤科,长春 130021
10唐山市人民医院乳腺疾病防治中心,河北 唐山 063001
11河北医科大学第四医院乳腺中心,石家庄 050011
13中国医科大学附属第一医院肿瘤内科,沈阳 110001
15赤峰市医院肿瘤内科,内蒙古赤峰 024000
16郑州大学第一附属医院乳腺外科,郑州 450052
17北京大学第一医院乳腺疾病中心,北京 100034
18北京大学肿瘤医院乳腺癌预防治疗中心,北京 100142
19河北大学附属医院肿瘤内科,河北省肿瘤放化疗机制与规程研究重点实验室,河北 保定 071000
20解放军总医院第六医学中心普通外科,北京 100048
21空军军医大学第一附属医院甲乳血管外科,西安 710032
22解放军总医院第五医学中心肿瘤学部,北京 100071
世界卫生组织(WHO)国际癌症研究机构发布的全球癌症负担数据显示,2020年全球乳腺癌新发病例高达226万例,已超过肺癌的220万例,成为女性发病率最高的恶性肿瘤。研究显示,中国女性乳腺癌的发病率和病死率虽然处于全球较低水平,但由于中国人口基数大,新发病例数和死亡病例数仍位居世界前列,女性乳腺癌发病例数占全球发病例数的11.2%,仅次于美国,且发病率增速为3.3%。最常见的乳腺癌亚型为激素受体(hormone receptor,HR)阳性(+)、人表皮生长因子受体2(human epidermal growth factor receptor 2,HER2)阴性(-),约占乳腺癌患者总数的70%[1-2]。
对于晚期HR+乳腺癌患者,因内分泌治疗相对于化疗的不良反应更少,疗效相对缓慢、持久,能明显改善患者的生活质量,故对于HR+、无明显内脏转移的晚期乳腺癌患者首选内分泌治疗[3]。但无论疗效如何,内分泌治疗都会出现耐药现象,具体的耐药机制尚未完全阐明,其中重要的机制包括细胞周期调控机制异常、生长因子信号通路异常等[4]。靶向治疗药物的出现为延缓甚至逆转内分泌治疗耐药提供了新思路。
细胞周期蛋白依赖性激酶(cyclin dependent kinase,CDK)4/6抑制剂的研发开启了内分泌治疗的新格局。目前CDK4/6抑制剂包括哌柏西利(Palbociclib)、利柏西利(Ribociclib)、阿贝西利(Abemaciclib)、达尔西利(Dalpiciclib)[5]。来自美国的真实临床实践中,超过50%的患者一线使用CDK4/6抑制剂+内分泌治疗,仅12.7%的患者一线使用化疗,二线治疗也有42.9%使用CDK4/6抑制剂+内分泌治疗[6]。
2018年2月26日,美国食品药品管理局(FDA)批准阿贝西利上市,与非甾体芳香酶抑制剂来曲唑或阿那曲唑联合用于一线治疗绝经后HR+HER2-晚期或转移性乳腺癌。2020年12月30日,国家药品监督管理局(National Medical Products Administration,NMPA)批准阿贝西利上市,成为国内第二个获批的CDK4/6抑制剂。在CDK4/6抑制剂辅助治疗早期乳腺癌的Ⅲ期临床试验中,MONARCH E是目前唯一取得阳性结果的研究。2021年12月31日,阿贝西利获得NMPA批准,用于HR+HER2-、淋巴结阳性、高复发风险且Ki-67≥20%早期乳腺癌患者的辅助治疗,成为国内首个且唯一被批准用于早期乳腺癌的CDK4/6抑制剂。
随着阿贝西利在国内患者使用比例的快速升高,为促进临床医师对于阿贝西利的临床管理,有针对性地介绍其药理特征、循证证据和不良事件,指导临床医师全周期的药物使用、疗效监测及不良反应管理有重要意义。
1 阿贝西利的作用机制及特点
乳腺癌原发和继发内分泌治疗耐药与细胞周期蛋白D(cyclin D)-CDK4/6信号通路的异常激活有关。CDK4/6通过与cyclin D形成复合物后被激活,最终促使细胞从G1期进入S期。而CDK4/6抑制剂选择性抑制CDK4/6与cyclin D复合物的结合,从而阻止细胞进入S期,使细胞有丝分裂停滞,抑制肿瘤细胞增殖。此外,CDK4/6抑制剂还可以阻断上游雌激素受体(estrogen receptor,ER)信号通路,与内分泌治疗存在协同增效作用,可延缓、逆转内分泌治疗的耐药性。
阿贝西利吸收缓慢,Tmax为8 h,绝对生物利用度为45%(90%CI:40%~51%),在每天2次重复给药后,5天内达到了稳态。阿贝西利主要通过细胞色素 P450 3A4(cytochrome P450 3A4,CYP3A4)代谢成多种代谢产物,N-脱乙基是主要代谢产物,其他代谢产物包括N-去乙基和N-去乙基羟基,这些循环代谢产物具有活性,效力与阿贝西利相似。约81%的阿贝西利剂量通过粪便排泄,约3%通过尿液排泄。年龄、体重、性别、种族、轻中度肝肾功能损伤对阿贝西利暴露无影响[7]。
2 阿贝西利的临床疗效
2.1 早期乳腺癌
一项随机Ⅲ期MONARCH E研究结果显示,在HR+HER2-、淋巴结阳性、高复发风险且Ki-67≥20%的早期成年乳腺癌患者中,与标准内分泌治疗相比,阿贝西利联合标准内分泌治疗可明显降低高危早期乳腺癌患者的复发风险;中位随访时间19个月,接受阿贝西利联合辅助内分泌治疗患者的复发风险降低 29%(HR=0.71,P=0.0009);随访27个月,无浸润性疾病生存时间(invasion diseasefree survival,IDFS)和无远处复发生存时间(distant relapse-free survival,DRFS)的改善率得以保持;中国亚组的安全性与总人群一致,也与阿贝西利治疗中国晚期乳腺癌的已知安全性一致[8]。因此,阿贝西利于2021年12月获得NMPA批准用于HR+HER2-、淋巴结阳性、高复发风险且Ki-67≥20%的早期乳腺癌患者,这是继HR+HER2-局部晚期或转移性乳腺癌后的又一新适应证。
2.2 复发转移性乳腺癌
一项Ⅱ期MONARCH 1初步研究结果显示,阿贝西利单药在既往多线治疗进展后的HR+HER2-、转移性乳腺癌患者中有较好的疗效和安全性,客观缓解率(objective response rate,ORR)达19.7%[9]。Ⅲ期MONARCH 2研究评价了内分泌治疗耐药的HR+晚期乳腺癌患者使用阿贝西利联合氟维司群与氟维司群单药的疗效和安全性,阿贝西利联合氟维司群治疗组患者的中位无进展生存期(progression-free survival,PFS)为 16.9个月,长于氟维司群单药治疗组患者的9.3个月(HR=0.536,P<0.001),ORR为48.1%,明显高于安慰剂组的21.3%(P<0.001)[10]。2019年欧洲肿瘤医学会议上报道了整体人群总生存期(overall survival,OS)的数据,与氟维司群单药相比,阿贝西利联合氟维司群组患者的OS明显延长(46.7个月vs37.3个月,HR=0.757,P=0.0137),且各亚组的生存获益一致,包括内脏转移患者。MONARCH 2的随访数据进一步奠定了CDK4/6抑制剂联合氟维司群在原发性及继发性内分泌耐药治疗领域的中坚地位。MONARCH 3研究结果显示,阿贝西利联合芳香化酶抑制剂(阿那曲唑或来曲唑)组患者的中位PFS为28.18个月,安慰剂联合芳香化酶抑制剂组的中位PFS为14.76个月;2018年2月,根据MONARCH 3研究获得的显著疗效,美国FDA批准阿贝西利联合非甾体类芳香化酶抑制剂一线治疗HR+HER2-绝经后晚期乳腺癌的适应证[11]。2022年欧洲肿瘤医学会议上报道,与安慰剂组相比,在接受阿贝西利治疗的意向治疗人群中,中位OS的临床获益延长了12.6个月(67.1个月vs54.5个月),在内脏转移亚组的人群中,中位OS延长了16.3个月(65.1个月vs48.8个月),且仍在进一步随访中[12]。
MONARCH plus Ⅲ期临床试验的对象大部分是中国乳腺癌患者,确认了阿贝西利治疗HR+HER2-晚期乳腺癌的疗效[13]。而Ⅱ期随机MONARCHER研究纳入既往曾接受过至少2种抗HER2治疗的HR+HER2+晚期乳腺癌患者,结果显示,阿贝西利、氟维司群和曲妥珠单抗联合应用显著改善了患者的PFS和OS,分别为8.3个月和31.1个月,同时显示出了可耐受的安全性。
3 阿贝西利的临床应用
3.1 阿贝西利的适应证
NMPA和美国FDA均批准了阿西贝利的以下适应证:①早期乳腺癌,阿贝西利联合内分泌治疗(他莫昔芬或芳香化酶抑制剂)用于HR+HER2-、淋巴结阳性、高复发风险且Ki-67≥20%的成年早期乳腺癌患者的辅助治疗。②局部晚期或转移性乳腺癌,阿贝西利用于HR+HER2-的局部晚期或转移性乳腺癌。③与芳香化酶抑制剂联合使用作为绝经后女性患者的初始内分泌治疗。④与氟维司群联合用于既往曾接受内分泌治疗后出现疾病进展的患者。
3.2 阿贝西利的用法
由于存在阿贝西利有效性降低的风险,应避免合并使用强效CYP3A4诱导剂;合并使用阿贝西利和CYP3A4抑制剂会升高阿贝西利的血浆浓度,如需合并使用强效CYP3A4抑制剂,请参考说明书调整剂量。注意:强效CYP3A4诱导剂包括但不限于卡马西平、苯妥英、利福平和圣约翰草;强效CYP3A4抑制剂包括但不限于克拉霉素、伊曲康唑、酮康唑、洛匹那韦/利托那韦、泊沙康唑或伏立康唑。
对于老年人、轻度/中度肝功能损伤、轻度/中度肾功能损伤患者无需调整剂量。在重度肝功能损伤患者中,建议降低给药频率至每日1次;尚无重度肾功能损伤、终末期肾脏疾病或接受透析患者的数据。阿贝西利对于HR+HER2-乳腺癌的临床适用人群见图1。
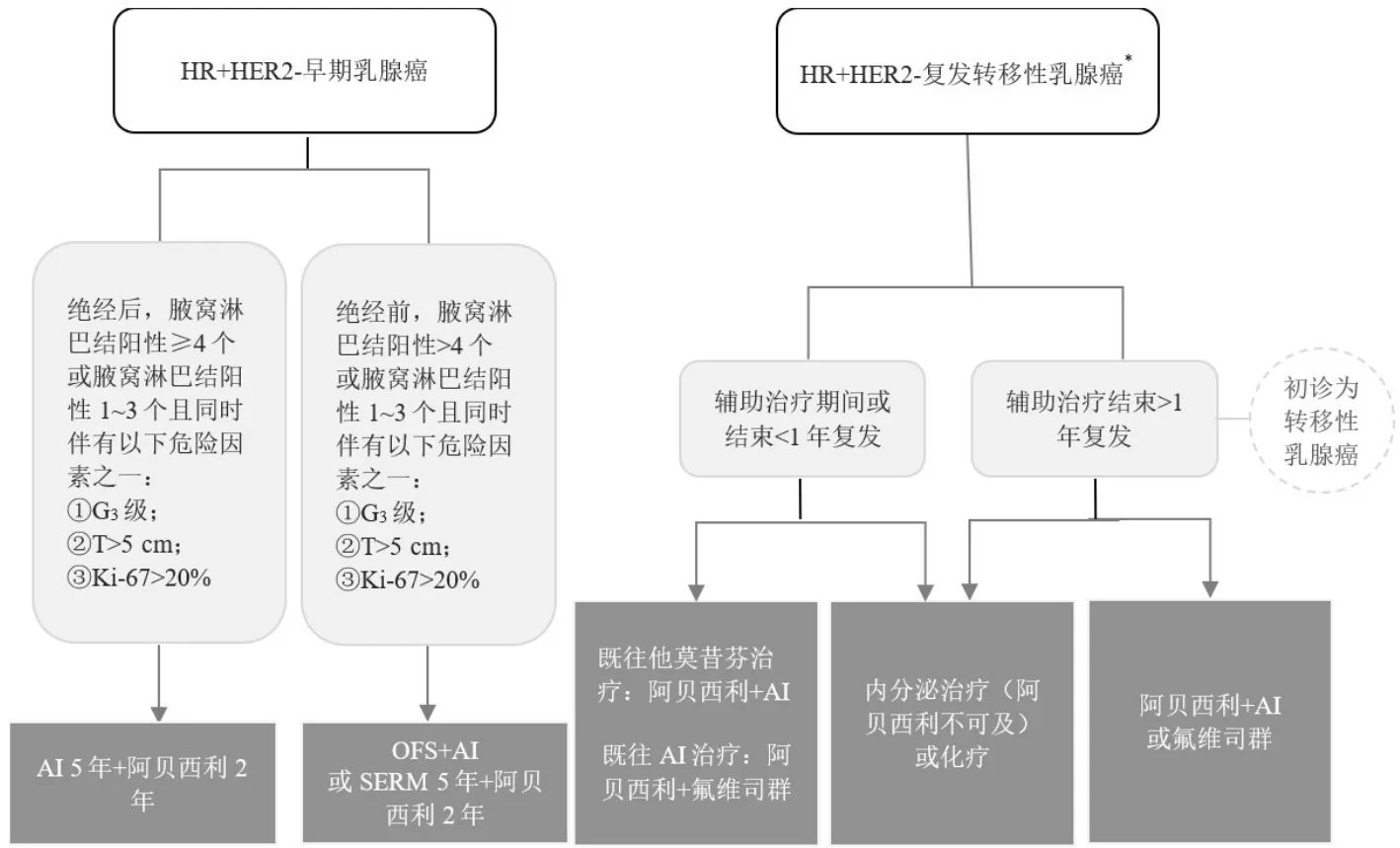
图1 阿贝西利对于HR+HER 2-乳腺癌的临床适用人群
3.3 临床治疗期间临床指标监测及频率
根据美国FDA药品说明书[14-16],开始阿贝西利治疗前、治疗最初2个月每2周1次、后续2个月每次治疗开始前及出现临床指征时应进行临床指标监测。对于出现腹泻的患者,建议在首次出现稀便时开始抗腹泻治疗,增加口服补液。此外,还需要监测患者是否具有静脉血栓形成和肺栓塞的症状和体征,必要时进行适当的治疗。不需要常规监测心电图。
4 阿贝西利所致不良反应
阿贝西利联合内分泌治疗临床研究中最常发生的不良反应包括腹泻、感染、中性粒细胞减少症、白细胞减少症、贫血、疲乏、恶心、呕吐、脱发和食欲下降。阿贝西利的总体安全性特征评估来自HR+HER2-晚期或转移性乳腺癌随机研究中接受阿贝西利联合内分泌治疗(来曲唑、阿那曲唑或氟维司群)的768例患者的合并数据(包括MONARCH 3、MONARCH 2研究)。(表1)
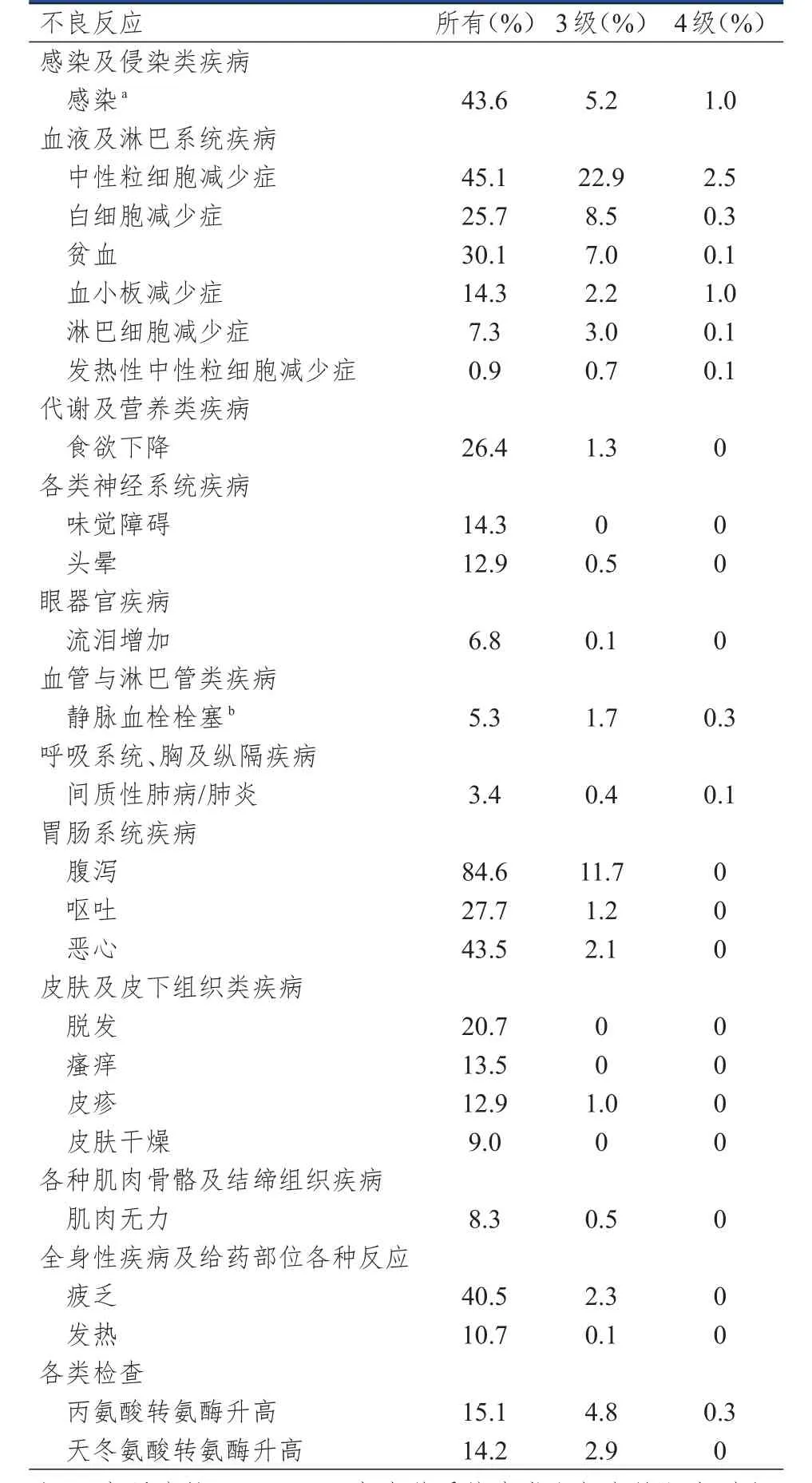
表1 阿贝西利联合内分泌治疗Ⅲ期研究中的不良反应发生情况( n=768)
5 阿贝西利所致常见不良反应的管理及干预措施
5.1 腹泻
5.1.1 临床表现及分级标准主要表现为大便性状改变(即稀便、水样便、黏液脓便、脓血便)和大便次数增多,严重时可出现重度脱水和中毒症状。依据常见不良反应事件评价标准4.0.3版(common terminology criteria for adverse event version 4.0.3,CTCAE 4.0.3)[17]对阿贝西利导致的腹泻进行分级。(表2)

表2 阿贝西利所致腹泻CTCAE 4.0.3分级标准
5.1.2 发生特点MONARCH 2和MONARCH 3研究的合并数据中,阿贝西利联合内分泌治疗所致腹泻的发生率在治疗第1个月最高,随后降低。首次发生腹泻的中位持续时间为6~8天,2级腹泻的中位持续时间为9~12天,3级腹泻的中位持续时间为6~8天。MONARCH E研究中,因腹泻导致的停药发生率为5.1%[18-19]。
5.1.3 患者教育确保患者开始治疗前了解腹泻的特点,指导患者在第一次出现稀便时就应开始抗腹泻药物治疗,增加口服补液,抗腹泻治疗24 h内监控腹泻缓解情况,如有必要根据推荐进行相应剂量调整。饮食宜均衡,忌辛辣等刺激食物,减少高纤维、高脂肪类食物,以尽量减少对肠道的刺激,必要时请营养师制订饮食计划。
5.1.4 剂量调整推荐应在第一次出现稀便时开始抗腹泻药物的支持治疗,如咯哌丁胺,起始剂量4 mg,每天最大剂量不超过16 mg。1级腹泻不需要调整剂量;2级腹泻如果毒性未在24 h内降低至1级或以下,暂停给药直至恢复,不需要降低剂量;对于采取最大支持措施,但仍持续不缓解的2级毒性,或在以相同剂量重新开始治疗后复发的2级毒性,暂停给药直至毒性降低至1级或以下,重新开始给药时应降低1个剂量水平;3级或4级毒性,或需要住院治疗的患者,暂停给药直至毒性降低至1级或以下,重新开始给药时应降低1个剂量水平。
5.2 血液学毒性
5.2.1 临床表现及分级标准白细胞减少症或中性粒细胞减少症表现为白细胞或中性粒细胞计数减少或感染症状,包括高热、寒战;贫血表现为血红蛋白低于正常值下限,皮肤和黏膜苍白、疲乏、困倦、软弱无力、头晕、心悸、气促,活动后明显加重;血小板减少症表现为血小板计数减少,皮肤出血点、瘀斑、鼻衄、牙龈或内脏出血。依据CTCAE 4.0.3[17]对阿贝西利所致血液学毒性进行分级。(表3)

表3 阿贝西利所致血液学毒性的CTCAE 4.0.3分级标准
5.2.2 发生特点MONARCH 2和MONARCH 3研究的合并数据中,阿贝西利联合内分泌治疗中性粒细胞减少症出现至≥3级中性粒细胞减少症的中位时间为29~33天,至中位缓解时间为11~15天,≥3级中性粒细胞减少症发生率约为25%;其他血液学毒性,如≥3级白细胞减少、贫血、血小板减少的发生率均<10%。
5.2.3 患者教育开始治疗前,患者应明确阿贝西利容易出现白细胞减少特别是中性粒细胞减少。建议中性粒细胞绝对值(absolute neutrophil count,ANC)≥1500/mm3、血小板计数≥100 000/mm3且血红蛋白≥8 g/dl才可开始使用阿贝西利。治疗最初2个月内每2周1次,接下来2个月内每月1次监测血液学指标,若出现明显白细胞、中性粒细胞、血红蛋白、血小板下降,应尽快咨询医师处理。
5.2.4 剂量调整推荐1级或2级血液学毒性无需调整剂量;3级血液学毒性暂停给药,直至毒性降低至2级或以下,不需要降低剂量;复发的3级或4级血液学毒性暂停给药,直至毒性降低至2级或以下,重新开始给药时应降低1个剂量水平;如果患者需要接受血细胞生长因子治疗,在最后1次血细胞生长因子给药后暂停阿贝西利给药至少48 h且毒性降低至2级或以下,重新开始给药时应降低1个剂量水平;如因毒性使用血细胞生长因子时已降低剂量,则不需要再次降低剂量。
5.3 静脉血栓栓塞(venous thromboembolism ,VTE)
5.3.1 临床表现及分级标准VTE表现为手臂或腿部疼痛或肿胀、气短、胸痛、呼吸急促、心率加快。依据CTCAE 4.0.3[17]对阿贝西利所致VTE进行分级:1级,不需要医学干预,如浅表性血栓形成;2级,需要医学干预;3级,需要医学紧急干预,如肺栓塞或心腔内血栓;4级,血流动力学或神经性障碍,危及生命;5级,死亡。
5.3.2 发生特点中国患者为主的MONARCH plus研究中,阿贝西利联合非甾体芳香化酶抑制剂(non-steroidal aromatase inhibitor,NSAI)所致 VTE的发生率为2.0%,均为1级或2级不良事件;阿贝西利联合氟维司群所致VTE的发生率为3.8%,其中仅1例出现3级不良事件[13]。MONARCH E研究中,阿贝西利联合内分泌治疗所致任意级别VTE的发生率为2.5%,停药率为0.5%,该研究4级VTE共发生6例(0.2%),主要为肺栓塞(3例)。当他莫昔芬作为初始内分泌治疗给药时,VTE的发生率更高[18]。MONARCH E研究观察到初次VTE的中位发生时间<6个月,94%的VTE患者接受了抗凝治疗[20]。
5.3.3 患者教育患者应警惕深静脉血栓形成和肺栓塞的症状和指征,若出现四肢疼痛或肿胀、呼吸短促、胸痛、呼吸急促和心动过速,应及时就诊。
5.3.4 剂量调整推荐如确诊VTE,立即中断治疗并请相关科室进行干预;如果VTE没有危及生命,可以继续抗肿瘤治疗,结合抗血栓治疗。
5.4 肝损伤
5.4.1 临床表现及分级标准肝损伤表现为疲乏、腹痛、食欲降低、容易出血或瘀伤。依据CTCAE 4.0.3[17]对阿贝西利所致肝损伤进行分级。(表4)
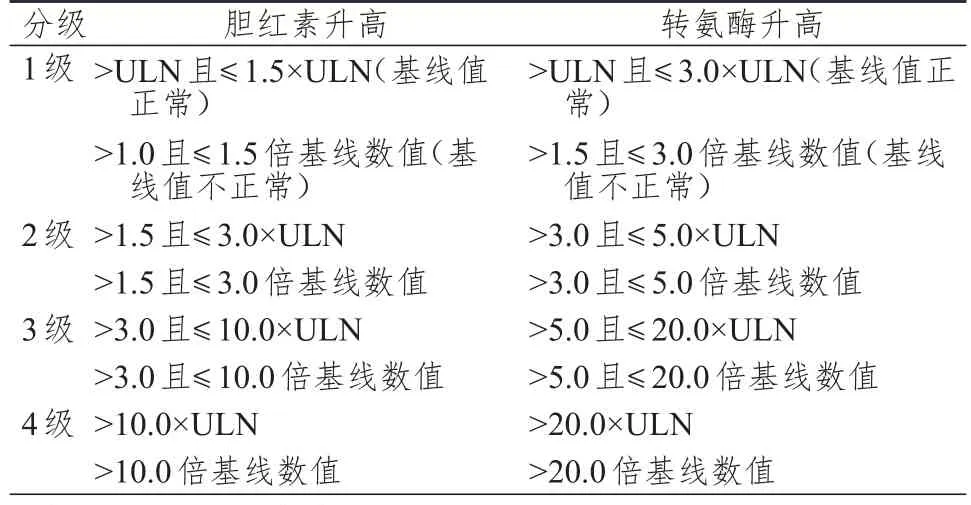
表4 阿贝西利所致肝损伤的CTCAE 4.0.3分级标准
5.4.2 发生特点以中国患者为主的MONARCH plus研究中阿贝西利联合内分泌治疗导致≥3级转氨酶升高发生率<6%。阿贝西利联合NSAI,≥3级丙氨酸转氨酶(alanine aminotransferase,ALT)和天冬氨酸转氨酶(aspartate aminotransferase,AST)升高发生率分别为5.9%和4.4%;阿贝西利联合氟维司群,≥3级ALT和AST升高发生率分别为5.8%和2.9%。MONARCH 2和MONARCH 3研究的合并数据中,阿贝西利联合内分泌治疗所致≥3级转氨酶升高的中位时间>57天,至缓解的中位时间<15天[21]。MONARCH E研究中,2.6%和1.6%的患者发生3级或4级ALT或AST升高(基于实验室检查结果)。
5.4.3 患者教育告知患者肝损伤的风险,若出现四肢疼痛或肿胀、呼吸短促、胸痛、呼吸急促和心动过速,应及时就诊。治疗最初2个月内每2周1次监测转氨酶及胆红素,接下来2个月内每月1次;出现明显转氨酶升高或胆红素升高应及时就诊。
5.4.4 剂量调整推荐1级[>正常值上限(upper limit of normal,ULN)且≤3.0×ULN)]或2级(>3.0且≤5.0×ULN)转氨酶升高不伴随总胆红素>2倍ULN,不需要剂量调整;持续性或复发性2级或3级(>5.0且≤20.0×ULN)转氨酶升高且不伴随总胆红素>2倍ULN,暂停给药,直至毒性降低至基线或1级,重新开始给药时应降低1个剂量水平;在没有胆汁淤积的情况下,AST和/或ALT升高>3倍ULN,伴总胆红素>2倍ULN,终止阿贝西利治疗;4级(>20.0×ULN)转氨酶升高,终止阿贝西利治疗。
5.5 间质性肺疾病(interstitial lung disease ,ILD)
5.5.1 临床表现和分级标准ILD表现为呼吸困难或气短,咳嗽伴或不伴咳痰,胸痛。依据CTCAE 4.0.3[17]对阿贝西利所致VTE进行分级:1级,无症状,仅临床检查或诊断发现,不需要干预;2级,有症状,需要干预,影响日常生活活动;3级,重度症状,个人自理能力受限,需要吸氧;4级,危及生命的呼吸障碍,需要紧急治疗,如气管切开或插管;5级,死亡。
5.5.2 发生特点MONARCH E研究纳入的阿贝西利联合内分泌治疗患者中,大多数ILD/肺炎不良事件为1级,主要是肺炎,共10例(0.4%)患者发生3级不良事件和1例致命事件,多数(82%)≥3级ILD/肺炎为严重不良事件(如需要住院治疗),约50%发生在治疗早期[18-20]。
5.5.3 患者教育患者应警惕ILD的症状和指征,若出现呼吸困难或气短、咳嗽伴或不伴咳痰、胸痛,应及时就诊。应根据临床指征开始适当的药物干预和监测。
5.5.4 剂量调整推荐如果出现疑似由ILD/非感染性肺炎引起的新发或恶化的呼吸道症状,则应中断治疗并进行评价;若为1级无症状的不良反应,无需调整剂量,根据临床指征开始适当的药物干预和监测;若为2级有症状的不良反应,暂停给药直至恢复至≤1级,降低1个剂量水平,如果再次出现2级不良反应,终止治疗;3或4级不良反应,终止治疗。
5.6 血清肌酐升高
5.6.1 临床表现及分级标准血清肌酐升高由实验室检查发现,阿贝西利导致肌酐排出受到抑制导致临床上观察到肌酐的升高,无明显症状。依据CTCAE 4.0.3[17]对阿贝西利所致血清肌酐升高进行分级。(表5)

表5 阿贝西利所致血清肌酐升高的CTCAE 4.0.3分级标准
5.6.2 发生特点阿贝西利通过抑制肾小管分泌转运蛋白而非影响肾小球功能(根据碘海醇清除率判断)使血清肌酐升高;血清肌酐升高发生于第1个月给药期间,在治疗期间保持升高水平但处于稳定状态;终止治疗后可逆转,且未伴随肾功能标志物[如血尿素氮(blood urea nitrogen,BUN)、胱抑素C或根据胱抑素C计算的肾小球滤过率]的变化。
5.6.3 患者教育告知患者肌酐升高的风险,尤其对于老年或既往伴有肾功能损伤的患者,治疗最初2个月内每2周1次,接下来2个月内每月1次监测肌酐水平,若出现明显肌酐明显升高及时就诊。
5.6.4 剂量调整推荐1级或2级不良反应无需调整剂量;采取最大支持治疗后,未在7天内降低至基线或1级的持续性或复发性2、3、4级不良反应,应暂停给药,直至毒性降低至1级或以下。重新开始给药时应降低1个剂量水平。
6 小结
CDK4/6抑制剂联合内分泌治疗为乳腺癌患者带来了明显的生存获益。阿贝西利循证证据充分,指南共识度高,不良反应管理方便,可及性好,中国各大指南和共识均进行了一致推荐。该全程管理临床实践为患者全程用药提供了指导,改善了患者的生活质量。
