基于生物信息学及分子对接技术探究羌活胜湿汤治疗强直性脊柱炎的作用机制∗
2023-03-14李金政霍凤蕾李志超邱红明
李金政,霍凤蕾,李志超,邱红明
1 山东中医药大学中医学院,山东 济南 250014; 2 山东大学,山东 济南 250100;3 山东中医药大学,山东 济南 250355; 4 山东中医药大学附属医院,山东 济南 250000
强直性脊柱炎(ankylosing spondylitis,AS)是与人类白细胞抗原有相关性的、以骶髂关节和脊柱附着点炎症为主要症状的自身免疫系统疾病[1]。骶髂关节是本病最早累及的部位,主要表现为滑膜炎、软骨变性、骨破坏等,晚期可致脊柱僵直和畸形,致残率极高[2]。目前西医在临床上通常采用免疫抑制类药物、糖皮质激素、生物制剂等治疗AS,但均存在严重的不良反应[3]。随着中医学的发展,中药治疗AS的安全性和有效性得到了广泛的认可,受到国内外越来越多的关注。
AS属于祖国医学“痹证”“背偻”等范畴。《素问·痹论篇》中记载:“风寒湿三气杂至,合而为痹也……肾痹者,善胀,尻以代踵,脊以代头。”[4]其描述的症状与AS晚期脊柱僵直、畸形等临床症状相符合。羌活胜湿汤最早见于金代李东垣所著《内外伤辨惑论》,由羌活、独活、川芎、甘草、蔓荆子、藁本、防风等七味药组成。方中羌活、独活祛风除湿、通利关节;川芎与羌活配伍,活血祛风,透关利节,治疗督脉为病,脊强而厥;防风、藁本、蔓荆子祛风止痛;甘草调和诸药,共奏祛风逐湿之功。羌活胜湿汤可有效地缓解AS患者疼痛、僵硬、屈伸不利等症状,是治疗风寒湿痹阻所致的AS、风湿性关节炎、类风湿性关节炎等疾病的经典名方,在临床上取得了满意的疗效[5]。
本研究基于生物信息学技术及分子对接技术,科学系统地探究羌活胜湿汤治疗AS的作用机制,为该方的临床应用提供理论支持,并进一步探索中药组方治疗AS的新方向与新思路。
1 资料与方法
1.1 GEO基因芯片数据分析AS差异表达基因以“ankylosing spondylitis”为关键词检索GEO数据库并确定芯片号为GSE41038的数据集,该数据集包含了8个属于AS及分类未定脊柱炎的膝关节滑膜组织样本为实验组,7个属于骨关节炎及健康正常组织的膝关节滑膜组织样本为对照组。采用生物信息学中RMA(robust multiarray average)算法背景校正和矩阵数据归一化处理其原始文件,并利用R语言中limma包分析该数据集,结合P值和差异倍数(fold change,FC)进行筛选,将显著差异基因的筛选条件设置为P<0.05,logFC绝对值>0.5,最终获得AS的差异表达基因。
1.2 AS疾病靶基因预测以“ankylosing spondylitis”作为关键词,采用疾病基因数据库(DisGeNET)、人类基因数据库(GeneCards)、孟德尔遗传综合数据库(OMIM)、疾病数据库(MalaCards)等多个数据库对AS已知靶基因进行查找筛选。将合并后的疾病靶基因与R语言分析芯片获得的差异表达基因取并集,删除重复的靶基因后,即获得已明确的AS发病过程的疾病靶点。
1.3 羌活胜湿汤有效成分筛选及靶点预测通过中药药理学平台(TCMSP),以羌活、独活、川芎、甘草、蔓荆子、藁本、防风等七味中药检索其化学成分,并以口服生物利用度(oral bioavailability,OB)≥30%和类药性(drug likeness,DL)≥0.18作为筛选条件,将获得的具有较高活性化合物导入蛋白质数据库(Unitprot)进行处理。利用Cytoscape 3.7.2软件,构建其有效成分的靶点网络图,并进行网络拓扑分析。
1.4 羌活胜湿汤治疗AS关键靶基因筛选将所筛选的羌活胜湿汤潜在靶基因与“1.2”项获取的AS疾病靶基因交叉生成Venny图,得出羌活胜湿汤治疗AS的映射靶基因。抽取映射靶基因,借助Cytoscape 3.7.2软件构建羌活胜湿汤治疗AS的作用靶点PPI网络图,根据节点连接度(degree)值进行筛选,得到羌活胜湿汤治疗AS的关键靶基因,揭示羌活胜湿汤治疗AS的关键机制。
1.5 生物通路及富集分析将“1.4”项筛选出的关键靶基因导入基因注释数据库(DAVID),进行KEGG(kyoto encyclopedia of genes and genomes)通路分析以及GO(gene ontology)生物过程的富集分析。将筛选条件设置为P≤0.05,FDR≤0.05,且分别将筛选出的前10个GO条目与KEGG条目借助R语言ggplot2包绘制富集分析气泡图。
1.6 分子对接从有机小分子生物活性数据库(Pubchem)下载“1.3”项筛选出的羌活胜湿汤主要有效成分的化合物结构,从蛋白质数据库(RCSB PDB)下载“1.4”项筛选出的关键靶基因的蛋白质结构。使用Mgltools工具,通过加氢、计算电荷、合并非极性氢后,作为对接配体。设置Grid Box坐标和盒子大小,通过Autodock Vina 1.1.2工具进行分子对接,得分越低说明其对接的活性越好,并使用Pymol 2.3工具作图分析。
2 结果
2.1 AS相关差异表达基因检索通过AS差异表达基因分析结果显示,发现704个mRNA存在差异表达,其中上调280个,下调424个,用R语言中heatmap与limma程序包绘制芯片原始的差异基因热图与火山图。见图1-2。
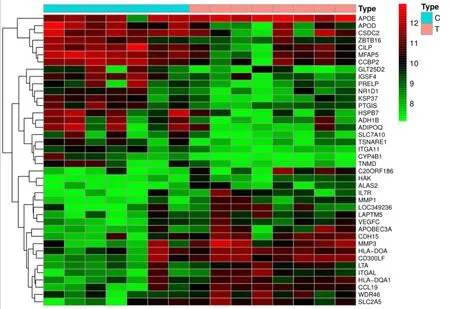
图1 AS相关芯片差异基因聚类图
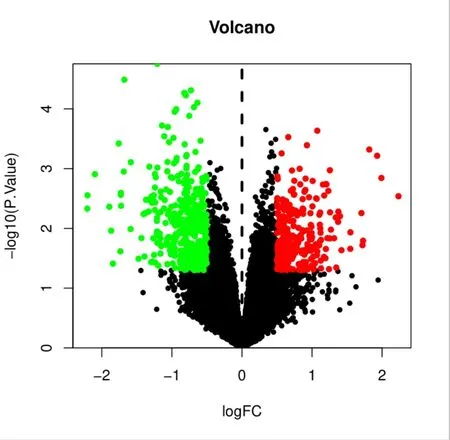
图2 AS相关芯片差异基因火山图
2.2 筛选AS疾病靶基因采用“1.2”项所述多个数据库,对AS已知靶基因进行检索与筛选,合并后共获得1323个疾病靶基因,将合并后的疾病靶基因与704个差异表达基因取并集并删除重复值,获得已明确的AS发病过程的疾病靶点共1950个。
2.3 羌活胜湿汤有效成分及作用靶点以OB≥30%,DL≥0.18为筛选标准,在TCMSP数据库共检索到七味中药活性成分共计176个,其中羌活17个、独活11个、川芎7个、蔓荆子27个、藁本1个、防风20个、甘草93个,相对应靶点共计3490个,删除重复值后得到羌活胜湿汤最终靶点137个。借助Cytoscape构建羌活胜湿汤中七味药物的有效成分-靶点网络图,见图3。分析可知,槲皮素、β-谷甾醇、山柰酚、异紫花前胡内酯、欧前胡素等潜在的活性成分自由度较高,与多个作用靶点相互关联,说明这些化合物是羌活胜湿汤治疗AS的主要有效成分。
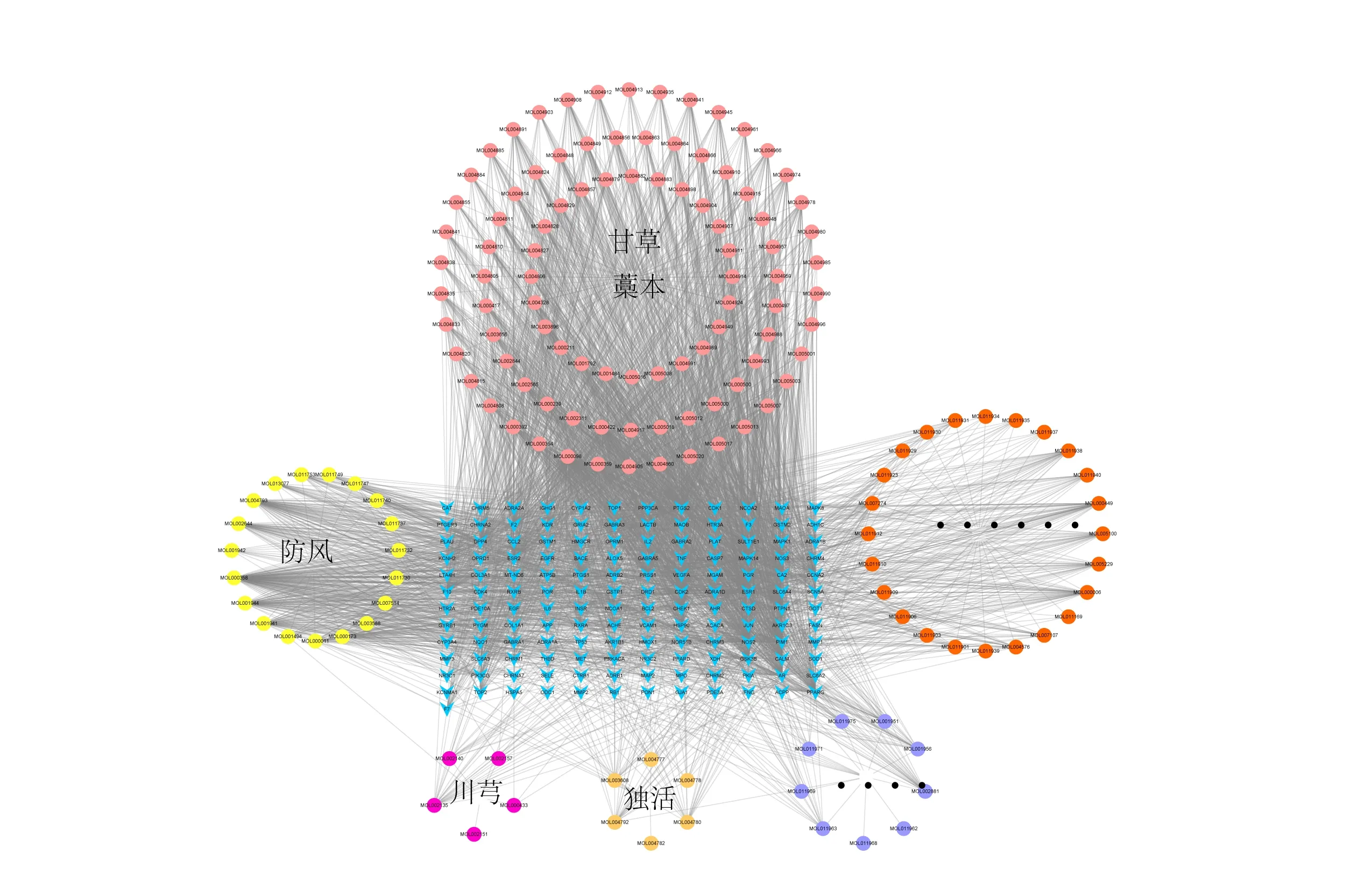
图3 羌活胜湿汤有效成分-靶点网络图
2.4 羌活胜湿汤治疗AS的PPI网络图将筛选的羌活胜湿汤潜在137个靶基因与“2.2”项获取的1950个AS疾病靶基因交叉生成Venny图,见图4,通过Venny图可以直观发现羌活胜湿汤对AS的靶基因映射率为2.3%,该方共有137个有效靶点,其中映射靶点46个,作为羌活胜湿汤治疗AS的直接或间接作用靶标基因,占据该方作用靶点的33.5%左右,表明该复方在治疗AS方面具有显著特异性。将这46个映射靶基因导入Cytoscape3.7.2软件,构建羌活胜湿汤治疗AS的作用靶点PPI网络图,根据节点连接度(degree)≥20为条件进行筛选,得到羌活胜湿汤治疗AS的关键靶基因13个,见表1。所获取的关键靶基因则是发挥治疗AS作用的关键靶点,揭示出羌活胜湿汤治疗AS的关键机制。

表1 羌活胜湿汤治疗AS关键靶基因信息
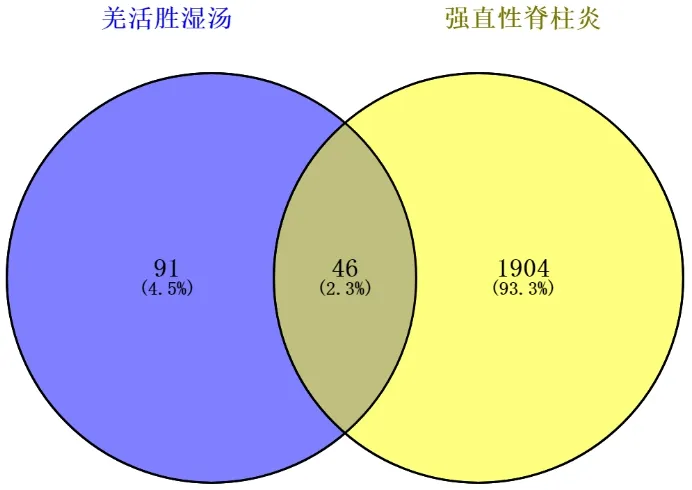
图4 “羌活胜湿汤-AS”映射靶基因Venny图
2.5 GO生物过程结果及KEGG通路富集分析对“2.3”项获得的13个关键靶基因采用DAVID数据库进行GO生物过程和KEGG信号通路分析,得到分子功能、生物过程和细胞成分条目161个,KEGG通路55条,将筛选条件设置为P≤0.05,FDR≤0.05,并以P值升序排列,获得排名前10的生物过程和10条信号通路,并将其以气泡图的形式展现出来,见图6。

图5 羌活胜湿汤治疗AS关键靶基因PPI网络图
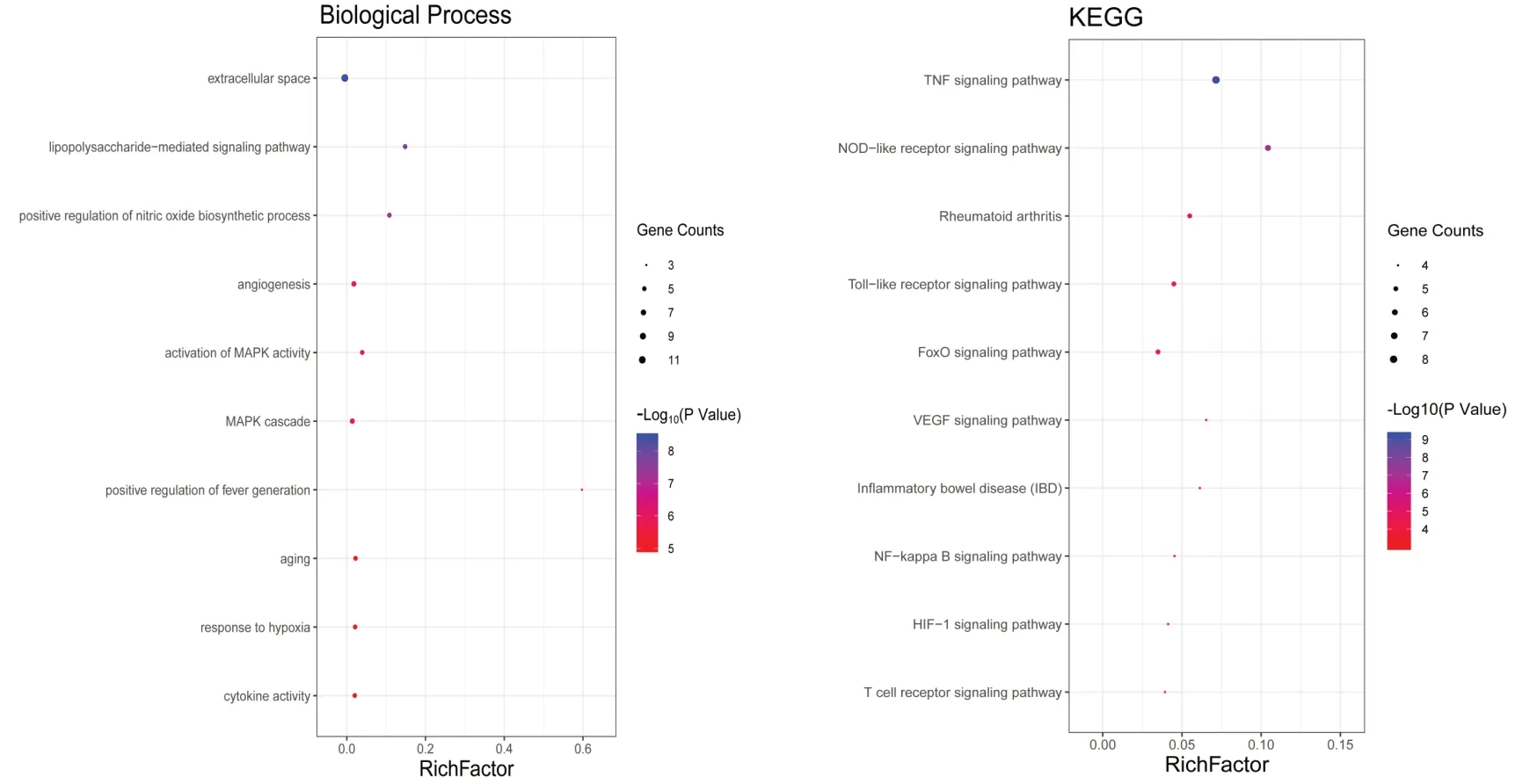
图6 羌活胜湿汤治疗AS关键靶基因的GO生物过程及KEGG信号通路气泡图
2.6 分子对接结果将“2.3”项获得的羌活胜湿汤主要有效成分槲皮素、β-谷甾醇、山柰酚、异紫花前胡内酯、欧前胡素与“2.4”项中自由度值排名前五的关键靶基因IL-6、TNF-α、VEGFA、PTGS2、IL-1β做分子对接,见表2。配体与受体的结合能越低,说明结合可能性越大越稳定,打分值≤-5的成分具有潜在的活性,打分值≤-7的成分具强的稳定性及活性。结果如表2所示,羌活胜湿汤中主要有效成分在与关键靶基因对接过程中均进入了活性位点,表明该方主要有效成分和关键靶基因具有较强的结合能力,验证了本研究数据的可靠性。根据表2可知,各靶基因对应各活性成分结合最稳定的是:槲皮素与IL-6、槲皮素与IL-1β、β-谷甾醇与VEGFA、β-谷甾醇与PTGS2、槲皮素与TNF-α,见图7。
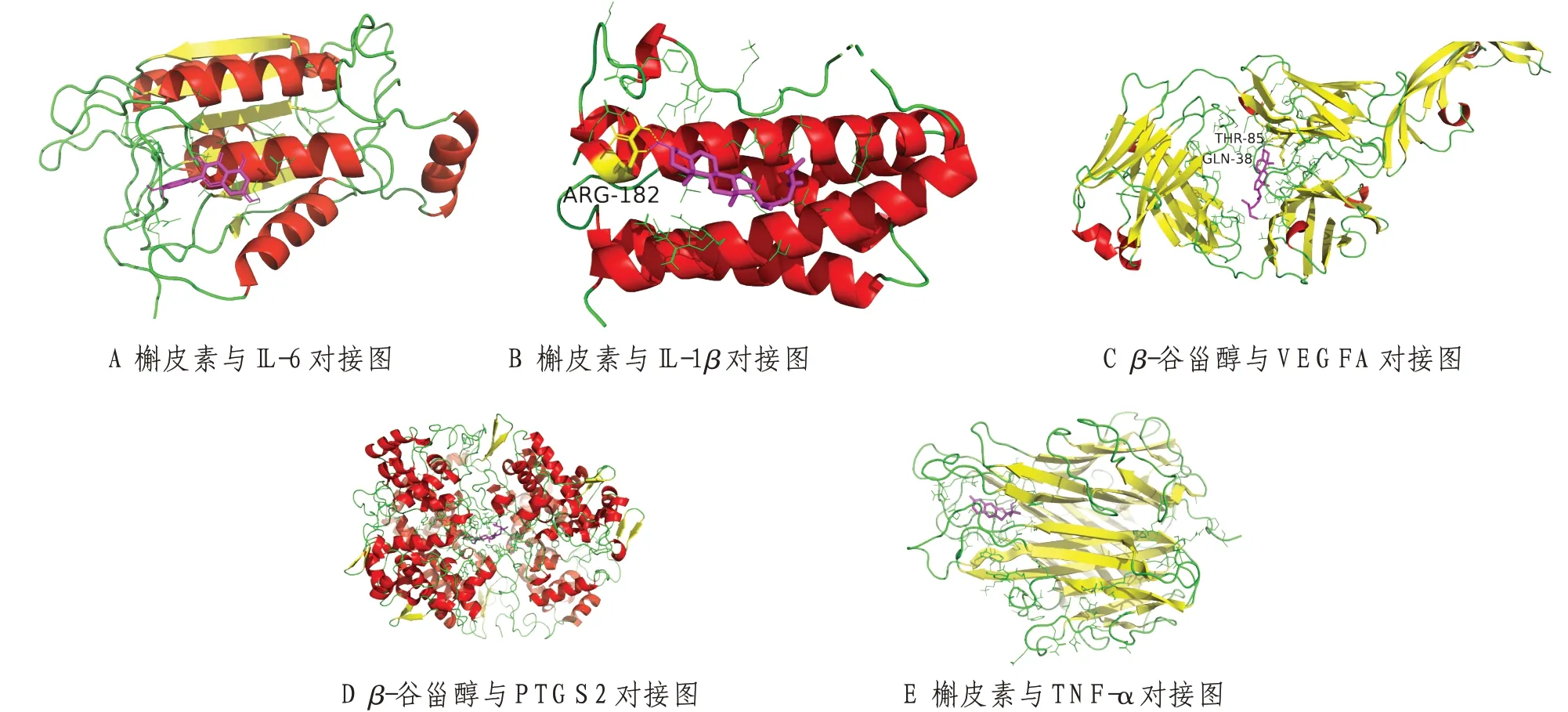
图7 各活性成分与各关键靶基因最稳定结合图
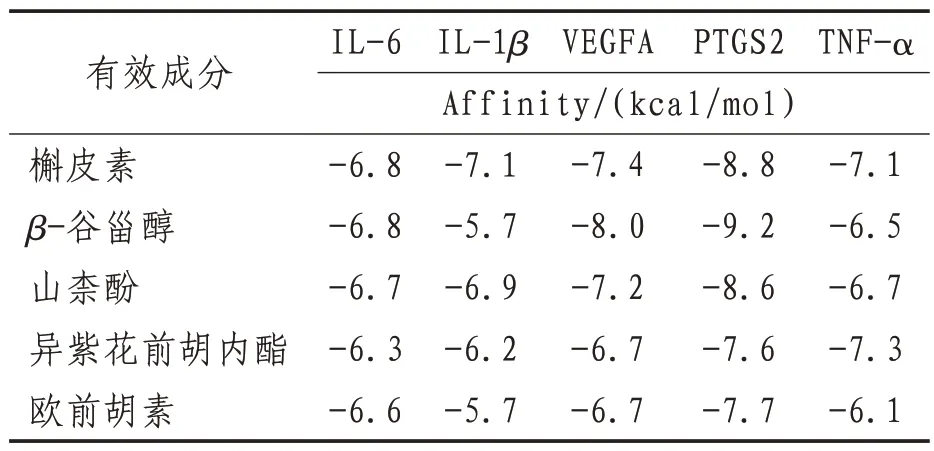
表2 分子对接打分结果
3 讨论
本研究应用生物信息学技术,通过GEO数据库筛选出AS患者与膝关节炎患者及正常人的差异基因,与各数据库已知AS作用靶基因进行合并。构建了羌活胜湿汤治疗AS的“药物-有效成分-靶基因-疾病”网络样机制,并进一步通过分子对接技术验证羌活胜湿汤中有效成分与关键靶基因的结合能力,系统阐述该方在治疗AS上药物、靶基因、通路与疾病的相关性。
通过TCMSP数据库分析得出,槲皮素、β-谷甾醇、山柰酚、异紫花前胡内酯等可能是羌活胜湿汤治疗AS的有效成分。槲皮素具有多重生物活性,其具有抗氧化、抗炎症、保护骨关节等作用[6]。研究表明,槲皮素可能通过增强下游抗氧化基因的表达,影响IKK/NF-κB和MAPK信号通路,进而抑制炎性细胞因子的释放,并且可显著降低基质金属肽酶13(matrix metallopeptidase-13,MMP-13)/基质金属蛋白酶抑制剂1(tissue inhibitor of metalloproteinase-1,TIMP-1)的比例,抑制软骨细胞外基质的降解,促进对关节软骨的保护[7-8]。β-谷甾醇在抗氧化、抗炎、免疫调节等多个方面表现出良好的药理作用[9]。β-谷甾醇具有强的抑制TNF-α、IL-1β和IL-6炎症因子作用,并通过强的抗氧化活性,猝灭人体产生的ROS,经嗜酸粒细胞渗滤等缓和炎症[10-11]。山柰酚具有抗炎症、抗氧化等药理作用,可有效降低IL-1β等因子的表达,使OA软骨细胞促炎介质的表达明显下降[12-13]。异紫花前胡内酯具有抗氧化、抗炎镇痛、保护中枢神经等作用[14]。有研究表明[15],异紫花前胡内酯除可调节细胞周期相关蛋白表达外,还可以抑制血管内皮细胞生长因子(vascular endothelial growth factor,VEGF)的表达。而VEGF的表达可促进关节软骨组织破坏,同时也与骨关节炎的发展呈正相关[16]。在目前的研究中,氧化应激稳态失衡被认为是导致AS发生发展的强效触发因素[17]。而如何干预氧化应激在AS过程中的信号通路表达也是治疗AS新的研究方向。本研究中的槲皮素、β-谷甾醇、山柰酚、异紫花前胡内酯均具有显著的抗氧化作用,故存在以上有效成分作为抗氧化剂整体参与AS的抗氧化应激治疗的可能,需要进一步研究证明。综上所述,羌活胜湿汤中的槲皮素、β-谷甾醇、山柰酚、异紫花前胡内酯等有效成分,表现出调节各种细胞因子的表达、保护关节软骨、缓和炎症、抗氧化等作用,很可能是治疗AS的有效成分。
在羌活胜湿汤治疗AS的靶基因中,TNF-α、IL-6、IL-1β、VEGFA、CAT、ESR1、PTGS2等起到了关键靶基因的作用。AS是一种主要累及脊柱与骶髂关节的慢性炎性疾病,各种促炎细胞因子过度表达,影响各相关细胞因子,在骨质的破坏和新骨的形成过程中起重要作用。TNF-α作为炎症的重要启动因子,诱导IL-1β、IL-6、VEGF等因子的表达,贯穿炎症反应发生发展的全过程,并通过调节自身免疫,在炎性骨吸收和自身免疫疾病等方面发挥作用[18]。IL-6是一种多效细胞因子,受到IL-1β的刺激而促进其表达,同时又诱导VEGF的表达而促进血管生成,在炎症反应、自身免疫、血管渗透和组织再生等多方面发挥作用[19]。VEGFA通过增加血管通透性导致炎性渗透加重,促进新生血管形成,导致滑膜炎症的快速发展及骨质的加速破坏,其与ESR1也存在正相关关系[20]。CAT作用与VEGF类似,同样受到各促炎性因子的调控,并且在新生血管形成过程中有重要作用[21]。PTGS2可参与炎性反应、细胞凋亡和自身免疫,调控破骨细胞与成骨细胞的生成和分化,其表达受到上述多个细胞因子的影响[22-23]。由此可见,许多细胞因子的表达与AS过程息息相关,每个细胞因子均具有多效性,它们之间的效应又相互重叠、相互诱导、相互协调,在AS的免疫反应中构成了复杂的关系网络,而网络性正是细胞因子的典型特点之一。干预细胞因子的表达是治疗AS的重要思路之一,而目前临床上常用的单一针对某个细胞因子的拮抗剂,如TNF-α拮抗剂,其作用也仅仅局限于缓解部分症状,无法根治,且大多数患者出现停药后反复的情况[24]。而羌活胜湿汤在临床上取得的良好疗效提醒我们:是否正是该方通过多成分、多靶点的作用机制,使得其多种有效成分干预了AS过程相关的多个细胞因子,在一定程度上起到了整体调控细胞因子网络的作用。这与中医学的整体观念、辨证论治之理念不谋而合,中药复方在整体性和微观性相结合的优势也为我们新的遣方应用及老方新用提供了线索。
从DAVID数据库对13个关键靶基因进行富集分析的结果可知,羌活胜湿汤治疗AS的生物学进程主要涉及细胞外间隙、脂多糖介导的信号通路、一氧化氮生物合成过程的正调控、血管生成、丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)活性的激活与级联反应、缺氧反应、细胞因子的活性等。通过KEGG通路富集分析发现,明显富集的TNF信号通路、FoxO信号通路、VEGF信号通路、炎症性肠病、NF-kappa B信号通路、HIF-1信号通路、T细胞受体等信号通路可能是治疗AS的关键通路。其中与各促炎因子相关的信号通路已有大量研究证明与AS发病机制有关,故不再赘述。FoxO信号通路、炎症性肠病是在本研究中值得关注的信号通路。在包括AS在内的慢性免疫介导炎症疾病中,参与细胞增殖和存活的基因和通路的异常调节对炎症的发生和发展起到了关键作用[25]。叉头框转录因子家族(forkhead box,FOX)的O亚族在维持细胞稳态上具有重要的作用,作为重要的信号整合因子,它将氧化应激、炎症和激素变化等环境刺激转化为参与许多生理和病理过程的动态基因表达程序,在骨和骨细胞中广泛表达,是骨形成和骨重塑的关键调节因子[26]。研究表明,敲除FoxO的小鼠软骨中参与抗氧化、自噬、氧化还原调节和适应能量应激的基因表达明显减少,同时使FoxO在人软骨细胞中过表达,结果发现自噬增强,炎症介质和软骨降解酶的表达减弱,并拮抗IL-1β的刺激作用[27]。由于羌活胜湿汤中的有效成分具有抗氧化作用,说明该方可能通过上调FoxO信号通路的表达,抑制促炎因子的释放,提高机体抗氧化能力,保护细胞免受氧化应激损伤,进而起到治疗AS的作用。炎症性肠病是由免疫介导的胃肠道晚期炎症。研究发现,AS患者中,炎症性肠病的发病率约为6%~14%,由于这两种情况可能是同时发生的,AS和炎症性肠病被认为存在相似的发病机制[28-30]。基于临床重叠的表现,证明两者之间存在共同的介体,在炎症与骨的稳态之间起作用。而羌活胜湿汤的作用靶点在炎症性肠病通路的明显富集,提示我们在临床上,可通过挖掘相关联疾病的重叠靶基因,筛选同时作用于这些靶基因的药物,借助中医学异病同治之理念组方用药,不失为一种有效的组方途径。
分子对接结果显示,羌活胜湿汤中主要有效成分在与关键靶基因对接过程中均进入了活性位点,尤其在与VEGFA、PTGS2、TNF-α的对接过程中体现了稳定的结构与强的活性,表明该方对VEGFA、PTGS2、TNF-α的表达具有强抑制作用,起到了抑制促炎因子的释放,调控骨的稳态及自身免疫的作用。基于分子对接结果,说明本研究数据及结果准确度较高,建立在此基础上的网络分析具有较高的置信度和参考价值。
随着生物信息学技术提高、各种生物信息数据库的建立,各种中药活性成分的作用靶点与疾病靶基因之间的网络样作用关系愈加清晰。中医药治疗AS的研究仍处于发展阶段,需要更多高质量、多角度和详细的数据理论支持临床试验。综上所述,本研究通过生物信息学与分子对接技术揭示羌活胜湿汤治疗AS的作用机制,以期为今后治疗AS的有效中药药理研究与中药组方配伍提供新思路。
