BEZ235和顺铂协同抑制膀胱癌细胞的增殖、迁移和侵袭
2023-03-14陈康邢基张云龙程帆
陈康, 邢基, 张云龙, 程帆
膀胱癌是全球第十大常见肿瘤[1], 发病率和病死率高[2]。膀胱癌90%为尿路上皮癌, 其中约75%为非肌层浸润性癌, 25%为肌层浸润性或转移性膀胱癌[3]。非肌层浸润性膀胱癌术后复发率高达70%, 可发展为肌层浸润性膀胱癌, 肌层浸润性膀胱癌预后差, 5年总生存率小于50%, 一次切除后易复发[4]。以顺铂为基础的新辅助化疗是局部晚期肌肉浸润性膀胱癌的推荐疗法[5]。然而, 大多数膀胱癌病人最终会产生顺铂耐药性, 癌细胞会通过使凋亡因子失活并增强对抗凋亡信号的存活途径而对化疗产生抗性[6]。
随着对肿瘤生物学认识的进步, 靶向治疗已成为包括泌尿生殖系统肿瘤在内的各种恶性肿瘤的一线或二线治疗选择。此外, 越来越多的数据表明, 联合使用靶向药物是增强传统化疗抗肿瘤效果的一种很有前途的策略[7-8]。磷脂酰肌醇3激酶(PI3K)/蛋白激酶B(Akt)/哺乳动物雷帕霉素靶蛋白(mTOR)信号轴是一条主要的生存途径, 其异常激活经常参与包括浸润性膀胱癌在内的多种肿瘤的发生发展[9]。此外, 一些研究已经观察到在肿瘤中, 抑制PI3K/AKT/mTOR通路可以增加顺铂的敏感性[10-11]。一些研究已经评估和证明了PI3K/AKT/mTOR通路抑制剂在临床前或临床环境下对膀胱癌的抗肿瘤作用[12-13]。然而, 很少有研究详细检验顺铂和PI3K/AKT/mTOR通路抑制抑制剂在人类膀胱癌中的协同作用。我们在2020年1月1日至2021年5月30日研究了口服生物利用咪唑喹啉衍生物PI3K/mTOR双重抑制剂BEZ235协同顺铂对膀胱癌细胞的抗肿瘤作用。
1 材料与方法
1.1 材料人膀胱癌5637细胞购自中国科学院上海生命研究所, RPMI-1640、胎牛血清磷酸缓冲盐溶液(PBS)购自美国Hyclone公司, 其他化学品购自美国Corning公司, 抗体均购自美国Abcam公司。蛋白质印迹法化学发光试剂购自美国Amersham公司。
1.2 方法
1.2.1 细胞培养 细胞培养在含10%胎牛血清(gibco)和青霉素-链霉素(100 U/mL)的RPMI-1640中, 在37 ℃, 5%二氧化碳的培养箱中培养。
1.2.2 细胞计数试剂盒(Cell Counting Kit-8, CCK-8)法细胞活力测定 用96孔板按每孔2 000个细胞接种5637细胞, 在接种后24 h、48 h、72 h和96 h, 将CCK-8溶液按1∶10比例加入96孔板, 用酶标仪在450 nm波长处测定吸光度。细胞生存率(%)=实验组吸光度/对照组吸光度×100%。
1.2.3 联合用药指数(combination index, CI)的计算 采用 CompuSyn(1.0.1)软件分析两药的CI, CI小于1表示两药协同, 等于1表示两药效相加, 大于1表示两药拮抗。
1.2.4 细胞划痕和细胞侵袭试验 当细胞在6孔板中达到90%融合时, 用200 μL的吸管尖端划伤细胞层。划痕的图像是在0、24和48 h拍摄的。24 h后, 观察相同位置的划痕伤口愈合情况, 并比较空白组、正常对照组和siRNA组的愈合情况。通过测量多个位置的划痕宽度, 计算划痕伤口愈合的平均速率。划痕愈合率(%)=(0 h划痕宽度-24 h划痕宽度)/0 h划痕宽×100%。在细胞侵袭实验中, 收集3 000个转染的人膀胱癌细胞(5637细胞)并转移到上transwell小室。上室加入200 μL RPMI-1640培养基, 下室加入600 μL完全培养基。48 h后用结晶紫染色, 荧光显微镜下观察穿膜细胞数。
1.2.5 集落形成试验 获得药物处理后的对数生长期的5637细胞, 将其中的500个均匀接种到六孔板中每两天进行换液。随后, 细胞常规培养10 d。当形成肉眼可见的细胞集落时, 取出平板, 然后用PBS冲洗细胞两次, 并用甲醇固定15 min。废弃固定液后, 用结晶紫染色, 计算细胞的集落形成数。
1.2.6 蛋白质印迹法 蛋白酶抑制剂(Beyotime:贝约提姆, 中国)以1∶100的比例加入到总蛋白提取试剂(Solarbio, 中国)中, 并与培养的细胞混合。BCA法用于测量蛋白质浓度。将蛋白质样品与加载缓冲液混合, 并加载到10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)上进行蛋白质印迹法分析, 将电泳分离后的蛋白质转移至聚偏二氟乙烯(PVDF)膜上, 用含5%脱脂奶粉的封闭液室温封闭1 h;加入兔抗人上皮钙黏素(E-cadherin)、神经钙黏素(N-cadherin)和波形蛋白单克隆抗体和鼠抗人甘油醛-3-磷酸脱氢酶(GAPDH)单克隆抗体(体积稀释比例均为1∶1 000), 4 ℃反应过夜;等渗缓冲盐溶液(TBST)洗膜3次后加入二抗, 并在室温下以1∶5000的浓度孵育1 h。TBST洗膜3次后, 免疫印迹带使用电化学发光法(ECL)试剂盒(中国蛋白科技)进行可视化, 在Bio-Rad凝胶成像仪中观察蛋白条带。用Image Lab软件分析蛋白条带的灰度值。以目的蛋白条带灰度值与内参照蛋白条带灰度值的比值表示目的蛋白的相对表达水平。
1.3 统计学方法所有实验至少进行3次。用SPSS 22.0软件进行统计分析。定量数据以±s表示, 两组间比较采用成组t检验的方法, 多组间数据比较采用单因素方差分析, 多组间两两比较SNK-q检验。P<0.05被认为差异有统计学意义。
2 结果
2.1 BEZ235和顺铂单独或联合使用对5637细胞活性的影响CCK-8法检测BEZ235和顺铂对膀胱癌细胞增殖的抑制作用。用不同浓度BEZ235和顺铂处理5637细胞, 分别于0、1、2、3和4 d检测细胞活力。如表1, 2所示, BEZ235和顺铂对5637细胞均以时间和剂量依赖的方式发挥抑制作用(均P<0.05)。BEZ235和顺铂分别作用3 d后, 当5637细胞的生长抑制率为50%时, BEZ235和顺铂的浓度分别为98 nmol/L和1.1 μmol/L, 为了计算方便, 后续我们将使用100 nmol/L BEZ235和1 μmol/L顺铂进行实验。随后, 5637细胞分别经25、50、100和200 nmol/L BEZ235以及0.1、0.5、1.0和2.0 μmol/L顺铂联合处理, 计算联合用药的CI值, 结果如表3所示, 当100 nmol/L BEZ235和0.1 μmol/L顺铂联合用药时, CI值最小, 即两药的协同作用最强。
表1 顺铂对膀胱癌细胞5637的影响/±s

表1 顺铂对膀胱癌细胞5637的影响/±s
注:①与0 μmol/L组相比,P<0.05。②与0.1 μmol/L组相比,P<0.05。③与1.0 μmol/L组相比,P<0.05。
顺铂浓度0 μmol/L 0.1 μmol/L 1.0 μmol/L 5.0 μmol/L F值P值重复次数9 999细胞活性(490 nm处吸光度)24 h 0.31±0.03 0.29±0.04 0.28±0.03 0.26±0.02 1.37 0.32 48 h 0.58±0.05 0.56±0.03①0.49±0.04①②0.25±0.03①②③46.78<0.001 72 h 1.03±0.06 0.95±0.04①0.52±0.03①②0.23±0.02①②③260.6<0.001 96 h 1.35±0.05 1.31±0.03①0.47±0.03①②0.21±0.01①②③922.46<0.001

表3 BEZ235和顺铂对膀胱癌5637细胞的联合用药指数
2.2 BEZ235联合顺铂可协同抑制膀胱癌细胞的平板克隆形成BEZ235 和顺铂单药及两药联合处理 5637细胞后, 应用平板克隆形成实验检测细胞的集落形成能力。结果如图1显示, 集落形成数:对照组为(207±9)个, BEZ235单药处理组为(146±10)个, 顺铂单药处理组为(179±11)个, 两药联合处理组为(103±9)个(F=76.81,P<0.001);BEZ235和顺铂单药及两药联合处理的5637细胞集落形成数显著少于对照组(均P<0.05), 两药联合处理的5637细胞集落形成数显著少于各单药处理组(均P<0.05)。

图1 平板克隆形成实验检测BEZ235和顺铂联合或单药对膀胱癌5637 细胞集落形成能力的影响
2.3 BEZ235联合顺铂可协同抑制膀胱癌细胞的迁移能力BEZ235和顺铂单药及两药联合处理 5637细胞后, 应用划痕愈合实验检测细胞的迁移能力。结果见图2, 细胞迁移率:对照组为(70±5)%, BEZ235单药处理组为(52±6)%, 顺铂单药处理组为(53±4)%, 两药联合处理组为(39±6)%(F=17.17,P<0.001);BEZ235和顺铂单药及两药联合处理的5637细胞的迁移率显著少于对照组(均P<0.05), 两药联合处理的5637的迁移率少于各单药处理组(均P<0.05)。

图2 划痕愈合实验检测BEZ235和顺铂联合或单药对膀胱癌5637 细胞迁移能力的影响
表2 BEZ235对膀胱癌细胞5637的影响/±s
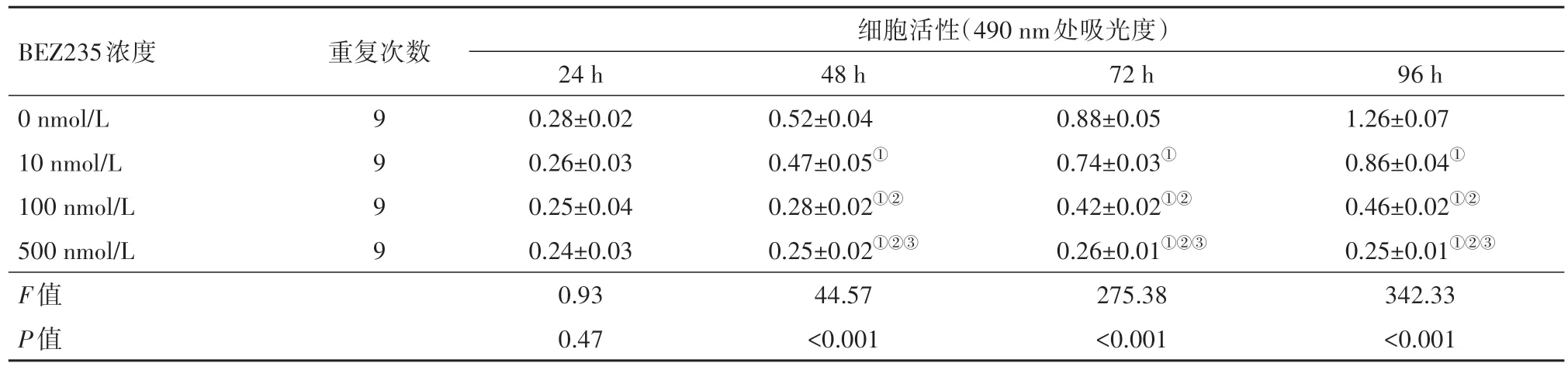
表2 BEZ235对膀胱癌细胞5637的影响/±s
注:①与0 nmol/L组相比,P<0.05。②与10 nmol/L组相比,P<0.05。③与100 nmol/L组相比,P<0.05。
BEZ235浓度0 nmol/L 10 nmol/L 100 nmol/L 500 nmol/L F值P值重复次数9 9 9 9细胞活性(490 nm处吸光度)24 h 0.28±0.02 0.26±0.03 0.25±0.04 0.24±0.03 0.93 0.47 48 h 0.52±0.04 0.47±0.05①0.28±0.02①②0.25±0.02①②③44.57<0.001 72 h 0.88±0.05 0.74±0.03①0.42±0.02①②0.26±0.01①②③275.38<0.001 96 h 1.26±0.07 0.86±0.04①0.46±0.02①②0.25±0.01①②③342.33<0.001
2.4 BEZ235联合顺铂可协同抑制膀胱癌细胞的侵袭能力BEZ235和顺铂单药及两药联合处理5637细胞后, 应用transwell法检测细胞的侵袭能力。结果如图3显示, 侵袭细胞数:对照组为(346±36)个, BEZ235单药处理组为(193±38)个, 顺铂单药处理组为(254±27)个, 两药联合处理组为(133±23)个(F=24.81,P<0.001);BEZ235和顺铂单药及两药联合处理5637细胞后, 穿过基质膜的细胞数显著少于对照组(均P<0.05), 两药联合处理组穿过基质膜的5637细胞数显著少于各单药处理组(均P<0.05)。

图3 细胞侵袭实验检测BEZ235和顺铂联合或单药对膀胱癌5637 细胞侵袭能力的影响(结晶紫染色×200)
2.5 BEZ235和顺铂的联合作用可调节膀胱癌细胞中上皮-间质转化相关蛋白的表达BEZ235和顺铂单药及两药联合处理5637细胞后, 应用蛋白质印迹法检测细胞中上皮-间质转化相关的E-cadherin、Ncadherin和波形蛋白蛋白表达情况。结果如表4所示, BEZ235和顺铂单药及两药联合处理5637细胞中E-cadherin蛋白表达水平均高于对照组(均P<0.05), N-cadherin和波形蛋白的表达水平均低于对照组均P<0.05)。两药联合处理组的5637细胞中 E-cadherin蛋白表达水平均显著高于各单药处理组(均P<0.05), N-cadherin和波形蛋白的表达水平均显著低于各单药处理组(均P<0.05)。
表4 蛋白质印迹法检测BEZ235和顺铂联合或单药对膀胱癌5637细胞中上皮-间质转化相关蛋白N-cadherin、E-cadherin和波形蛋白表达的影响/±s

表4 蛋白质印迹法检测BEZ235和顺铂联合或单药对膀胱癌5637细胞中上皮-间质转化相关蛋白N-cadherin、E-cadherin和波形蛋白表达的影响/±s
注:N-cadherin为神经钙黏素, E-cadheri为上皮钙黏素。①与对照组相比,P<0.05。②与BEZ235组相比,P<0.05。③与顺铂组相比,P<0.05。
组别对照组BEZ235顺铂BEZ235+顺铂F值P值重复次数9 9 9 9 N-cadherin 0.57±0.07 0.32±0.04①0.44±0.03①0.21±0.03①②③34.75<0.001 E-cadherin 0.38±0.06 0.56±0.06①0.28±0.04①0.59±0.05①②③23.18<0.001波形蛋白1.02±0.04 0.61±0.02①0.68±0.03①0.57±0.05①②③68.49<0.001
3 讨论
癌细胞的侵袭和随后的转移是导致死亡的主要原因[14]。许多研究表明, 与单一疗法相比, 接受联合疗法的病人在治疗肿瘤转移等方面表现出良好的生存结果, 这使得联合疗法在癌症治疗方面有巨大潜力[15-16]。在很多肿瘤中, PI3K/Akt/mTOR通路被异常激活, 该通路抑制剂在不同肿瘤中被广泛研究[17]。目前对晚期和转移性尿路上皮膀胱癌病人的治疗标准是基于顺铂的联合化疗, 但顺铂的耐药性常限制了其使用[18]。
本研究通过CCK-8法验证了BEZ235 和顺铂单独用药时能抑制膀胱癌5637细胞的增殖, 当不同浓度的BEZ235和顺铂联用时, 多种浓度组合均表现为协同抑制作用, 当100 nmol/L BEZ235与0.1 μmol/L顺铂联用时, 两者的联合用药指数CI值最小, 表明此时两者的协同作用能力最强。为了验证BEZ235和顺铂的协同作用, 在接下来的实验中, 我们使用100 nmol/L BEZ235与0.1 μmol/L顺铂单独或者联合作用于5637细胞。平板克隆形成的实验结果显示, BEZ235联合顺铂可显著抑制膀胱癌细胞的增殖。划痕愈合实验和细胞侵袭实验显示, BEZ235联合顺铂可显著抑制膀胱癌细胞的迁移和侵袭。
为了探究BEZ235和顺铂协同抑制膀胱癌细胞的增殖、迁移和侵袭能力的具体机制, 我们进一步研究了BEZ235和顺铂与上皮-间质转化相关蛋白的潜在关联, 例如上皮标志物:E-cadherin, 间质标志物:N-cadherin和波形蛋白。上皮-间质转化是指上皮细胞失去极性而成为间质细胞的生物学过程, 上皮-间质转化会赋予细胞转移和侵袭能力, 使恶性肿瘤细胞具有转移倾向[19-20]。E-cadherin蛋白表达与细胞的黏附力有关, E-cadherin蛋白的高表达能抑制肿瘤细胞的转移和侵袭[21], 而N-cadherin和波形蛋白的高表达会促进肿瘤细胞的迁移和侵袭[22]。本研究发现, BEZ235和顺铂两药联合时可显著抑制N-cadherin和波形蛋白的表达, 并能显著上调E-cadherin的表达, 表明BEZ235联合顺铂可通过上皮-间质转化途径抑制膀胱肿瘤细胞的迁移和侵袭能力。
综上所述, BEZ235和顺铂能够抑制膀胱癌细胞的增殖、迁移和侵袭, 并且两种药物能够协同通过上皮-间质转化途径抑制膀胱癌细胞的增殖、迁移和侵袭, 使抗肿瘤效果更为显著。本研究为临床膀胱癌病人的靶向治疗提供了联合用药的实验基础, 也为解决顺铂在膀胱癌中的耐药难题提供新的思路。
