功能性鱼软骨多糖制备工艺优化及食用安全性评价
2023-03-13武瑞赟刘子宇TharushiShinali
武瑞赟,桂 萌,刘子宇,Tharushi S. Shinali,尚 楠,
(1.中国农业科学院农产品加工研究所,北京 100193;2.中国农业大学工学院,北京 100083;3.北京市农林科学院水产科学院研究所,北京 100068;4.北京语言大学社区卫生服务中心,北京 100083)
结直肠癌是消化系统中最常见的恶性上皮肿瘤[1],在欧美等一些发达国家,结直肠癌已经成为继肺癌、肝癌和乳腺癌后的第四大常见癌症[2],严重威胁人类健康。随着社会经济的发展,生活方式的转变以及老龄化人口的增涨,结直肠癌的发病率和死亡率明显上升,亟需开展有效的防治工作。由于结直肠癌发病因素复杂,病理表征多样[3]。目前,结合外科手术和放疗、化疗的综合治疗对结直肠癌的治疗效果并不理想,靶向治疗费用较为昂贵;此外,结直肠癌的形成和发展是一个多阶段的漫长过程,通常需要7~10 年的潜伏期[4],这就为早期的预防提供了最佳的机会。预防药物的开发已成为目前结直肠癌研究中的热点;但是,许多经历多年开发的化学预防药物都被发现在长期服用下存在一定的安全问题,如抗药性或对其他脏器的毒性[5]。因此,在满足有效的同时,寻找安全低毒的预防物质是目前迫切需要解决的问题。
硫酸软骨多糖(chondroitin sulfate,CS)广泛存在于动物软骨、结缔组织和细胞外基质中,以D-葡萄糖醛酸(D-glucuronic acid,GlcA)和N-乙酰-D-半乳糖胺(N-acetyl-D-galactosamine,GalNAc)通过β-1,3糖苷键为基本二糖单位,二糖单位之间通过β-1,4-糖苷键连接形成的一类线性直链糖胺聚糖[6],分子质量约10~100 kDa,具有抗炎、止血、保持关节软骨弹性、调节细胞发育、调控细胞黏附分化和增殖、抗肿瘤等多种生物活性[7]。但是CS的高分子质量和高电荷密度导致其生物利用率较低,限制了其生物功效的发挥[8-9]。越来越多的证据表明,低分子质量CS具有黏度小、溶解性好、易吸收等优点,可有效克服CS生物利用率低的缺点,如牛源CS经降解后制备出不同分子质量的CS(92.7、54.1、26.3、19.7 kDa),通过体外氧化实验证明了低分子质量的CS具有更高的抗氧化活性[10]。因此,开发和制备分子质量低、活性高的CS受到研究者的青睐。目前,低分子质量CS主要通过酸降解法、氧化降解法、超声降解法、辐射降解法以及酶解法获得[11-14],其中由于酶解法具有反应条件温和、催化效率高、操作简便、作用底物专一、产物分子质量可控性高等优点而被广泛使用。
常见的CS大多来源于鲨鱼软骨组织,但过度捕捞造成鲨鱼资源的日趋匮乏。鲟鱼作为世界上最大最原始的软骨硬鳞鱼类,软骨含量可占鱼体的10%~20%[15-16],为CS的研究提供了丰富的来源。实验室之前对鲟鱼来源的CS进行结构分析,表明鲟鱼CS(sturgeon sulfate chondropolysaccharides,SCS)具有和鲨鱼CS一样的官能团和相似的结构[17],说明SCS可作为鲨鱼CS的良好替代物。且前期实验发现,SCS具有抑制结直肠癌细胞增殖的作用[18-19],但体内吸收效果不佳,大量不能吸收的CS主要是通过调节患病小鼠肠道菌群缓解或减缓结直肠癌的发展[20]。因此,本实验以SCS为原料,结直肠癌细胞HT-29增殖活性为指标,通过酶解法,利用响应面优化制备具有抗结直肠癌活性的低分子质量SCS。此外,开发SCS相关的食品或保健食品目前缺乏明确的毒理安全评价资料。因此,本实验进一步通过动物急性毒性实验探究制备的SCS食用安全性,研究结果为开发以低分子质量SCS为基础的膳食营养补充剂预防、降低结直肠癌发生风险提供实验依据,对SCS相关产品的开发和进一步的安全应用具有重要意义。
1 材料与方法
1.1 材料与试剂
杂交鲟鱼(Acipenser schrenckii×Huso dauricus)CS由中国农业大学食品科学与营养工程学院应用微生物实验室制备保存。
BALB/c小鼠(生产许可证号:SCXK(京)2016-0006)购于北京维通利华实验动物技术有限公司。SPF级健康5 周龄雌雄小鼠各半饲养于北京医科大学实验动物中心。按照SPF级要求,温度(22±2) ℃,相对湿度(50±10)%,严格按照12 h光照/黑暗循环进行饲养和管理。实验中各组小鼠进食和饮水自由。
硫酸软骨素酶AC(chondroitinase sulfate AC,ChonAC) 北京碧澄生物科技有限公司;人源结直肠癌细胞HT-29细胞 中国医学科学院基础医学研究所;DMEM高糖培养基、胎牛血清、胰蛋白酶细胞消化液、磷酸盐缓冲液 美国Gibco公司;顺铂(cisplatin,DDP)美国Sigma公司;苏木精-伊红染色(hematoxylin-eosin staining,HE)试剂盒 北京索莱宝生物技术有限公司;葡聚糖分子质量标准品 美国聚合物标准品公司。
1.2 仪器与设备
FD-1/1C冷冻干燥机 北京德天佑科技发展有限公司;UV2355紫外-可见分光光度计 上海尤尼科仪器有限公司;SynergyHTX酶标仪 美国Biotek公司;DHG-9141A恒温恒热培养箱 上海一恒科技有限公司;Hitachi 720血生化分析仪 日本日立公司;HEMAVET 950FS血细胞分析仪 美国DREW公司;3K15通用台式冷冻离心机美国Sigma公司;UFSC40001 Amicon搅拌超滤杯 美国贝德福德密理博公司。
1.3 方法
1.3.1 细胞培养
HT-29细胞从液氮中取出,在37 ℃快速溶解后,离心收集细胞沉淀,加入新鲜的含有10%牛血清的DMEM培养基并重悬细胞后,置于无菌的细胞培养瓶中,37 ℃、5%的二氧化碳条件下培养细胞,待细胞增殖到90%左右时进行传代,3 代以上后用于实验。
1.3.2 细胞增殖实验
细胞经胰蛋白酶消化2 min后,吹打细胞成单细胞悬液,调整细胞浓度为5×104cells/mL,按照每孔100 μL加入到96 孔板中,于37 ℃ CO2培养箱中培养过夜后,更换不同质量浓度的SCS溶液(DMEM培养基配制),同时设置不添加任何药物的空白处理组和DDP阳性对照组。每个处理设置6 个平行,培养24 h后,每孔添加10 μL CCK-8试剂,避光4 h后,在450 nm波长下测定吸光度,按照下式计算细胞抑制率。
式中:A处理为处理组吸光度;A空白为空白组吸光度;A对照为DDP阳性对照组吸光度。
1.3.3 具有抑制结直肠癌增殖的低分子质量SCS最优制备条件确定
1.3.3.1 单因素试验
利用单因素试验,探究酶添加量、底物质量浓度、pH值、酶解时间、酶解温度5 个因素下酶解产物对HT-29细胞增殖抑制率,共进行5 组实验。酶添加量选取0.012 5、0.025 0、0.050 0、0.100 0、0.200 0 IU/mg;pH值选取5、6、7、8、9;酶解时间选取15、30、60、90、120 min;底物质量浓度选取0.125、0.250、0.500、1.000、2.000 mg/mL;酶解温度选取20、25、30、35、40 ℃。单因素试验中每个实验重复3 次,取平均值。
1.3.3.2 Plackett-Burman(PB)试验
试验中使用Design-Expert 8.0.6软件辅助设计PB试验,选用N=12的PB试验设计。因素及水平如表1所示,响应值为酶解产物(1 000 μg/mL)对HT-29细胞存活率。通过对各因素效应值、方差和贡献率的分析,选出贡献率前3的因素进行下一步研究。

表1 PB试验设计Table 1 Low and high levels of each independent variable used in Plackett Burman design
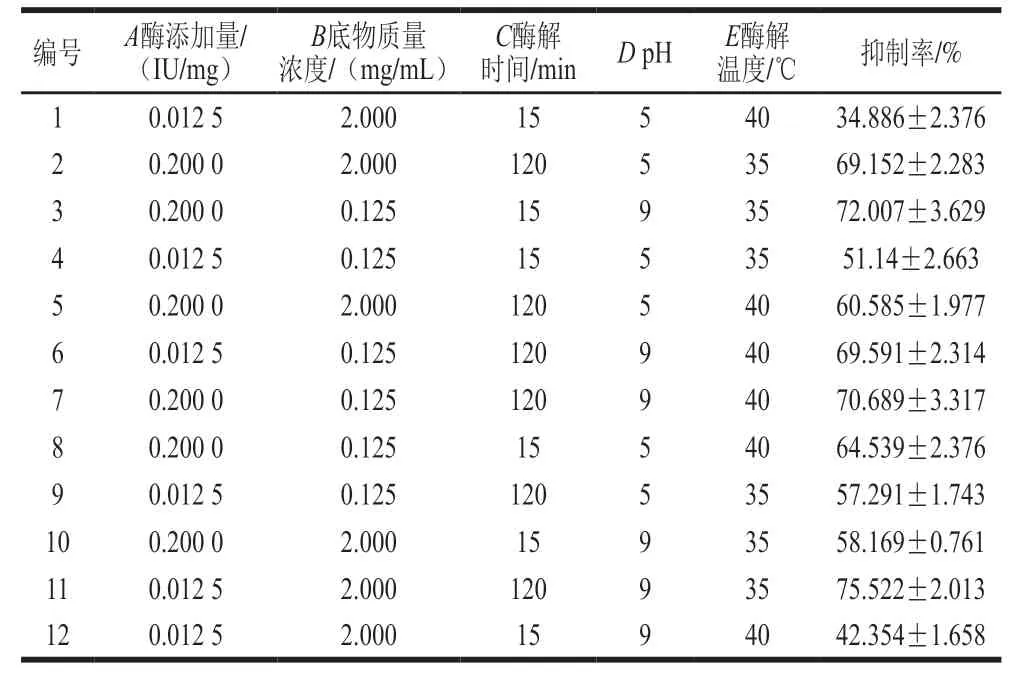
表2 PB试验结果Table 2 Plackett Burman design and experimental results
1.3.3.3 最陡爬坡试验
根据PB试验得到的显著因素和效应值,利用软件设计最陡爬坡试验的方向和步长。非显著因素的取值根据PB试验中的效应值确定。
1.3.3.4 响应面试验
由最陡爬坡试验得到的拐点可确定响应中心及接近响应值区间的因素取值范围,利用Box-Benhnken(BB)法,利用Design-Expert 8.0.6软件进行响应面分析。试验模型对产物(1 000 μg/mL)作用下HT-29细胞存活率进行二次多元回归拟合,得到等高线图和响应面曲线图,并获得最优酶解制备条件,对模型进行方差分析,确定可信度并进行验证。
1.3.4 低分子质量SCS分离
将在最优酶解条件下获得的SCS酶解溶液经三氯乙酸除去蛋白后离心取上清,添加到Amicon搅拌超滤杯中,并连续通过不同分子质量的超滤膜(截留分子质量5、3、0.5 kDa)。超滤过程中的压力调节0.10~0.22 mPa。收集3 种超滤成分,包括>5、3~5、0.5~3 kDa,并冷冻干燥样品,分别命名为SCS-1、SCS-2和SCS-3。测定不同分子质量的冻干SCS质量,并测定其对HT-29细胞存活率的影响。
1.3.5 动物实验分组和处理
BALB/c小鼠适应性喂养1 周后随机分为6 组,其中雌性和雄性各3 组,每组10 只,实验采用最大灌胃剂量方法,每只小鼠灌胃剂量为1 mg/(g·d),分别灌胃SCS和SCS-F2,另设生理盐水为正常对照组,按照每只0.2 mL/d进行灌胃,连续灌胃2 周后处死小鼠,取各组织脏器进行病理分析,经眼球采血后,进行血液指标和血生化指标的测定。
1.3.6 血常规测定
使用血液细胞分析仪进行血常规测定,指标包括红细胞计数、红细胞比容、平均红细胞体积、白细胞计数、平均红细胞血红蛋白、血小板计数等。
1.3.7 血液生化指标测定
使用血生化测定仪进行液生化指标测定,包括谷丙转氨酶、白蛋白等。
1.3.8 病理切片观察
将剖取的脏器组织置于10%的中性福尔马林组织固定液中,使用不同体积分数乙醇溶液和无水乙醇进行梯度脱水,二甲苯透明后,石蜡包埋。使用切片机对组织进行切片,厚度5 μm,按照试剂盒进行操作进行染色后使用光学显微镜检测并采集图片,进行病理分析。
取小鼠结直肠样本制好的HE染色切片,显微镜下进行观察并拍照记录,每个样本随机选取2~3 个不同视野进行拍照,利用软件进行图像分析。选取组织结构完整性好的隐窝,对结直肠纵切后,记录每个隐窝纵向一半时的细胞数为所需隐窝深度,每个样本的计数均需要大于20 个隐窝。
1.4 数据处理
各个组别脏器指标、血生化以及血液学指标统计完全后将实验组的数据与空白组利用SPSS软件进行分析,采用单因素方差分析的方法对各组间的差异进行统计学分析,数据结果以平均值±标准差表示,P<0.05表示差异显著。
2 结果与分析
2.1 单因素试验
如图1所示,随着酶添加量、pH值、温度、酶解时间和底物质量浓度的增加,酶解产物对HT-29细胞的抑制率呈现先增加后降低或趋于不变的趋势。其中,酶添加量在0.1、0.2 IU/mg时达到最大(图1A),这是由于在一定的底物质量浓度时,大分子、长链的糖链会被酶解成短链的多糖,从而分子质量降低[13-14],但是酶解产物对细胞的抑制率与酶解效率并不呈正相关,小分子的糖越多,分子质量越低并不一定代表对细胞的抑制活性越强。如图1B所示,当pH值为7时对细胞的抑制率最高为58.05%;而后随pH值增加,酶解产物的细胞活性抑制率降低。这可能是由于随pH值增加,糖苷键断裂加剧,聚合度减低,形成的单糖越多,为细胞生长提供的营养越充分,促进细胞增殖[21],也因此细胞的抑制率有所降低。在固定酶添加量和pH值的条件下,酶解温度对产物活性的影响如图1C所示,酶解温度为35 ℃时,产物对HT-29细胞的抑制率最高,为62.43%。这是由于温度的升高,使酶与底物之间的分子运动速率增加,酶的作用效果加强,酶解效率也有所增加,糖苷键断裂的数量增加,使更多具有抑制癌细胞生长的活性糖链片段被分离出来。在此条件下,随酶解时间延长,细胞抑制率在60 min时达到最大值64.41%(图1D);而后酶解时间进一步延长,一方面底物和酶的含量有限,酶解效率减缓;另一方面,酶解得到的寡糖或者二糖增加,细胞生长需要的碳源增加,使得细胞的增殖能力有所上升,SCS对HT-29细胞的抑制率降低。保持其他条件不变的情况下,底物质量浓度为1、2 mg/mL时,产物对细胞的抑制率最大,分别为70.04%和70.11%(图1E),且与其他各组差异显著。细胞抑制率增长表明酶解反应后更多具有活性的SCS被解离[22-23],糖苷键断裂,具有抗肿瘤活性的糖链被解离出来。通过单因素试验得到最适酶添加量、pH值、酶解温度、酶解时间及底物质量浓度分别为0.1 IU/mg、7、35 ℃、60 min和1 mg/mL。
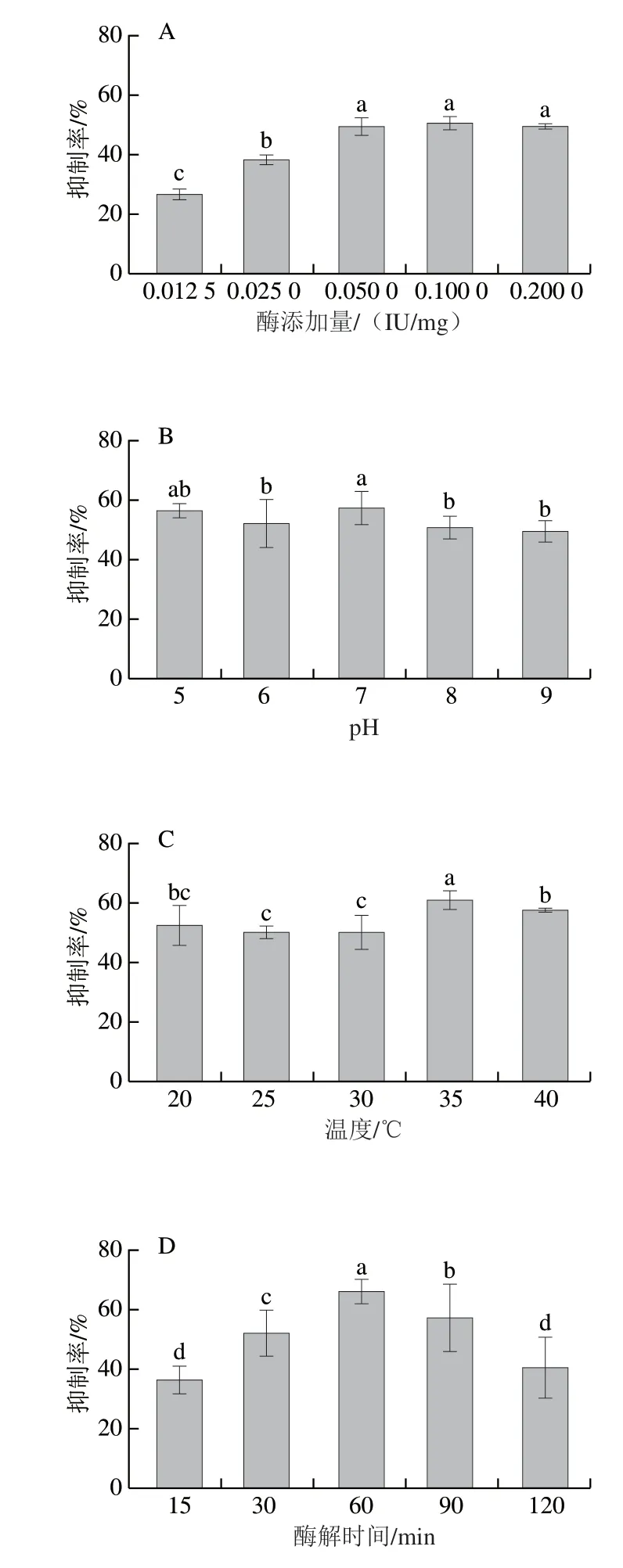
图1 酶添加量(A)、pH值(B)、温度(C)、酶解时间(D)、底物质量浓度(E)对细胞增殖活性的影响Fig. 1 Effects of enzyme dosage (A), pH (B), temperature (C),enzymatic hydrolysis time (D) and substrate concentration (E) on cell proliferation activity
2.2 PB试验
利用Design Expert 8.0.6设计N=12的Plackett-Burman,选择对酶添加量(A)、底物质量浓度(B)、酶解温度(C)、pH值(D)及温度(E)5 个因素进行分析。考察各因素对制备的酶解产物抑制结直肠癌细胞增殖活性的影响,以上述因素在单因素实验中的结果选择合适的范围和高低水平,以酶解产物对结直肠癌细胞HT-29的抑制率为响应值,设计和结果分别如表1、2所示。
用Design Expert 8.0.6对实验结果进行效应分析以及方差分析,结果如表3、4所示。由表3可知,酶添加量、底物质量浓度、酶解时间这3 个因素为正效应;pH值、温度2 个因素为负效应,并且这些因素效应值的大小与贡献率保持一致。由表4可知,模型显著,说明PB模型选择合适,各因素P值的大小反映了该因素对实验结果影响的显著程度,P值越小说明该因素对结果影响越显著。因此可选用这3 个因素进行最陡爬坡试验。对于其他的因素,pH值、温度为负效应,因此应选取其低水平,即pH 5、温度35 ℃。

表3 PB试验设计因素水平及效应分析Table 3 Analysis of effect and contribution rate of each variable used in PB design

表4 PB试验整体因素模型方差分析表Table 4 Analysis of variance for the effect of each variable on cell proliferation activity in PB design
2.3 最陡爬坡试验
最陡爬坡法是将各因素正负效应的变化确定为爬坡方向,利用各因素的效应值大小确定变化步长,可以更经济快速地逼近最佳值区域,得到有效的响应拟合方程。根据PB试验结果,筛选出主要的影响因素并设计最陡爬坡路径。最陡爬坡试验拐点图如图2所示。编号为4的实验是最大值点,对应的条件为酶添加量0.1 IU/mg、底物质量浓度1 mg/mL、酶解时间90 min。对应对HT-29细胞的抑制率可达80.95%,故该点为下一步BB试验设计的中心点。

图2 最陡爬坡试验Fig. 2 Results of steepest ascent test
2.4 BB响应面试验
利用Design-Expert 8.05b软件对酶添加量(A)、底物质量浓度(B)、酶解时间(C)设计三因素三水平的实验,BB试验的结果如表5所示。BB试验的数据分析使用Design-Expert 8.0.5b软件进行方差分析,结果如表6所示。

表5 Box-Behnken试验设计Table 5 Box-Behnken design and experimental results

表6 Box-Behnken实验回归模型方差分析Table 6 AVOVA of quadratic polynomial model developed based on Box-Behnken design
由表6可知,所选择的回归模型的P值小于0.05,表明整体模型对实验结果有显著的影响,具有可信度;失拟项的P值为0.053 5,不显著,说明未知因素对结果的影响较小,残差主要由随机误差引起,模型选择适当;该模型的相关系数R2=0.978 7,信噪比大于4,表明模型可信。低分子质量硫酸软骨对HT-29细胞的抑制率(Y)对酶添加量(A)、底物质量浓度(B)、酶解时间(C)的多元二次回归方程为:
由回归方程所做的响应面立体图见图3所示,主要反映了酶添加量、底物质量浓度和酶解时间之间的交互作用。通过方程可知,二次项系数为负值,表明方程具有最大值。利用Design-expert8.0.5b分析计算,酶解最佳条件为酶添加量0.103 IU/mg、底物质量浓度1.005 mg/mL、酶解时间87 min,可得最大抑制率82.63%。按照工艺进行验证实验,所得结果为82.55%,与预测值基本吻合,说明模型很好地预测试验结果。

图3 两因素交互作用的响应面图和等高线图Fig. 3 Response surfaces and contour plots showing individual and interactive effects of variables on inhibitory activity against cell proliferation
2.5 具有抗结直肠癌活性的低分子质量SCS的超滤分离
超滤分离后各组分相对含量如图4A所示,共收集到3 个组分,冻干并计算相对含量,SCS-F1、SCS-F2和SCS-F3分别占SCS总质量的24.11%,57.07%和18.02%。配制1 000 μg/mL的各组分样品进行细胞实验,检测各组分对结直肠癌细胞HT-29增殖活性的抑制效果。如图4B所示,SCS-F2具有更高的抑制活性(88.87%),显著高于阳性对照DDP处理组(50.70%)。同时分子质量最小的SCS-F3却显示出较低的抑制活性,约29.13%,低于阳性对照DDP组,这可能是由于分子质量降低,具有抗肿瘤活性的官能团减少或者消除[23],使得该组分(SCS-F3)不具有抗肿瘤活性,因此选择SCS-F2进行后续研究。


图4 不同分子质量截留超滤后各组分相对含量(A)和对结直肠癌细胞HT-29增殖活性的影响(B)Fig. 4 Percentages of ultrafiltration fractions with different molecular masses (A) and their inhibitory effects on the proliferation of colorectal cancer cell line HT-29 (B)
2.6 具有抗肿瘤活性的低分子质量SCS毒性分析
动物实验期间,各小鼠均未表现出明显的不良反应,且无意外死亡状况发生。随机剖取各组中的小鼠,观察不同处理对小鼠心、肝、脾、肺、肾和结肠组织的影响。表7中脏器质量结果显示,SCS-F2对脏器的生长发育没有影响。如图5所示,各组脏器的形态、颜色和质地未见变化。其中肝脏组织切片的HE染色图显示各组肝脏中肝小叶排列规则、结构无异常、无病理性改变,但是在空白对照组中,可见少部分胞浆呈空泡网格状,猜测可能有轻微炎症现象,SCS-F2处理组中未见该现象,且干细胞索排列整齐,细胞形态正常,胞核位于中央,胞浆分布均匀,未见变性坏死,说明对肝脏没有毒性影响,结合上述肝脏血生化指标(表7),SCS-F2处理组中血液中抗炎指标均高于空白组,说明SCS-F2一定程度上对肝脏具有保护作用。

图5 SCS和SCS-F2对小鼠组织脏器的影响(200×)Fig. 5 Effects of SCS and SCS-F2 on visceral tissues of mice (200 ×)

表7 SCS和SCS-F2对小鼠脏器质量、血常规及血生化的影响Table 7 Effects of SCS and SCS-F2 on visceral organ mass, complete blood count and blood biochemical indexes in mice
肾脏病理切片观察可以看出,各组小鼠肾脏组织中肾皮质及肾髓质分界清晰,肾小球分散且分布均匀,周围组织未见明显病变,均为正常肾脏组织。肾脏的基本功能是产生尿液[24-25],清除体内代谢产物及不可被吸收的残渣,具有保证机体内环境的稳定和新陈代谢的正常进行的作用[26-29],说明SCS-F2对肾脏不具有毒副作用。
异常隐窝灶(aberrant crypt foci,ACF)是结直肠的一种癌前病变,是结直肠癌发生发展过程中的一个重要阶段[30-31]。因此,对ACF的检测和改善可以有效预防结直肠癌的早期发生[32]。如图5所示,各组中小鼠结肠隐窝细胞排列整齐规则;对比正常对照组,SCS-F2处理组中不论是雄性或者是雌性小鼠中结肠均为出现柱状细胞和杯状细胞增生的现象。如图6所示,与正常对照组和SCS处理组相比,SCS-F2处理后ACF数量较低,仅为6.11±2.09(雄性)和6.00±3.21(雌性),说明SCS-F2具有预防和治疗结直肠癌的潜力。综合以上结果,SCS-F2属于实际无毒级,对小鼠内脏器官无不良影响。根据《保健食品检验与技术评价规范》,当死亡数量≤50%时,可以进入下一阶段的毒理学试验,实验结果说明实验组在1 000 μg/(g·d)剂量下满足食品安全要求,可初步确定SCS-F2安全。

图6 SCS和SCS-F2对小鼠结肠ACF的影响Fig. 6 Effects of SCS and SCS-F2 on colonic aberrant crypt foci in mice
3 结 论
本实验以SCS为原料,以结直肠癌细胞抑制率为指标,利用酶解法和响应面法结合的手段,确定最佳酶解制备条件,通过凝胶层析色谱,分离纯化出具有高活性的低分子质量SCS;采用小鼠急性毒性实验,对SCS-F2的食用安全性进行评价。结果显示,制备的低分子质量SCS具有较高的抑制结直肠癌增殖活性,且无毒副作用,在1 000 μg/(g·d)剂量下满足保健食品的要求。本研究为开发高活性、低分子质量SCS的制备和研究提供新思路,初步了解SCS是否具有食用安全性,为SCS相关产品的日后开发和利用提供依据。
