莪术醇抑制VEGF诱导的新生血管生成的实验研究
2023-03-13郝雨檬王彩霞马景学李雪景尚庆丽
郝雨檬,王彩霞,马景学,李雪景,尚庆丽
0 引言
新生血管生成在多种疾病致病中发挥重要作用,主要包括肿瘤血管、眼底新生血管、冠状动脉斑块新生血管等[1]。眼底新生血管包括视网膜新生血管(retinal neovascularization,RNV)和脉络膜新生血管(choroidal neovascularization,CNV)常发生于糖尿病视网膜病变、年龄相关性黄斑变性、病理性近视等致盲性眼病中,是视力丧失的重要原因。眼底新生血管的发生机制尚不明确,与基因异常、缺氧、氧化应激、炎症等因素均相关,是多种细胞和因子共同作用的结果,其中血管内皮生长因子(vascular endothelial growth factor,VEGF)发挥关键作用[2-3]。目前临床主要采用玻璃体腔注射抗VEGF药物治疗RNV和CNV,但存在作用靶点单一、复发率高、反复注射引起纤维瘢痕化和视网膜色素上皮(retinal pigment epithelium,RPE)萎缩等问题[4]。中药及中药单体安全、高效、价廉、多靶点,可为药物防治眼底新生血管提供新的思路和方法。莪术醇(Curcumol),分子式C15H24O2,倍半萜类,是中药莪术的主要活性成分,具有抗肿瘤、抗炎、抗纤维化等多种生物活性,临床应用广泛,但在新生血管生成中的作用尚不明确[5-6]。人脐静脉血管内皮细胞(HUVECs)是体外常用的内皮细胞模型,也是RNV和CNV体外研究常用的细胞模型[7-9]。本研究利用HUVECs体外分析莪术醇对新生血管生成的抑制作用,为后续其应用于眼底新生血管的治疗研究提供理论和技术支持。
1 材料和方法
1.1材料
1.1.1细胞HUVECs细胞购自湖北丰辉生物科技有限公司。
1.1.2主要试剂及仪器莪术醇(HY-N0104,美国MedChemExpress公司),VEGF(100-20,美国PeproTech公司),DMEM培养基(美国Gibco公司),胎牛血清(fetal bovine serum,FBS)(以色列 Biological Industries公司),CCK-8检测试剂盒(HY-K0301,美国MedChemExpress公司),EdU-594细胞增殖检测试剂盒(C0078,碧云天生物技术公司),Transwell小室(8.0μm,24孔,3422,美国Corning公司),Matrigel基质胶(356234,美国Corning公司),β-actin(20536-1-AP,武汉三鹰生物技术公司),Akt(4691)、p-Akt(4060)、S6(2217)和p-S6(4858)抗体(美国Cell Signaling Technology公司)。细胞培养箱、低温高速离心机(美国Thermo公司),倒置相差显微镜(日本Olympus公司),激光共聚焦显微镜(德国Carl Zeiss公司),酶标仪(美国BioTek公司)。
1.2方法
1.2.1细胞培养及分组HUVECs细胞用含10% FBS和1%青-链霉素的DMEM培养基,于37℃、5% CO2的恒温培养箱中培养,待细胞生长至90%融合时,采用0.25%胰酶消化,1∶2传代,取对数生长期的细胞进行实验。莪术醇用二甲基亚砜(dimethyl sulfoxide,DMSO)配制为400mmol/L储备液,使用时用培养基稀释为相应浓度。将细胞分为对照组、VEGF组、莪术醇+VEGF组,实验组培养基中分别加入相应浓度莪术醇和/或50ng/mL VEGF,对照组加入0.1%DMSO。
1.2.2CCK-8法检测细胞增殖取1×104/mL细胞接种于96孔板中,过夜培养后用无FBS的培养基饥饿24h,分别用各浓度莪术醇和VEGF处理24h,各孔更换新鲜培养基,向每孔加入10μL CCK-8溶液,置于37℃培养箱内孵育1h,酶标仪测定450nm处吸光度。
1.2.3EdU实验检测细胞增殖取1×104/mL细胞接种于96孔板中,过夜培养后用无FBS的培养基饥饿24h,分别用各浓度莪术醇和VEGF处理24h,加入等体积的10mmol/L EdU,继续孵育2h;然后用4%多聚甲醛固定,0.3% Triton X-100通透,加入50μL反应液,室温避光孵育30min,Hoechst 33342溶液进行细胞核染色,荧光显微镜下观察并拍照,增殖细胞(EdU阳性)在荧光显微镜下呈现红色荧光。
1.2.4Transwell迁移实验分析细胞迁移用无FBS培养基培养细胞24h,重悬细胞为 2×105/mL,加入不同浓度莪术醇,向Transwell小室的上室加入100μL细胞悬液,下室加入600μL含10% FBS和/或50ng/mL VEGF的培养基,培养24h;取出小室,加入4%多聚甲醇固定,0.1%结晶紫染色细胞,棉签擦除小室内面未穿过的细胞,PBS洗净,显微镜下随机选取5个视野计算迁移细胞数。
1.2.5管腔形成实验分析血管生成将Matrigel胶放入4℃冰箱过夜融化,加入预冷的48孔板中,每孔100μL,置于37℃培养箱中凝固1h。取对数生长期细胞制成2.5×105/mL的细胞悬液,各组加入不同浓度的莪术醇和VEGF处理,各取100μL加入到Matrigel胶的孔板中,培养24h,显微镜下观察管腔形成情况,随机选取5个视野,Image J软件计算管腔的分支数量和长度。
1.2.6Westernblot分析p-Akt和p-S6表达收集HUVECs细胞,提取总蛋白,BCA法测定样本蛋白含量。SDS-PAGE分离蛋白,随后将蛋白质转印至PVDF膜上,5%脱脂奶粉室温封闭1h,分别加入抗p-Akt(1∶1000)、抗p-S6(1∶2000)、抗Akt(1∶2000)、抗S6(1∶2000)和抗β-actin(1∶1000)一抗,4℃孵育过夜;TBST洗涤3次,加入HRP标记的二抗,室温作用1h,TBST洗涤3次后加入ECL反应液,BIO-RAD凝胶成像系统进行拍照;Image J软件对蛋白条带进行灰度分析,通过分析目的蛋白与内参对照灰度比值计算目的蛋白相对表达量。

2 结果
2.1各组细胞增殖能力比较CCK-8实验结果显示,各组细胞OD450值总体比较差异有统计学意义(F=18.346,P<0.001);其中,VEGF组OD450值显著高于对照组,差异有统计学意义(t=3.80,P<0.01);50、100、200μmol/L莪术醇+VEGF组OD450值与VEGF组比较差异无统计学意义(t=-0.49、-0.71、-1.10,均P>0.05),400、800μmol/L莪术醇+VEGF组OD450值显著低于VEGF组,差异有统计学意义(t=-3.49,P<0.01;t=-8.58,P<0.001),见图1。但800μmol/L莪术醇+VEGF组OD450值低于对照组,可能会抑制正常细胞功能,故后续实验仅采用200、400μmol/L莪术醇处理细胞。
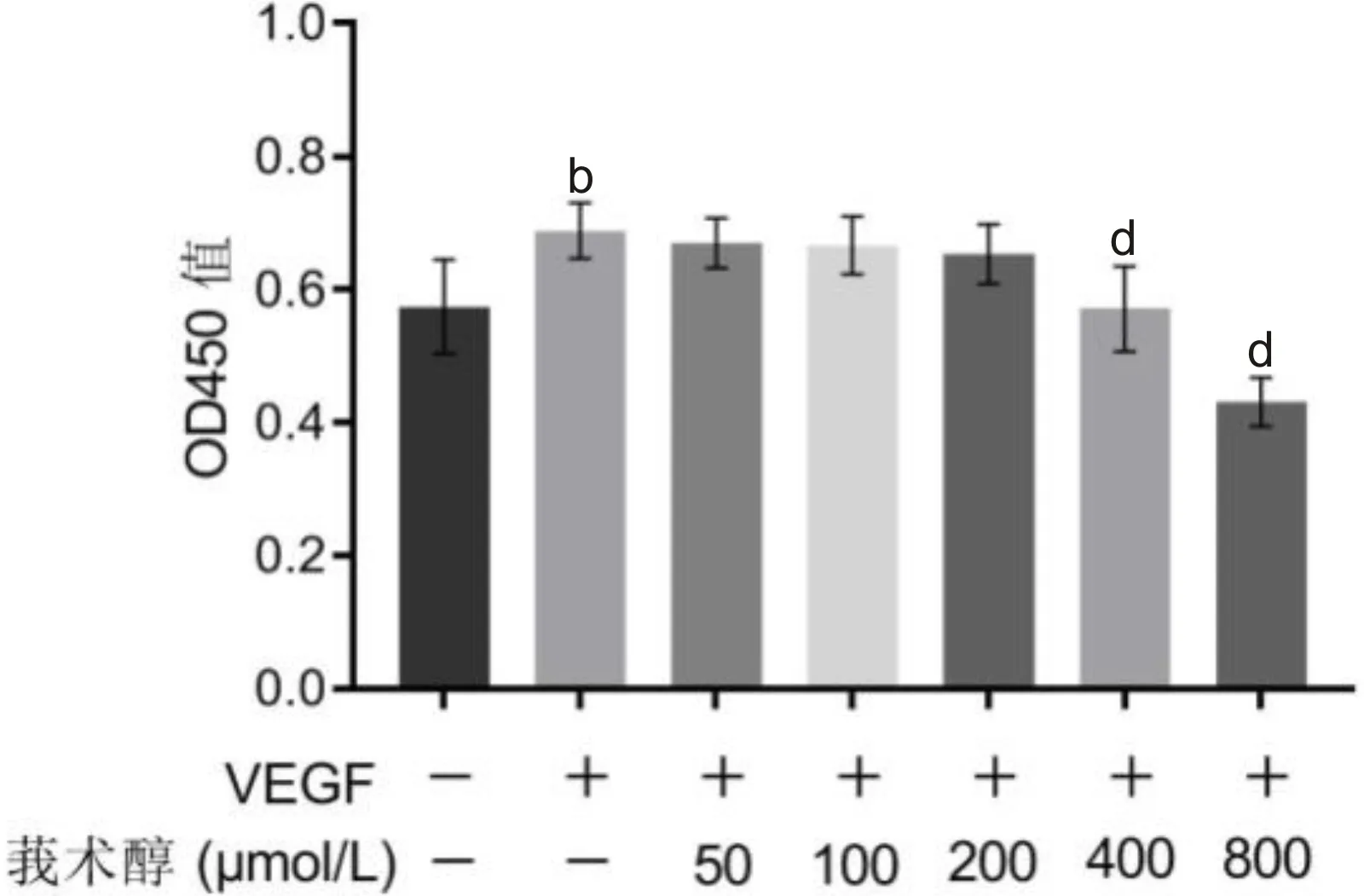
图1 CCK-8实验中各组细胞OD450值比较 bP<0.01 vs 对照组;dP<0.01 vs VEGF组。
EdU实验结果显示,各组细胞增殖率总体比较差异有统计学意义(F=27.814,P<0.001);其中,VEGF组细胞增殖率高于对照组,差异有统计学意义(t=6.11,P<0.001);200μmol/L莪术醇+VEGF组细胞增殖率与VEGF组比较差异无统计学意义(t=-1.41,P>0.05);400μmol/L莪术醇+VEGF组细胞增殖率显著低于VEGF组,差异有统计学意义(t=-7.83,P<0.001),见图2。
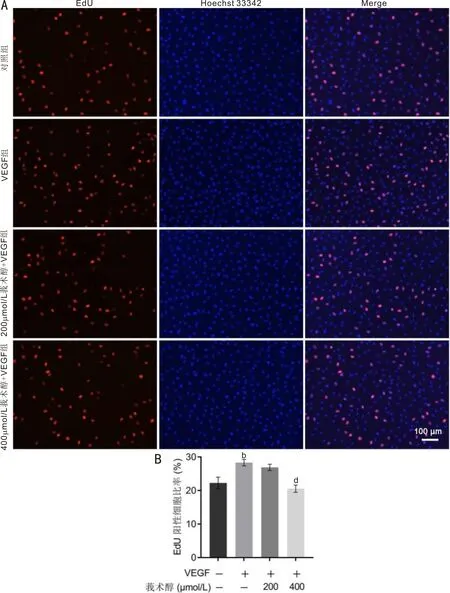
图2 各组细胞EdU染色结果比较 A:各组细胞EdU染色的荧光显微镜像,红色示EdU染色阳性细胞,蓝色示Hoechst 33342细胞核染色;B:定量比较各组细胞增殖率,bP<0.01 vs 对照组;dP<0.01 vs VEGF组。
2.2各组细胞迁移率比较Transwell实验结果显示,各组细胞迁移数总体比较差异有统计学意义(F=49.132,P<0.001);其中,VEGF组迁移细胞数相比对照组明显增加,差异有统计学意义(t=9.65,P<0.001);200μmol/L莪术醇+VEGF组细胞迁移数与VEGF组比较差异无统计学意义(t=2.09,P>0.05);400μmol/L莪术醇+VEGF组迁移细胞数相比VEGF组明显降低,差异有统计学意义(t=-9.34,P<0.001),见图3。
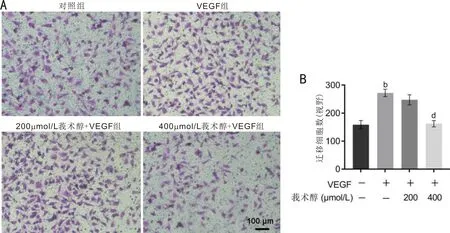
图3 Transwell实验中各组细胞迁移比较 A:各组迁移细胞的显微镜像;B:定量比较各组迁移细胞数,bP<0.01 vs 对照组;dP<0.01 vs VEGF组。
2.3各组细胞管腔形成能力比较管腔形成实验结果显示,各组细胞形成管腔的分支数量和分支长度总体比较差异均有统计学意义(F=32.585、23.179,均P<0.001);其中,VEGF组形成管腔的分支数量和分支长度高于对照组,差异均有统计学意义(t=7.23、5.99,均P<0.001);200μmol/L莪术醇+VEGF组细胞形成管腔的分支数量和分支长度与VEGF组比较差异无统计学意义(t=-0.22、-0.57,均P>0.05);400μmol/L莪术醇+VEGF组细胞形成管腔的分支数量和分支长度明显低于VEGF组,差异有统计学意义(t=-6.97、-6.33,均P<0.001),见图4。
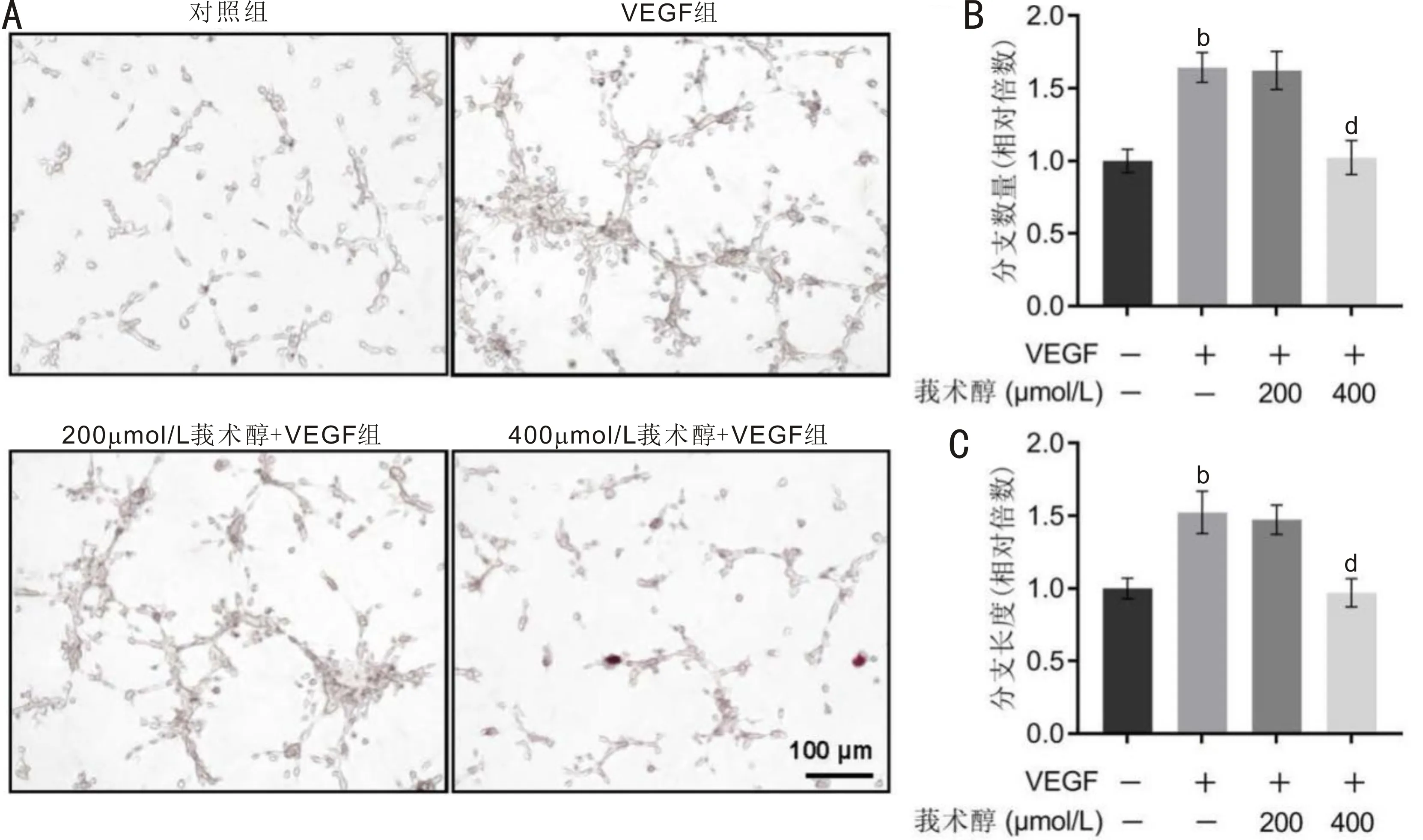
图4 各组细胞管腔形成情况 A:各组细胞形成管腔的显微镜像;B:定量比较各组细胞形成管腔的分支数量;C:定量比较各组细胞形成管腔的分支长度。bP<0.01 vs 对照组;dP<0.01 vs VEGF组。
2.4各组细胞p-Akt和p-S6表达水平比较为了分析莪术醇作用于血管生成的信号通路机制,本研究检测Akt/mTORC1信号通路的关键效应因子p-Akt(S473)和p-S6(S235/236)的相对表达水平。Western blot检测结果显示,各组细胞Akt和S6相对表达水平总体比较,差异无统计学意义(F=3.938、4.581,均P>0.05),p-Akt和p-S6相对表达水平总体比较,差异有统计学意义(F=10.113、5.407,均P<0.05);其中,与对照组相比,VEGF组细胞p-Akt和p-S6相对表达水平差异无统计学意义(t=0.10、-0.78,均P>0.05),而400μmol/L莪术醇+VEGF组细胞p-Akt和p-S6相对表达水平较VEGF组明显降低,差异有统计学意义(t=-3.45、-2.90,均P<0.05),见图5。

图5 Western blot检测各组细胞p-Akt和p-S6蛋白表达水平 A:各组细胞蛋白表达电泳图;B:定量比较各组细胞p-Akt相对表达水平,用p-Akt/Akt灰度值比值反映p-Akt相对表达水平;C:定量比较各组细胞p-S6相对表达水平,用p-S6/S6灰度值比值反映p-S6相对表达水平。aP<0.05 vs VEGF组。
3 讨论
目前抗VEGF药物治疗作为RNV和CNV的一线治疗方案,虽取得一定疗效,但治疗的局限性也很明显:(1)药物作用靶点单一,作用时间短,停药后易复发,需要多次注射,有高于50%的患者在持续抗VEGF治疗1a后仍存在活动性病灶;(2)反复注射引起的副作用,尤其是纤维瘢痕化和RPE萎缩,使患者术后视力恢复不良;(3)此类药物价格昂贵[4,10]。因此,寻找新的治疗药物和方案显得尤为迫切,安全、高效、价廉、多靶点的中药及中药单体是一个重要选择。
莪术醇是中药莪术(蓬莪术,广西莪术和温郁金等的干燥根茎)的挥发油中提取的单体,是莪术油中含量最高的有效成分[5]。现代药理学研究显示,莪术醇具有较强的抗癌作用,且具有低毒和不引起白细胞数量减少等优点,对临床多种肿瘤如肝癌、乳腺癌、胃癌和血液系统恶性肿瘤等均有一定的治疗作用[11-12]。研究证实,莪术醇可靶向并抑制许多异常激活的细胞生长或存活相关的信号通路,从而诱导多种肿瘤细胞的凋亡或死亡,如PI3K/Akt/mTOR、Wnt、ERK/NF-κB信号通路等[13-15]。因此莪术醇可能通过抑制多种细胞生长信号通路,从而发挥抑制新生血管形成的功效。目前关于莪术醇对血管内皮细胞的作用研究还非常少,南京中医药大学的研究显示莪术醇可抑制肝窦内皮细胞毛细血管化,是肝纤维化的潜在治疗药物[16-17]。另有研究显示,莪术油可以抑制高糖下的人视网膜血管内皮细胞的增殖和VEGF表达,具有抗视网膜新生血管的作用[18]。本研究重点分析了中药单体莪术醇对新生血管生成的抑制作用及机制,探讨其应用于眼底新生血管治疗的可能性。
内皮细胞的增殖、迁移及管腔形成是血管生成的必经过程,VEGF在这一过程中起关键作用。既往关于CNV的研究中,恒河猴脉络膜血管内皮细胞RF/6A经常作为细胞模型,但2018年Makin等[19]证实RF/6A细胞已不再具有关键的内皮细胞性质。目前HUVECs仍是CNV体外研究常用的细胞模型,同时在RNV的研究中,HUVECs细胞模型也应用广泛。本研究采用体外VEGF诱导HUVECs细胞增殖、迁移及管腔形成,观察莪术醇对上述过程的影响和机制,为莪术醇应用于临床治疗眼底新生血管提供体外实验基础。本研究结果显示,莪术醇可有效抑制HUVECs的增殖、迁移和管腔形成。分析不同浓度莪术醇的作用效果发现,当莪术醇浓度≤200μmol/L时无明显抑制效果,而当浓度为400、800μmol/L时,莪术醇可以有效抑制内皮细胞增殖,但800μmol/L莪术醇使内皮细胞活性明显低于未加VEGF的对照组,可能对内皮细胞的正常功能造成影响,因此后面的细胞实验中未再采用此浓度,400μmol/L莪术醇可能是更安全且有效的,这为以后动物实验探索体内给药浓度提供了依据。
为了探究莪术醇抑制新生血管生成的分子机制,本研究检测了Akt/mTORC1通路,其是调节细胞生长、代谢、分化的关键信号通路,Akt磷酸化后可激活mTORC1,S6为mTORC1下游的主要效应因子,磷酸化后可促进蛋白质合成,同时p-Akt可调控细胞存活和增殖。Akt/mTORC1通路在新生血管生成中发挥重要作用,在RNV和CNV动物模型中,通过玻璃体腔注射或口服抑制剂阻止Akt/mTORC1活化可显著抑制新生血管形成[20-21]。此外,研究者也在尝试将mTOR抑制剂应用于年龄相关性黄斑变性的临床治疗,可通过其多种药理作用,包括抗炎、抗增殖、抗迁移和诱导自噬,在改善CNV和保护RPE方面发挥显著功效[22-23]。本研究结果显示莪术醇可以有效抑制内皮细胞中Akt和S6的磷酸化,抑制Akt/mTORC1通路活化,提示莪术醇抑制血管生成的一个可能机制是调控Akt/mTORC1通路。
本研究证实,莪术醇可在体外有效抑制VEGF诱导的血管内皮细胞增殖、迁移和血管形成,并抑制Akt/mTORC1通路活化,具有抑制新生血管的潜在作用。但本研究只是对莪术醇抑制新生血管作用的初步探索,应进一步在动物模型中深入分析莪术醇对RNV和CNV形成的作用与机制及其最佳给药途径和剂量、安全性、药代动力学特征等,为莪术醇在眼底新生血管疾病中的科学使用提供更多依据。
