基因治疗在眼底血管性疾病中的应用和展望
2023-03-13张朝阳张敬香张敬法
张朝阳,张敬香,张敬法
0 引言
随着遗传学基础研究取得重大进展,基因治疗已经成为很多难以治愈疾病的潜在治疗选择。基因治疗在眼部的应用取得了巨大成功,具体原因如下:(1)眼睛具有解剖尺寸小、多细分隔间、便于手术进入等特点,因此每个基因载体经眼内注射后可以形成局部高浓度,即大约每100μL达到1.0×1010至2.0×1010拷贝数,大大减少了治疗所需的载体总量。(2)由于血-视网膜屏障和独特的眼内微环境,使眼睛成为相对封闭和相对免疫豁免的区域,这些特性可以限制载体的全身扩散、并减少免疫反应。(3)眼睛是成对存在的,因此基因治疗可以在动物模型和临床试验受试者中进行自身比较。鉴于以上独特优势,眼睛一直处于基因治疗转化研究的前沿领地[1]。2017-12,美国食品药品监督管理局(Food and Drug Administration,FDA)批准了首个用于眼遗传性疾病的基因治疗产品Luxturna,用于治疗2型莱伯氏先天性黑矇(Leber’s congenital amaurosis 2,LCA2)[2]。Luxturna基于腺相关病毒(adeno-associated virus,AAV)载体,采用基因补充策略将正常的人源RPE65基因导入患者视网膜。Luxturna的问世为遗传性和获得性视网膜疾病基因治疗的临床转化研究奠定了基础。目前,数十项视网膜基因治疗临床试验正在开展,所涉及的疾病包括全色盲、1型莱伯氏先天性黑矇、Stargardt病、X连锁视网膜色素变性、Usher综合征、无脉络膜症、视网膜色素变性、X染色体连锁视网膜劈裂、年龄相关性黄斑变性(age-related macular degeneration,AMD)、糖尿病视网膜病变(diabetic retinopathy,DR)等[3-4]。
基因治疗在单基因遗传性视网膜疾病(inherited retinal diseases,IRDs)中取得了巨大成功,但该类疾病比例较低(约为1/3000),且具有基因和表型多样性(>300个致病基因),因此对于罕见突变的特异性治疗的可行性和成本效益都提出了巨大挑战[5]。相比之下,获得性视网膜疾病,如以AMD和DR为代表的眼底血管性疾病的受众群体十分庞大,且该类疾病具有相似的发病机制和干预靶点,因此在基因治疗的应用方面具有巨大潜力。根据世界卫生组织的数据,AMD和DR分列全球性致盲眼病的第3和第5位。AMD是全球性老年人视力损害的主要原因,目前约有超过1.9亿患者,预计到2040年上升至2.88亿[6];DR是全球性工作人群的主要致盲眼病之一,根据国际糖尿病联盟第10版的数据(IDF Diabetes Atlas),2021年全球约5.37亿成年人患有糖尿病,预计到2030年将上升至6.43亿,其中1/3的糖尿病患者会发生不同程度的视网膜病变[7]。此外,眼底血管性疾病还包括视网膜静脉阻塞(retinal vein occlusions,RVOs)、病理性近视继发脉络膜新生血管等。这些疾病具有相似的发病机制,其中一个关键靶点是血管内皮生长因子(vascular endothelial growth factor,VEGF)[8],且anti-VEGF治疗已成为该类疾病的金标准和一线疗法,因此基于VEGF及其相关信号通路的基因治疗研究和临床试验是当前该领域的研究热点[9-10]。本综述首先介绍基因治疗的基本概念和要素,随后重点讨论基因补充和基因编辑在nAMD和DR中的探索、应用、挑战以及未来的发展方向。
1 基因治疗概述
在医学领域,基因治疗特指将具体的、有针对性的核酸聚合物(特别是外源正常基因)导入患者的靶细胞,并在患者体内产生相应基因的直接产物,以纠正或补偿因基因缺陷和异常引起的疾病,以达到治疗目的。按这样的理解,曾被视为基因治疗先驱的减毒活疫苗治疗并不属于现代基因治疗的范畴,因为这些疫苗并不改变接种者的基因。另一方面,进行输血、骨髓移植和器官移植等治疗时,虽然把异体DNA带给了受体患者,但由于其导入的不是特定的基因,也不是依靠特定的基因发挥治疗作用,因此也不属于基因治疗。但利用新技术在DNA水平进行修饰(如基因编辑技术)以治疗疾病的策略应该属于基因治疗的范畴。
1.1基因治疗的策略基因治疗的策略主要包括基因补充和基因编辑(图1)。基因补充主要是将外源性遗传物质导入遗传缺陷的细胞;而基因编辑主要是对内源性基因组进行精确修饰,以纠正突变的等位基因。基因补充对常染色体隐性遗传的突变很有效;然而,功能获得性(gain-of-function)显性突变则需要通过敲除或抑制突变等位基因来纠正疾病表型[1]。

图1 基因补充和基因编辑在眼科中的应用实例 A:目前通过“基因补充”治疗视网膜疾病的临床试验及相关载体信息;B:“基因编辑”技术用于矫正突变基因,如CRISPR/Cas9位点特异性核酸酶矫正CEP290基因。
1.2眼底基因治疗给药途径科学的给药途径是保证基因特异且有效导入眼底的重要决定因素。最常见的给药途径是玻璃体腔注射和视网膜下腔注射,另有一些研究采用脉络膜上腔给药。如图2所示,玻璃体腔注射可在玻璃体中释放治疗药物,有限转染内层视网膜;而视网膜下腔注射是将载体注射至视网膜下腔,即视网膜色素上皮(retinal pigment epithelium,RPE)和光感受器细胞(photoreceptor,PRs)之间,主要靶向RPE和PRs。尽管玻璃体腔注射更容易操作且载体分布更广泛,但对于RPE和PRs的转染弱于视网膜下腔注射,其原因可能是由于玻璃体和视网膜内存在物理屏障而使载体无法有效到达靶细胞[11]。然而,视网膜下腔注射会导致视网膜短暂脱离,使得原本脆弱的病变视网膜雪上加霜。脉络膜上腔给药为nAMD和其他脉络膜疾病的药物递送提供了额外选择。

图2 视网膜基因治疗的给药途径 红色字体表示处在临床试验阶段的基因治疗。
1.3基因治疗的载体
1.3.1病毒载体基因治疗最常用的载体是病毒载体,包括腺病毒(adenovirus,Ad)、慢病毒(lentivirus,LV)和腺相关病毒(adeno-associated virus,AAV)三种。每一种病毒载体都具有各自的优缺点,见表1。

表1 腺病毒和慢病毒及腺相关病毒的特点比较
1.3.2非病毒载体非病毒载体常用电穿孔法、显微注射法和脂质体等导入目的基因。与病毒载体相比,非病毒基因载体在降低免疫反应风险和转入更大基因的潜力方面具有优势。最近,一些研究将非病毒载体用于视网膜基因导入,并发现至少在短期内对某些IRDs动物模型的治疗是有效的[12]。然而,考虑到非病毒载体治疗持续时间较短及转染效率偏低(特别是在大型动物模型中),因此限制了其在视网膜基因治疗中的广泛应用。在非病毒基因治疗领域,反义寡核苷酸(antisense oligonucleotide,AON)可以用来靶向突变等位基因,导致异常剪接。最近的一项临床试验通过反复玻璃体腔内注射AONs,以此靶向LCA10的致病基因(CEP290 IVS26等位基因),结果表明该治疗没有出现严重的不良事件,且患者在3mo时视力提高[13]。基于此,相关临床试验(NCT03913143、NCT03780257)正在进行,这将为AONs是否适用于视网膜基因治疗提供重要证据,但该方法需要多次给药。
2 眼底血管性疾病
2.1新生血管性年龄相关性黄斑变性AMD的晚期病理表现包括:地图样萎缩(geographic atrophy,GA)和新生血管性AMD(nAMD),但目前临床上只有针对nAMD的治疗方法。Anti-VEGF药物已成为治疗nAMD的一线药物,该治疗能显著抑制脉络膜新生血管、减少视网膜渗漏,并提高患者视力[14-16]。然而,高频的玻璃体腔注射造成患者精神上和经济上的双重负担,导致患者依从性较差,所以真实世界中anti-VEGF的治疗效果并没有达到关键随机对照试验(randomized controlled trial,RCT)中的水平[6,17-18]。
2.2DR 糖尿病患者中约30%~40%会出现不同程度的DR,其中5%~10%会表现出威胁视力的DR(vision threatening DR,VTDR),包括严重的非增殖性DR(non-proliferative DR,NPDR)、增殖性DR(proliferative DR,PDR)和糖尿病性黄斑水肿(diabetic macular edema,DME)[19]。需要注意的是,PDR和DME是造成 DR 患者视力降低的主要原因,其中DME可能出现在DR病程的任何阶段[20]。由于VEGF是导致DR发病的重要因子,所以目前anti-VEGF也是PDR和DME的一线治疗方法[21]。同样,anti-VEGF治疗PDR和DME也存在着频繁注射、费用昂贵以及患者依从性差等劣势,导致真实世界中的治疗效果不及临床试验[22-23]。
2.3其他眼底血管性疾病由于VEGF/VEGFR相关信号通路在眼底血管性疾病的发生发展中发挥了非常重要的作用,所以VEGF抑制剂也常用于治疗RVOs继发的黄斑水肿(RVOs-ME)、脉络膜新生血管(choroidal neovascularization,CNV)和早产儿视网膜病变(retinopathy of prematurity,ROP)等。RVOs是仅次于DR的最常见视网膜血管类疾病,目前世界范围内患者约为2800万人[24],RVOs-ME的anti-VEGF治疗同样面临着与nAMD、DME、PDR类似的困扰。ROP是一种危及视力的儿童视网膜血管疾病,在新生血管增殖期可接受VEGF抑制剂治疗。由于患儿处于发育阶段,抗VEGF治疗需要合理把握治疗窗口、治疗剂量和治疗频次[25]。
3 基因治疗在眼底血管性疾病中的应用
与单基因IRDs相比,眼底血管性疾病的基因治疗更多地依赖于相关信号通路/治疗靶点(如VEGF),对细胞类型或位点的特异性要求相对较低[26]。但在监管批准和临床应用方面,眼底血管性疾病基因治疗的门槛较高,即需要与现有标准疗法进行严格评估和对比,且表现出明显优势的前提下才能被采用。如前文所述,常规的anti-VEGF治疗存在诸多问题导致患者依从性较差、治疗效果欠佳。而基因治疗介导的anti-VEGF策略可以有效克服这些短板[27],其最大的优势是可以实现长期有效的VEGF阻断,避免了频繁的眼内注射[26]。
针对眼底血管性疾病,研究者尝试了各种基因治疗策略(图3),主要包括基因补充、基因编辑、以及RNA干扰等技术[26]。其中,通过基因补充“内源性anti-VEGF”的基因治疗研究最多,且最接近临床转化[28-30]。表2汇总了目前正在进行的眼底血管性疾病的基因治疗临床试验,其中nAMD相关临床试验最多,此外还涉及干性AMD、DME以及DR(非DME)。
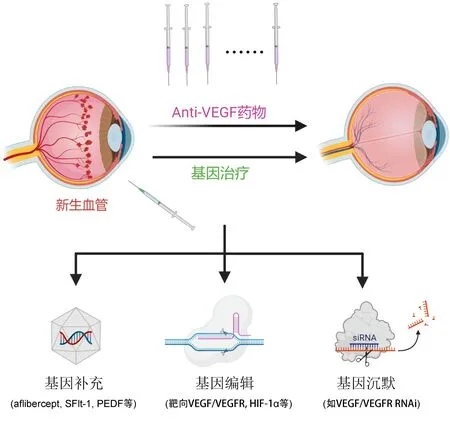
图3 眼底血管性疾病的常规anti-VEGF治疗和基因治疗 常规治疗采用定期、多次注射anti-VEGF药物;基因治疗策略主要包括基因补充、基因编辑以及基因沉默。
3.1基因补充如前所述,基因补充可以使治疗性蛋白长期内源性生成,相当于创建了一个“眼内生物工厂”。由于anti-VEGF已成为眼底血管性疾病的一线治疗药物,所以基于基因治疗持续表达anti-VEGF蛋白是最容易实现临床转化的。正如表2所示,当前大部分眼底血管性疾病基因治疗临床试验都采用了AAV介导的基因补充anti-VEGF相关分子的策略,例如表达合成的重组anti-VEGF蛋白(aflibercept)或内源性VEGF抑制剂(soluble fms-like tyrosine kinase 1,SFlt-1)。本节我们将重点介绍3种基于anti-VEGF的基因治疗产品。

表2 AMD和DR基因治疗临床试验汇总 (截至2022-04)
3.1.1ADVM-022 ADVM-022(Adverum Biotechnologies,Inc.)通过玻璃体腔内注射AAV2.7m8载体诱导眼内产生aflibercept,目前用来治疗nAMD和DME。一项Ⅰ期OPTIC研究的2a结果显示:nAMD患者玻璃体腔内注射ADVM-022耐受性良好;眼内aflibercept可持续产生2a,减少了患者频繁注射的治疗负担;期间患者视力稳定,视网膜厚度降低(ADVM-022 Intravitreal Gene Therapy for Neovascular AMD - Phase 1 OPTIC Study;NCT03748784)。ADVM-022针对nAMD患者的Ⅲ期临床试验正在计划中。此外,ADVM-022针对DME患者的一项Ⅱ期临床试验正在进行中(NCT04418427)。
3.1.2SFlt-1 SFlt-1是一种机体天然的内源性VEGF抑制剂,通过AAV介导的基因补充SFlt-1可以实现其内源性表达,目前用来治疗nAMD[28-30]。一项Ⅰ期临床试验(NCT01024998)结果显示:玻璃体腔内注射AAV2-sFlt-1是安全的,且耐受性良好;但sFlt-1的表达水平和疗效并不稳定,研究者认为可能是受到本底anti-AAV2血清抗体的影响[29]。在另一项Ⅰ/Ⅱa期临床试验(NCT01494805)中,视网膜下腔注射rAAV-sFlt-1是安全的且耐受性良好;但该治疗并没有显著改善患者视力或视网膜厚度[28,31]。
3.1.3RGX-314 RGX-314(REGENXBIO Inc.)通过AAV介导的基因补充anti-VEGF抗原结合片段(antigen-binding fragment,Fab),目前用以治疗nAMD和DR(非DME)。一项Ⅰ/Ⅱa期临床试验(NCT03066258)已经证明该治疗对于nAMD患者具有良好的耐受性和安全性;RGX-314可稳定患者视力、降低视网膜厚度[3]。同时,针对nAMD的Ⅱ期(NCT03999801)和Ⅱb/Ⅲ期(NCT04514653、NCT04704921、NCT04832724)临床试验正在进行中。此外,针对DR(非DME)患者的一项Ⅱ期临床试验(NCT04567550)正在进行中。
3.1.4其他靶点的基因补充眼底血管性疾病的基因治疗临床试验除了聚焦经典靶点VEGF外,还涉及一些其他分子。两项Ⅰ期临床试验通过基因补充生成内源性抗血管生成因子用来治疗nAMD,分别靶向色素上皮衍生因子(NCT00109499)、内皮抑素和血管抑制素(NCT01301443)[32-33]。另有一些临床试验靶向补体途径的抑制因子,例如靶向CD59治疗nAMD(NCT03585556)和干性AMD(NCT03144999);靶向补体因子Ⅰ(NCT03846193、NCT04437368、NCT04566445)用以治疗干性AMD。
3.2基因编辑基于基因组中成簇有规律的间隔短回文重复序列(Clustered Regularly Interspaced Short Palindromic Repeat,CRISPR)的基因编辑技术在IRDs的治疗中取得了巨大进展[34],也为眼底血管性疾病的基因治疗提供了新思路,即借助基因编辑技术对血管生成通路中的信号分子进行敲除/敲低来实现治疗目的[35]。目前,基于基因编辑技术治疗眼底血管性疾病仅限于临床前研究,主要集中在小鼠CNV模型中[35-41]。这些研究大多采用视网膜下腔或玻璃体腔注射病毒载体,如AAV和慢病毒来导入核酸酶;另有一些研究尝试采用非病毒载体,如直接使用预组装的Cas9核糖核蛋白,以尽量减少免疫和抗体反应[38]。CRISPR基因编辑系统靶向的基因一般为血管生成通路相关信号分子,包括VEGF-A、VEGF受体2(VEGFR2)、低氧诱导因子-1α(HIF-1α)等[35-41]。基因编辑技术可以实现长期抗新生血管的作用,但也要考虑其脱靶效应带来的风险,这些问题将在未来的临床前和临床试验中予以考虑和优化。
3.3基因沉默基因沉默在基因治疗中的应用也十分广泛。基因沉默是把反义核酸(如siRNA、shRNA、反义RNA、反义DNA等)和核酶等导入细胞内,在转录和翻译水平阻断特定基因的异常表达,或者破坏某个基因结构使其不表达,从而实现治疗的目的[42]。其中,RNA干扰技术(RNAinterfere,RNAi)已在眼底血管性疾病治疗中进行了相关探索。一项Ⅲ期临床试验(NCT00557791)结果显示:一种靶向VEGF的siRNA药物Bevasiranib治疗nAMD的效果没有达到预期,因此试验终止[43]。另一种靶向VEGF受体1(VEGFR1)的RNAi药物Sirna-027(AGN211745)进行了Ⅱ期临床试验(NCT00395057)评估,同样也因治疗效果不佳而选择终止[42]。需要注意的是,单纯的RNAi药物并不能提供持久的抑制效果,所以仍需要进行频繁眼内注射;而病毒(如AAV)介导的内源性shRNA/miRNA可以实现长期有效抑制VEGF的目的[44]。
4 讨论与展望
基因治疗在IRDs中的研究和应用已趋向成熟,这也为眼底血管性疾病的基因治疗提供了理论和技术基础。基因治疗通过提供有效和持续的抗血管生成药物释放,克服了传统疗法的缺陷,进而减轻了患者的经济和精神负担。虽然眼底血管性疾病的基因治疗具有巨大的应用潜力,但目前仍面临一些挑战。与常规anti-VEGF治疗相比,基因治疗最大优势在于治疗效果的持久性,但持续抑制VEGF可能是一把双刃剑。临床研究表明频繁给予anti-VEGF治疗会引起视网膜萎缩或地图样萎缩[45-46],其原因可能是VEGF本身的生理功能也受到了长期慢性的阻断,因此探索可调控的基因治疗可有效解决此类问题[47-49]。此外,眼底血管性疾病基因治疗受制于所选靶点的有效性,因此对该类疾病发病机制的探索尤为重要,以便为基因治疗提供更加关键的治疗靶点。在基础研究中,建立更加具有代表性的AMD/DR/DME动物模型有助于该类疾病基因治疗的转化医学研究。
综上所述,大量基础和临床研究已证实基于基因补充、基因编辑和基因沉默靶向血管生成通路相关信号分子(如VEGF/VEGFR)治疗眼底血管性疾病是安全且有效的;同时,多项正在进行的临床试验也将推进眼底血管性疾病基因治疗的临床转化。基因治疗的发展将会为众多眼底血管性疾病患者带来福音。
