POU2F1调控miR-433-3p抑制胃癌细胞增殖、迁移的实验研究
2023-03-13赵轶峰李明霞胡小敏赵铁军
赵轶峰,李明霞,张 超,胡小敏,王 雄,赵铁军
胃癌是世界范围内一种可致命的癌症,具有复发率高、转移快的特点[1]。尽管胃癌的诊断和治疗取得一定进展,但是临床预后依然很差,5年生存率仅为21.35%[2]。因此,深入了解胃癌进展的分子机制可以为改善其预后提供有价值的生物学标志物和潜在的治疗靶点。微小核糖核酸(miRNA)是一类由19~25个核苷酸组成的单链非编码RNA,能够参与细胞增殖、凋亡、迁移和分化等许多生物过程[3]。最近研究表明,位于14号染色体上的抑癌基因miR-433-3p通过靶向生长因子受体结合蛋白2抑制食管鳞状细胞癌的增殖和侵袭[4]。然而,正如大多数文献报道,对于miR-433-3p的研究仅局限于靶基因的鉴定及对细胞生物学功能的影响方面,而关于其自身转录调控机制的研究却很少。本研究通过生物信息学预测发现第2类POU结构域转录因子1(POU2F1)与miR-433-3p启动子区存在结合位点,POU2F1作为POU同源域家族的一员,已有研究显示其在肝癌组织中高表达,POU2F1过表达促进了肝癌细胞增殖、集落形成、上皮间质转化、迁移和侵袭,而沉默POU2F1表达则抑制了这些恶性表型[5]。但POU2F1调控miR-433-3p对胃癌细胞增殖、迁移的影响鲜有报道。因此,本研究旨在探索POU2F1对miR-433-3p表达的调控作用及对胃癌细胞增殖、迁移的影响,以期进一步阐明胃癌的发病机制。
1 材料与方法
1.1材料
1.1.1胃癌组织样本及细胞:2021年6月—2022年4月在河北北方学院附属第一医院共收集45例胃癌组织及与之匹配的癌旁组织(距癌组织4 cm处)。其中男22例,女23例;年龄(57.25±3.45)岁;Ⅰ~Ⅱ期24例,Ⅲ~Ⅳ期21例。将所有临床组织标本在液氮中速冻后保存于-80 ℃冰箱中。所有临床组织标本的组织学诊断至少由2名病理专家证实。胃癌患者在手术或活检前均未接受任何抗肿瘤治疗。所有患者在本研究开始前签署本研究知情同意书。人胃黏膜上皮细胞株GES-1和人胃癌细胞株BGC-823、MKN-28、SGC-7901均购自上海信裕生物科技有限公司,批号分别为XY19167、XY19325、XY26331、XY23115。本研究获得医院医学伦理委员会批准。
1.1.2主要试剂与仪器:POU2F1小干扰RNA(siRNA)、POU2F1 siRNA阴性对照、miR-433-3p siRNA、miR-433-3p siRNA阴性对照及miR-433-3p、POU2F1、U6引物均由上海基屹生物科技有限公司设计合成;RPMI-1640培养基(批号KE1902)、Trizol试剂(批号KE13127)、RIPA裂解液(批号KE04361)、LipofectamineTM2000转染试剂盒(批号KE90117)、四甲基偶氮唑蓝(MTT,批号KE20035)均购自上海创凌生物科技有限公司;胎牛血清(FBS,批号90170)、羊抗鼠二抗(批号33175)、化学发光试剂盒(批号40219)均购自北京威瑞谷生物技术有限公司;鼠源POU2F1(批号1076R)、GAPDH单克隆抗体(批号1013R)、双荧光素酶报告基因检测试剂盒(批号4159K)均购自常州福生生物技术有限公司;CO2培养箱(型号Galaxy 48)、酶标仪(型号Sunrise)、凝胶成像仪(型号ChampChemi 580)均购自北京博劢行仪器有限公司;qRT-PCR仪(型号CG-05)、Transwell小室(型号PIEP12R48)均购自北京明阳科华科技有限责任公司。
1.2研究方法
1.2.1细胞培养:将人胃黏膜上皮细胞株GES-1及人胃癌细胞株BGC-823、MKN-28、SGC-7901在RPMI-1640培养基中培养,该培养基含有10%FBS、链霉素100 U/ml和青霉素100 U/ml,置于含有5% CO2的37 ℃培养箱中。取对数生长期细胞用于后续实验。
1.2.2qRT-PCR检测胃癌组织、癌旁组织和GES-1、BGC-823、MKN-28、SGC-7901细胞中miR-433-3p、POU2F1 mRNA表达:将胃癌组织和癌旁组织匀浆,使用Trizol试剂从胃癌组织、癌旁组织和GES-1、BGC-823、MKN-28、SGC-7901细胞中提取总RNA。使用NanoDrop 2000分光光度计测定RNA浓度后,将RNA反转录为cDNA。在PCR系统上使用TransStart® Green qPCR SuperMix进行PCR扩增。引物序列:miR-433-3p上游引物:5′-AGAAGTACGGTGAGCCTGTC-3′,miR-433-3p下游引物:5′-GCTCTCACTCTGTCACCCAG-3′;POU2F1上游引物:5′-ATCTGGACTACGCTAGCTGAC-3′,POU2F1下游引物:5′-CGTAGTCCGATCAAGCTAGCA-3′;U6上游引物:5′-CTCGCTTCGGCACACA-3′,U6下游引物:5′-TGGTGTCGTGGAGTCG-3′。以U6作为内参,通过2-ΔΔCt法分析miR-433-3p、POU2F1 mRNA的相对表达。每种细胞设置6个重复组。
1.2.3蛋白印迹法检测胃癌组织、癌旁组织和GES-1、BGC-823、MKN-28、SGC-7901细胞中POU2F1蛋白表达:将胃癌组织和癌旁组织匀浆,利用RIPA裂解液提取胃癌组织、癌旁组织和GES-1、BGC-823、MKN-28、SGC-7901细胞中蛋白质,定量蛋白浓度后,通过电泳分离等量蛋白质。电泳结束后,将蛋白质转移至聚偏氟乙烯膜上,然后用5%脱脂牛奶封闭膜2 h,用TBST洗膜3次,再将膜分别与鼠源POU2F1(1︰2000)、GAPDH(1︰3000)一抗在4 ℃下孵育过夜。第2日用TBST洗膜3次后,将膜与羊抗鼠二抗(1︰2000)于室温下孵育3 h,化学发光试剂盒可视化蛋白,采用Image软件对灰度值进行量化分析(内参为GAPDH)。每种细胞设置6个重复组。
1.2.4BGC-823细胞转染与分组:取对数生长期BGC-823细胞,利用LipofectamineTM2000转染试剂盒进行转染,分为空白组(细胞未转染)、POU2F1 siRNA组(POU2F1 siRNA转染细胞)、POU2F1 siRNA-NC组(POU2F1 siRNA阴性对照转染细胞)、miR-433-3p siRNA组(miR-433-3p siRNA转染细胞)、miR-433-3p siRNA-NC组(miR-433-3p siRNA阴性对照转染细胞)、miR-433-3p siRNA+POU2F1 siRNA-NC组(miR-433-3p siRNA和POU2F1 siRNA阴性对照共转染细胞)、miR-433-3p siRNA+POU2F1 siRNA组(miR-433-3p siRNA和POU2F1 siRNA共转染细胞)。每组设置6个复孔。
1.2.5MTT法检测BGC-823细胞增殖能力:将“1.2.4”中转染后培养48 h的各组BGC-823细胞以1×103个/孔的密度接种在96孔板上,向每孔中加入MTT 10 μl,于37 ℃、5% CO2条件下培养3 h,然后向每孔中加入二甲基亚砜150 μl,使用酶标仪测定490 nm波长处的光密度(OD)值,计算BGC-823细胞增殖率,增殖率=各转染组OD值/空白组OD值×100%。
1.2.6Transwell实验检测BGC-823细胞迁移能力:将“1.2.4”中转染后的各组BGC-823细胞加入到无FBS的RPMI-1640培养基重悬后,调整细胞浓度为2×105个/ml,取100 μl转移至Transwell上室中,并使用600 μl含有10% FBS的RPMI-1640培养基填充于Transwell下室中。48 h后,细胞用4%多聚甲醛固定20 min,0.1%结晶紫染色20 min,显微镜下随机选取6个视野计数迁移细胞数目。
1.2.7qRT-PCR和蛋白印迹法检测BGC-823细胞中miR-433-3p、POU2F1 mRNA和蛋白表达:将“1.2.4”中转染后培养48 h的各组BGC-823细胞,按照“1.2.2”和“1.2.3”中的方法检测BGC-823细胞中miR-433-3p、POU2F1 mRNA和蛋白表达。
1.2.8双荧光素酶报告基因实验:使用TransmiR v2.0 database在线软件预测POU2F1与miR-433-3p启动子区的结合位点,分别构建miR-433-3p启动子区野生型(WT)和突变型(MUT)报告质粒,标记为miR-433-3p-WT、miR-433-3p-MUT。按照LipofectamineTM2000转染试剂盒说明书将miR-433-3p-WT和miR-433-3p-MUT分别与POU2F1 siRNA阴性对照或POU2F1 siRNA共转染于BGC-823细胞,分别记为:POU2F1 siRNA-NC+miR-433-3p-WT组(POU2F1 siRNA阴性对照和miR-433-3p-WT共转染)、POU2F1 siRNA+miR-433-3p-WT组(POU2F1 siRNA和miR-433-3p-WT共转染)、POU2F1 siRNA-NC+miR-433-3p-MUT组(POU2F1 siRNA阴性对照和miR-433-3p-MUT共转染)、POU2F1 siRNA+miR-433-3p-MUT组(POU2F1 siRNA和miR-433-3p-MUT共转染)。每组设置6个复孔,转染48 h后,使用双荧光素酶报告基因分析系统评估荧光素酶相对活性。
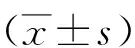
2 结果
2.1胃癌组织、癌旁组织中miR-433-3p及POU2F1 mRNA、蛋白表达比较 与癌旁组织比较,胃癌组织miR-433-3p表达水平显著降低,POU2F1 mRNA和蛋白表达水平显著升高(P<0.05),见表1。
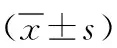
表1 胃癌组织、癌旁组织中miR-433-3p及POU2F1 mRNA、蛋白表达比较
2.2GES-1、BGC-823、MKN-28、SGC-7901细胞中miR-433-3p及POU2F1 mRNA、蛋白表达比较 与GES-1细胞比较,BGC-823、MKN-28、SGC-7901细胞miR-433-3p表达水平均降低,POU2F1 mRNA和蛋白表达水平均升高(P<0.05),其中BGC-823细胞miR-433-3p表达水平最低,POU2F1 mRNA和蛋白表达水平最高。见表2。因此选用BGC-823细胞为研究对象进行后续研究。
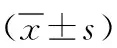
表2 GES-1、BGC-823、MKN-28、SGC-7901细胞中miR-433-3p及POU2F1 mRNA、蛋白表达比较
2.3沉默POU2F1对BGC-823细胞增殖、迁移及miR-433-3p、POU2F1 mRNA和POU2F1蛋白表达的影响 与空白组和POU2F1 siRNA-NC组比较,POU2F1 siRNA组BGC-823细胞增殖率、迁移细胞数目、POU2F1 mRNA和POU2F1蛋白表达水平显著降低,miR-433-3p表达水平显著升高(P<0.05);空白组和POU2F1 siRNA-NC组上述指标比较差异无统计学意义(P>0.05)。见表3。
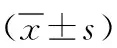
表3 沉默POU2F1对BGC-823细胞增殖、迁移及miR-433-3p、POU2F1 mRNA和POU2F1蛋白表达的影响
2.4沉默POU2F1逆转下调miR-433-3p表达对BGC-823细胞增殖、迁移及miR-433-3p、POU2F1 mRNA和POU2F1蛋白表达的影响 与空白组和miR-433-3p siRNA-NC组比较,miR-433-3p siRNA组和miR-433-3p siRNA+POU2F1 siRNA-NC组BGC-823细胞增殖率、迁移细胞数目显著升高(P<0.05),miR-433-3p表达水平显著降低(P<0.05),POU2F1 mRNA和蛋白表达水平差异无统计学意义(P>0.05);与miR-433-3p siRNA组和miR-433-3p siRNA+POU2F1 siRNA-NC组比较,miR-433-3p siRNA+POU2F1 siRNA组BGC-823细胞增殖率、迁移细胞数目、POU2F1 mRNA和POU2F1蛋白表达水平显著降低,miR-433-3p表达水平显著升高(P<0.05)。见表4。
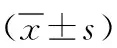
表4 沉默POU2F1逆转下调miR-433-3p表达对BGC-823细胞增殖、迁移及miR-433-3p、POU2F1 mRNA和POU2F1蛋白表达的影响
2.5生物信息学预测miR-433-3p上游转录因子 使用TransmiR v2.0 database预测发现POU2F1与miR-433-3p启动子区存在结合位点,结合位点位于14号染色体上的100881247~100881262区域,结合序列为GGGAGTGCAGAGCAT。双荧光素酶报告基因实验结果表明,POU2F1 siRNA-NC+miR-433-3p-WT组、POU2F1 siRNA+miR-433-3p-WT组、POU2F1 siRNA-NC+miR-433-3p-MUT组及POU2F1 siRNA+miR-433-3p-MUT组荧光素酶相对活性分别为1.09±0.13、2.06±0.19、1.06±0.12、1.04±0.11,与POU2F1 siRNA-NC+miR-433-3p-WT组比较,POU2F1 siRNA+miR-433-3p-WT组荧光素酶相对活性显著升高(P<0.05);POU2F1 siRNA-NC+miR-433-3p-MUT组和POU2F1 siRNA+miR-433-3p-MUT组荧光素酶相对活性比较差异无统计学意义(P>0.05)。
3 讨论
胃癌是癌症相关死亡的第三大原因,也是全球第五大癌症[6]。相关数据统计,东亚地区胃癌发病率急剧升高,该地区男女发病率在全球范围内最高[7-8]。由于缺乏特异性生物学标志物,大多数新诊断的胃癌患者在确诊时已处于晚期[9-10]。因此,迫切需要进一步研究胃癌的发病机制并确定与胃癌相关的特异性标志物。
miRNA在肿瘤细胞增殖、分化、凋亡、迁移和侵袭中发挥重要作用[11-12]。李燕等[13]发现miR-433-3p在宫颈癌细胞中低表达,miR-433-3p过表达可抑制宫颈癌细胞的增殖、迁移及侵袭。万智双等[14]表明miR-433-3p可通过下调丝裂原活化蛋白激酶8表达抑制肝癌细胞MHCC97H的迁移和侵袭。杨艳等[15]阐明下调miR-433-3p可促进结直肠癌HT-29细胞增殖、迁移、侵袭。SUN等[16]报道miR-433-3p通过靶向环磷酸腺苷反应元件结合蛋白来抑制神经胶质瘤细胞的生长、侵袭及迁移。本研究结果显示,miR-433-3p在胃癌组织和胃癌细胞BGC-823、MKN-28、SGC-7901中呈低表达状态,且miR-433-3p在BGC-823细胞中的表达水平最低,因此本研究选择BGC-823细胞进行转染实验。本研究还发现,抑制miR-433-3p表达可明显促进BGC-823细胞的增殖和迁移,提示miR-433-3p在胃癌中发挥着抑癌基因的作用。但关于miR-433-3p上游的调控机制尚不清楚,据报道转录因子可正向或负向调节miRNA的表达[17],因此本研究通过使用TransmiR v2.0 database预测发现转录因子POU2F1与miR-433-3p启动子区存在结合位点。
POU2F1也称为八聚体结合转录因子1,由染色体1q24.1上的基因位点编码。它是一种普遍存在的转录因子,可调节与细胞周期相关靶基因的表达[18]。相关文献报道,POU2F1通过脂肪非典型钙黏蛋白1信号通路促进肝细胞癌的生长和转移,可作为肝癌治疗的靶点[19]。敲低POU2F1表达可导致头颈部鳞状细胞癌细胞的增殖和侵袭数目显著减少[20]。POU2F1在肺癌细胞中高表达,且具有促进肺癌细胞上皮间充质转化、迁移侵袭、增殖及克隆形成等生物学功能[21]。POU2F1在胃癌患者中上调并且与较差的存活率显著相关[22]。有研究报道POU2F1可与miR-4490的启动子序列互补结合调节miR-4490在胃癌中的表达[23]。但POU2F1与miR-433-3p在胃癌中的调控关系尚不十分清楚。本研究结果显示,POU2F1 mRNA和蛋白在胃癌组织和细胞中高表达,双荧光素酶报告基因实验证实POU2F1作为转录因子,通过与miR-433-3p启动子区结合,发挥调控miR-433-3p表达的作用;沉默POU2F1可抑制BGC-823细胞的增殖与迁移能力,促进miR-433-3p表达,下调miR-433-3p表达对BGC-823细胞增殖、迁移的影响。提示沉默POU2F1后,低表达的POU2F1可促进miR-433-3p表达进而发挥抑癌效应。
综上,POU2F1可与miR-433-3p启动子区结合,低表达的POU2F1可促进miR-433-3p表达,使miR-433-3p表达升高,进而抑制胃癌细胞的增殖与迁移。
