不同负荷运动对大鼠骨骼肌氧化应激的影响
2023-03-13侯媛媛闫文升李增明宋磊刚赵玮琳彭子富
侯媛媛 闫文升* 李增明 宋磊刚 赵玮琳 彭子富
(1.河北体育学院运动医学教研室 河北石家庄 050041;2.天津体育学院运动生理与运动医学重点实验室 天津 301617)
运动员的血清睾酮水平是反映其运动能力、肌肉力量、疲劳消除等的重要指标之一,所以血清睾酮已成为运动员身体机能评定中最常用、最成熟的内分泌指标[1]。运动项目、运动时间及运动强度等诸多因素影响血清睾酮的含量[2]。缺乏运动及超负荷的体力劳动均可造成体内活性氧(Reactive oxygen species,ROS)和自由基的生成增加,自由基生成率大于机体的清除能力,机体发生氧化应激,造成细胞内蛋白质、线粒体和细胞器受损,导致细胞结构和功能异常,并且可导致肌肉收缩功能障碍,造成肌肉损伤[3]。而一定时间和强度的运动训练,能使机体抗氧化系统产生适应性变化,提高机体抗氧化酶活性,氧化和抗氧化系统之间保持平衡[4]。
目前,关于不同负荷运动后机体的血睾酮含量、骨骼肌氧化应激水平及抗氧化酶基因表达情况如何,以及相应的骨骼肌形态学变化特点,有待进一步研究明确。该实验以成年雄性SD 大鼠为实验对象,4 周不同强度跑台训练为运动干预方案,观察不同负荷运动对血清睾酮水平、骨骼肌自由基代谢、抗氧化酶活性和基因表达及形态学的影响,以期探索出适宜运动负荷,防止骨骼肌运动损伤,达到最佳运动效果,为科学制定运动处方提供理论依据。
1 材料与方法
1.1 实验动物
32 只成年雄性SD 大鼠购自河北医科大学动物中心。饲养温度控制在(22±2)℃,12h亮黑循环(06:00~18:00 照明),食物和水供给充足。所有大鼠在动物室内适应性饲养1周后正式实验。
1.2 实验方法
1.2.1 动物分组及干预方式
建立不同负荷运动大鼠模型[5],分为安静组、小强度组、中强度组和大强度组,每组8只,共32只,跑台运动4周。小强度组:第1周10min/天(10m/min),第2~4周20min/天(15m/min);中强度组:第1 周30min/天(10m/min),第2~4周60min/天(15m/min);大强度组:第1周60min/天(10m/min),第2~4周120min/天(15m/min)。安静组:进行必要的鼠笼清洁,其他不做任何干预。
1.2.2 测试样品制备
整个运动干预结束后取材,直接断头取血,将血液于室温静置30min,于低温离心机中(3000r/min)离心15min,取血清用于睾酮水平测定。同时,分离右侧比目鱼肌(同一位置),预冷PBS缓冲液冲洗表面血液,锡箔纸包裹、标记后于液氮保存用于实时荧光定量PCR(qPCR)检测。另取新鲜比目鱼肌组织制备成10%的组织匀浆,以3000r/min 的速度,离心15min 取上清,用于骨骼肌抗氧化剂Mn-SOD、GSH-PX及脂质过氧化物MDA水平的检测。取左侧比目鱼肌样本,HE染色样品制备,室温保存。
1.2.3 血清睾酮浓度检测
以放射免疫分析法检测血清睾酮的含量。实验步骤严格按照碘(125I)睾酮放射免疫分析试剂盒说明书。
1.2.4 骨骼肌组织切片及苏木精-伊红染色
完成固定后的标本依次进行脱水-透明-浸蜡-包埋。取样本切片,切片厚度4μm,行苏木精-伊红染色(Hematoxylin-Eosin Staining,HE 染色)。Leica 倒置光学显微镜观察(Leica Co,Germany),选取视野进行观察拍照,观察形态学变化及炎性细胞浸润情况。
1.2.5 骨骼肌Mn-SOD、GSH-PX及MDA水平检测
Mn-SOD测定采用黄嘌呤氧化酶法,GSH-PX测定采用比色法测定,MDA含量测定采用硫代巴比妥酸法。检测严格按照测试盒的操作程序进行测定。
1.2.6 qPCR检测
提取比目鱼肌组织总RNA、逆转录、扩增。反应条件:95℃预变性15min,95℃变性10s,退火/延伸72℃20s,共40 个循环。用2-ΔΔCt法来计算Mn-SOD 和GSHPX mRNA的相对表达量。引物序列如下:Mn-SOD(5′-ACAACTCCCAGAAGCCTAAGAATG-3′and5′-GCTT TTCCCTTGGCAGCTATG-3′),GSH-PX(5′-AATCAG TTCGGACATCAGGAG-3′and5′-GAAGGTAAAGAGCG GGTGAG-3′),以GAPDH为内参基因,GAPDH(5′-GAC TCTTACCCACGGCAAGTT-3′and5′-GGTGATGGGTTT CCCGTTGA-3′)。
1.2.7 统计学分析
采用SPSS 19.0 统计软件进行统计分析,所有参数以平均数±标准差表示,采用单因素方差分析法(Oneway analysis of variance,one-way ANOVA),P<0.05 代表差异显著。
2 结果
2.1 大鼠体重
对实验前各组体重进行分析显示:各组动物的体重无显著差异。对各组动物4周后体重增长量进行分析(见表1):随着运动负荷的逐渐增加,体重增长量呈现逐渐降低的趋势,且组间存在显著性差异(P<0.05),大强度组的体重增长量比安静组降低了31%,小强度组及中强度组的体重增长量与安静组相比无显著性差异。
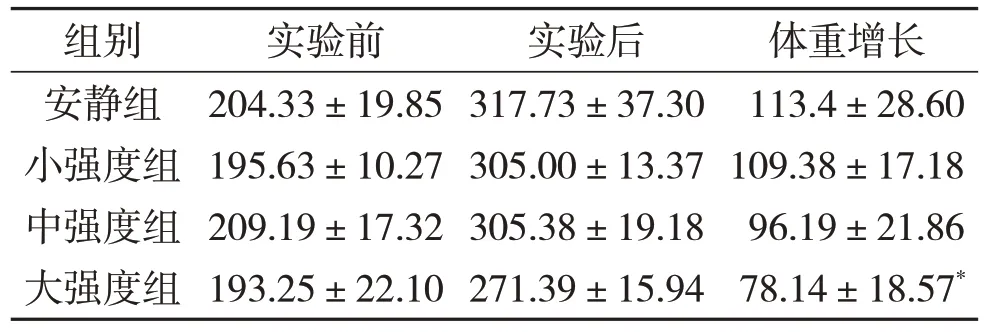
表1 不同运动负荷实验前、后动物体重测量(g)
2.2 大鼠血清睾酮水平
经过4 周训练后,安静组大鼠血清睾酮水平为439.8±36.40ng/dl,小强度组血清睾酮水平为465.6±39.83ng/dl,与安静组相比无显著差异。安静组、中强度组和大强度组各组之间血清睾酮水平存在显著差异,中强度组血清睾酮水平为770.3±43.06ng/dl,显著高于安静组(P<0.01);大强度组血清睾酮水平为140.1±21.69ng/dl,显著低于安静组(P<0.01)(见图1)。
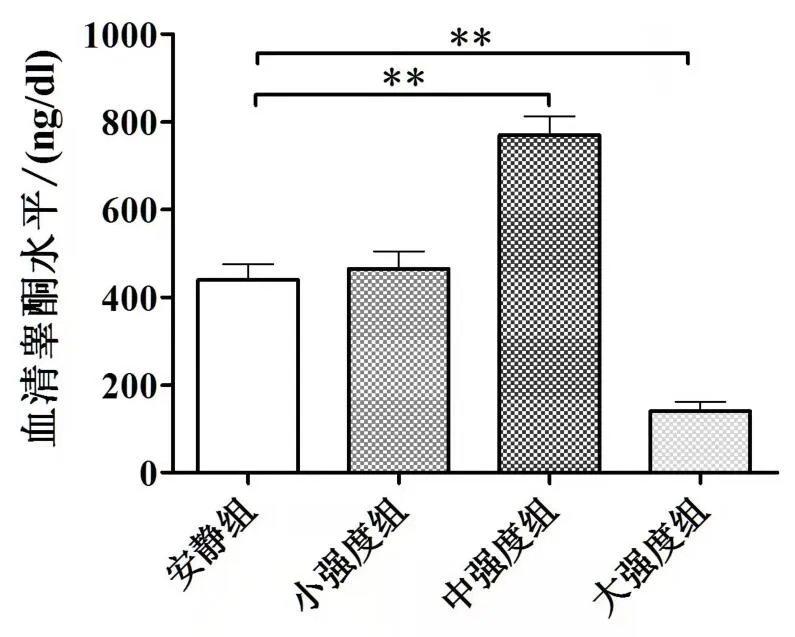
图1 不同运动负荷实验组血清睾酮水平
2.3 大鼠比目鱼肌显微结构观察
光镜下观察安静组(见图2a)及小强度组(见图2b)比目鱼肌肌束排列整齐,无淤血、无炎细胞浸润及水肿;中强度组(见图2c)肌束间隙增宽,肌束增粗;大强度组(见图2d)肌束间血管扩张、淤血,多灶性慢性炎细胞聚集,血管周围慢性炎细胞浸润(见图2)。
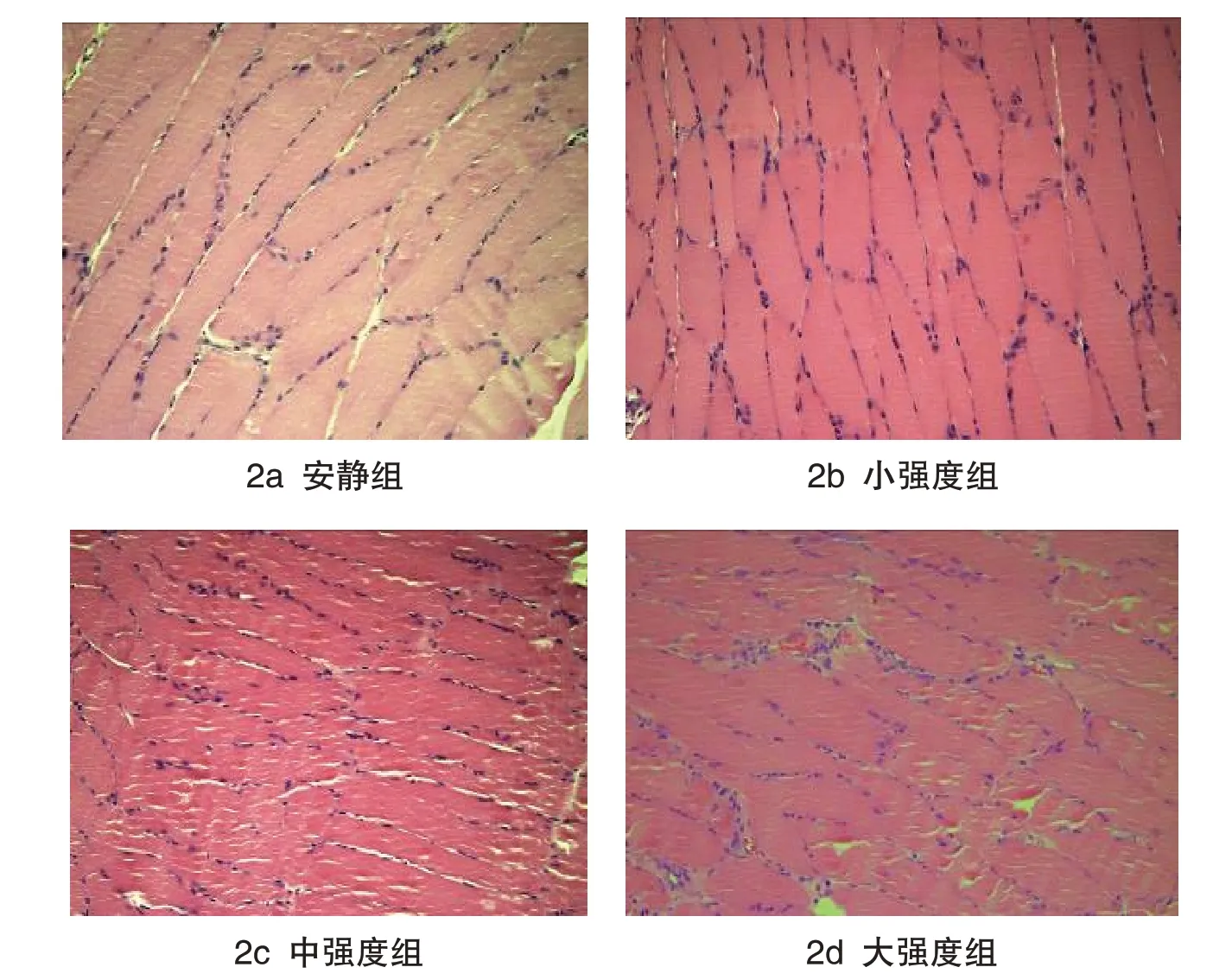
图2 不同运动负荷实验组比目鱼肌形态学变化(HE染色,200×)
2.4 大鼠比目鱼肌氧化应激参数
实验结果显示,小强度组比目鱼肌中的Mn-SOD和GSH-PX 活性、MDA 的量与安静组相比,无显著差异。安静组、中强度组和大强度组各组之间比目鱼肌的Mn-SOD(P<0.01)(见图3)、GSH-PX 活性(P<0.01)(见图4)和MDA的量(P<0.01)(见图5)存在明显差异。中强度组比目鱼肌Mn-SOD 和GSH-PX 活性、MDA 的量与安静组相比,Mn-SOD 和GSH-PX 活性显著升高,MDA 水平降低(P<0.01);大强度组比目鱼肌Mn-SOD和GSH-PX活性、MDA的量与安静组相比,Mn-SOD和GSH-PX 活性显著降低,MDA 的量升高(P<0.01)(见图3、图4、图5)。
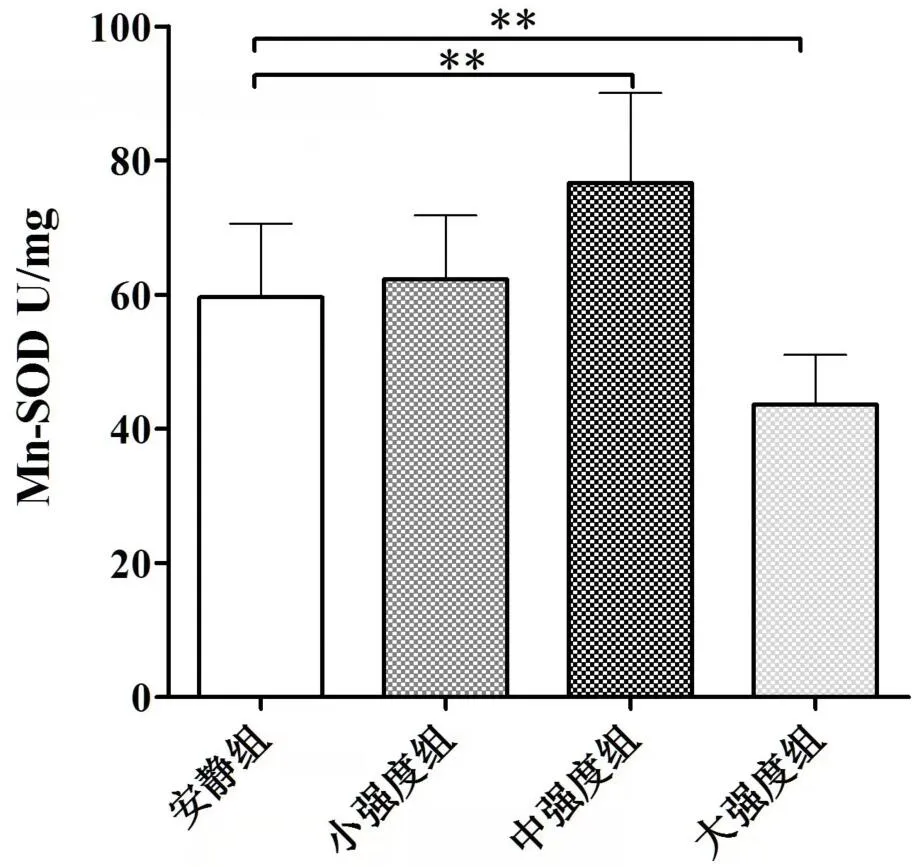
图3 不同运动负荷实验对比目鱼肌Mn-SOD的影响
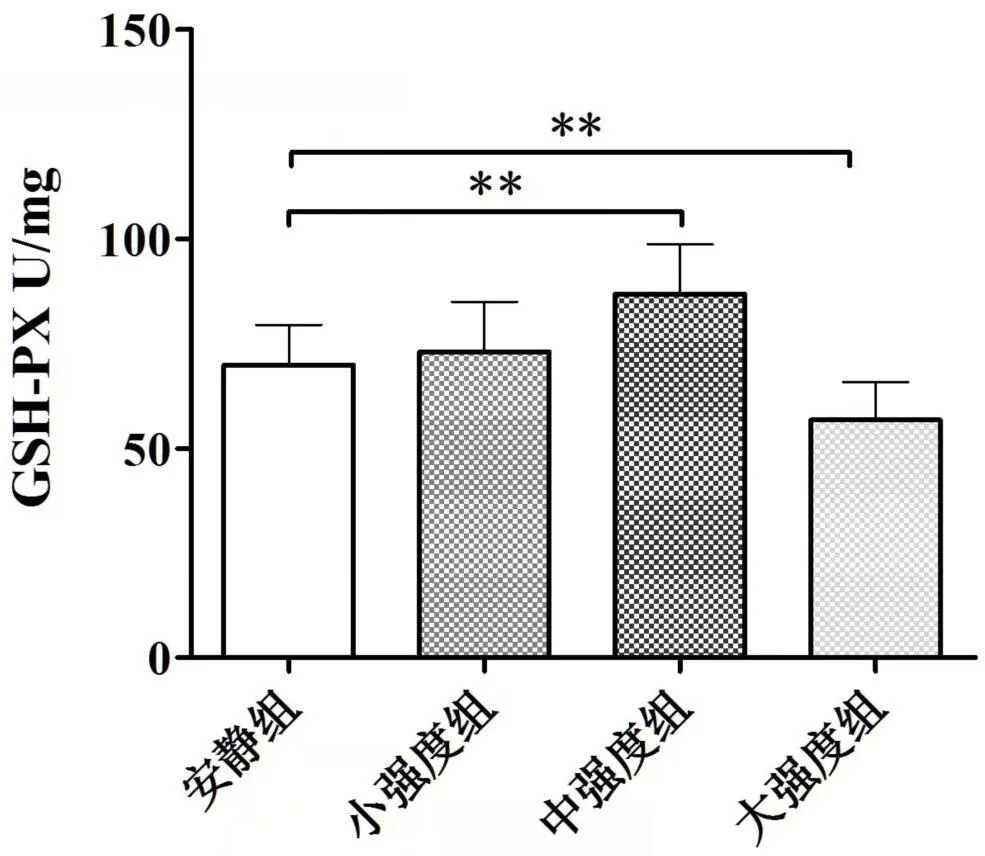
图4 不同运动负荷实验对比目鱼肌GSH-PX的影响
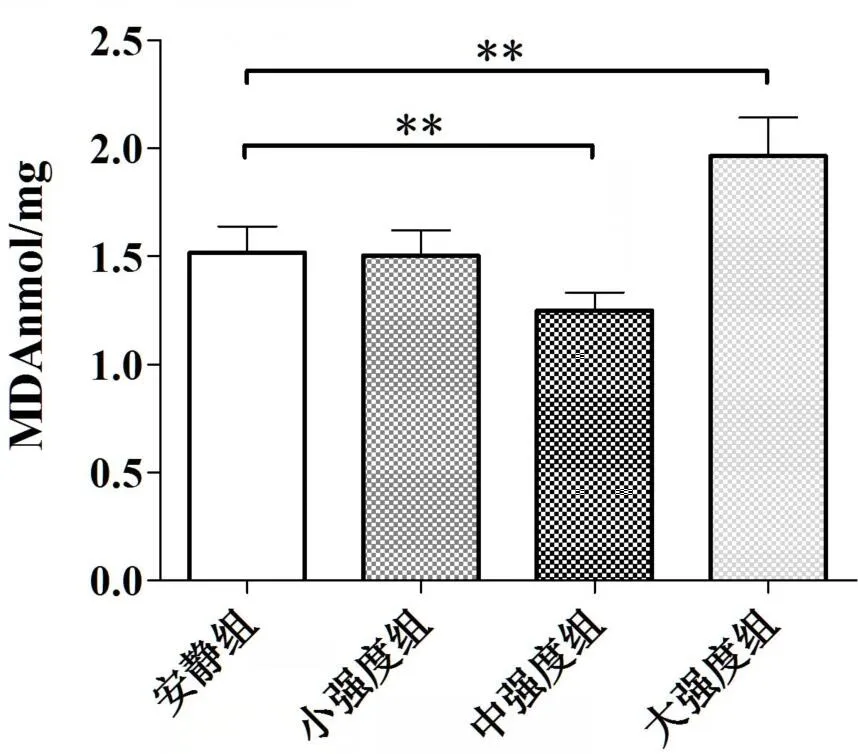
图5 不同运动负荷实验对比目鱼肌MDA的影响
2.5 实时荧光定量PCR检测相关基因表达
实验结果显示,小强度组比目鱼肌中的MnSOD RNA 和GSH-PX RNA 表达与安静组相比,无显著差异。安静组、中强度组和大强度组各组之间比目鱼肌的Mn-SOD RNA(p<0.01)(见图6)、GSH-PX RNA(P<0.01)(见图7)表达存在明显差异,中强度组MnSOD RNA 和GSH-PX RNA 表达均与安静组相比显著增加(P<0.01),大强度组MnSOD RNA和GSH-PX RNA表达与安静组相比均明显下降(P<0.01)。
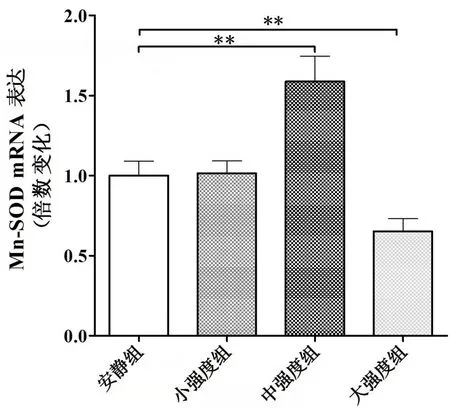
图6 不同运动负荷实验对比目鱼肌Mn-SOD基因表达的影响

图7 不同运动负荷实验对比目鱼肌GSH-PX基因表达的影响
3 讨论
该研究利用组织染色、生物化学及qPCR等方法进行实验,发现随着运动负荷的逐渐增加,大鼠体重增长量呈现逐渐降低的趋势,长时间大强度运动,体重降低明显。长时间中强度运动,血清睾酮含量增加,比目鱼肌肌束间隙增宽,肌束增粗,Mn-SOD、GSH-PX活性和基因表达显著升高,MDA含量显著下降;长时间大强度运动可显著降低血清睾酮含量,比目鱼肌肌束间血管扩张淤血,多灶性慢性炎细胞聚集,血管周围慢性炎细胞浸润,Mn-SOD、GSH-PX活性和基因表达显著降低,MDA 含量显著升高;安静组和小强度组比目鱼肌血清睾酮、组织形态、氧化应激参数、Mn-SOD和GSH-PX基因表达未见明显改变。这些研究结果表明不同负荷运动可以影响骨骼肌的氧化应激水平,影响骨骼肌的形态学特点。
氧化应激是指体内氧化与抗氧化作用失衡,抗氧化的代表酶,超氧化物歧化酶(Superoxide dismutases,SODs)用于专一清除超氧阴离子自由基(O2-),是体内对抗自由基的第一道防线,其中锰超氧化物歧化酶(Manganese superoxide dismutase,MnSOD)被认为是哺乳动物最重要的SOD[6,7]。谷胱甘肽过氧化物酶(Glutathione peroxidase,GSH-PX)可以代谢细胞内的活性氧自由基(reactive oxygen species,ROS),进而抑制ROS 毒害作用,维持细胞的稳态。丙二醛(Malondialdehyde,MDA)是氧化产物的代表性产物,其含量的高低间接反映自由基损害所造成的脂质过氧化的程度,是反映自由基介导细胞损伤的指标[8]。该研究的中强度运动提高了Mn-SOD 和GSH-PX 活性、mRNA 表达,促进MDA的清除,说明运动增强了大鼠骨骼肌的抗氧化能力,避免了自由基对骨骼肌的损伤。
长期大强度运动导致骨骼肌中Mn-SOD 和GSHPX活性、mRNA表达降低,MDA水平升高,提示长时间大强度运动大鼠的抗氧化能力降低,氧化损伤增加。长时间大强度运动,为了能够提供足够的能量,体内代谢增加,体重减轻,线粒体耗氧量在增加,呼吸水平提高,产生更多的氧自由基,可能由于机体疲劳不能产生正常的生理应激反应,抗氧化酶活性反而下降,不能有效消除运动引起的高ROS 和自由基水平,引起组织结构功能紊乱,造成骨骼肌和脑等器官损伤[9,10]。
金雯等人[11]研究发现,每天0.5h、1h、2h 游泳训练均可以引起衰老大鼠股四头肌SOD、GSH-Px活性的升高,以1h运动组效果最优,并且有效地减少MDA含量。潘玮敏等人[12]研究发现,经过4周游泳训练,小负荷训练组大鼠腓肠肌细胞膜MDA 含量降低,SOD 活性升高,大负荷训练组MDA 含量和SOD 活性无显著性差异。雷晓妮等人[13]研究老年小鼠10周游泳运动后,无负荷老年运动组小鼠腓肠肌MDA 含量明显下降,SOD活性显著升高,GSH-PX 活性极显著增高;负荷老年运动组小鼠腓肠肌GSH-PX 活性显著升高,MDA 含量和SOD 活性无显著性变化,负荷运动和无负荷运动交替组小鼠GSH-PX 和SOD 活性极显著升高,MDA 含量明显下降。朱天宇[14]研究发现,经过4周跑台运动,低强度组和中强度组大鼠腓肠肌SOD 水平明显升高,MDA水平明显降低,而高强度组SOD 水平明显降低,MDA水平明显升高。
运动后提高机体抗氧化的能力不同,可能与实验对象和实验器官的选择、运动方式、运动强度和运动时间等因素有关,研究中同为设定的低、中、高负荷的标准也各不相同,提示对不同对象开具的运动处方应采取个体化原则,以免造成机体的损伤。
睾酮是体内主要的雄激素,男性大部分由睾丸间质细胞产生,小部分由肾上腺皮质网状带产生。运动可以调节血清睾酮的变化[15,16],运动性血睾酮变化一直是运动员身体机能检测的常用指标之一。该研究发现,安静组和小强度组大鼠血清睾酮水平无显著差异,中强度组血清睾酮水平显著升高,大强度组血清睾酮水平降低明显。雄激素在骨骼肌蛋白质代谢和肌肉质量控制中发挥了重要作用,雄激素通过IGF-1/Akt、ERK/mTOR 和GPCR 等信号途径促进骨骼肌蛋白质合成,促进肌肉生长质量增加,运动加强了雄激素的促肌肉合成效应[17,18];而雄激素匮乏时可通过自噬、泛素蛋白酶体系统等途径促进蛋白质分解,导致肌肉质量的流失。
基于老年雄性存在睾酮水平降低[19,20],老年雄性大鼠给予睾酮补充能够改善运动行为和运动技能及增加中枢神经脑的抗氧化能力和降低氧化损伤。去势大鼠皮下给予丙酸睾酮后能够恢复黑质和海马脑区线粒体的氧化应激指标[21],表明雄激素不足引起的相关氧化应激与体内雄激素水平的减少有关。运动的影响是广泛的,运动对骨骼肌氧化应激的调节或许与睾酮有协同效应,还是通过复杂的信号机制来实现调节Mn-SOD、GSH-PX表达,还需进一步研究。
