巨噬细胞AMPKα1敲除对非酒精性脂肪肝小鼠模型的影响
2023-03-13王顺意陈思烁于天力林彩霞王丽京郑凌云
王顺意陈思烁于天力林彩霞王丽京郑凌云
(广东药科大学,生命科学与生物制药学院,广州 510006)
非酒精性脂肪肝(non-alcoholic fatty liver disease, NAFLD)已经成为威胁全球人类健康的主要疾病之一,其全球患病率约为25%[1]。NAFLD是指非饮酒条件下,患者超过5%的肝细胞中存在脂肪变性[2-3]。作为一种进行性疾病,NAFLD可从非酒精性肝脂肪变性(NAFL)演变为非酒精性肝炎(NASH),进一步发展为肝纤维化,最终导致肝硬化或肝癌[4-5]。在NAFLD患者肝中,M1型巨噬细胞为炎症因子的主要来源,激活将促进炎症的发展[6-7]。AMP依赖的蛋白激酶(AMPK)是一种丝氨酸/苏氨酸激酶,由α(α1/2)催化亚基,β(β1/2)和γ(γ1/2/3)两个调节亚基组成,是细胞内调节能量平衡和对代谢应激反应的能量传感器[8]。AMPK参与巨噬细胞线粒体脂质代谢进而调控其炎症反应[9-10],AMPK缺失将促进巨噬细胞M1型极化[11]。但巨噬细胞特异性敲除AMPKα1对NAFLD的作用尚未见报道。本研究利用巨噬细胞AMPKα1敲除小鼠构建NAFLD模型,检测血糖及血清TG变化,观察肝病理改变及脂滴堆积程度,并利用GC/MS技术[12]探究血清脂质组学改变。
1 材料和方法
1.1 实验动物
AMPKα1flox/flox(AMPKfl/fl)小鼠及lyz2-cre小鼠为SPF级的C57BL/6J背景小鼠,雄性,各10只,4周龄,体重14~15 g,购自美国Jackson lab,购买动物卫生证书编号为[2011A00085]。于广东省实验动物监测所进行胚胎净化,生产许可证号为[SCXK(粤)2018-0044]。饲养于广东药科大学实验动物中心无特殊病原体SPF级环境,饲养许可证号为[SYXK(粤)2017-0125],环境温度为22~26℃,环境湿度为50%~70%,压差25 Pa,洁净度10 000级,氨浓度15 mg/m3,照明度150~300 Lux,定时循环照明,8:00~20:00为光照时间,夜间20:00至次日8:00为无照明时间。动物饲养设施配备了独立通风系统(IVC),换气次数为每小时10次。小鼠日常维持饲料采购于广东省医学实验动物中心。本研究所有动物实验均通过广东药科大学动物伦理委员会审查批准许可(gdpulacspf2021006),实验动物饲养及实验过程均按照实验动物使用的3R原则给予人道关怀。
1.2 主要试剂与仪器
GAPDH抗体(CST,2118S);AMPKα抗体(CST,2795S);Oil red(Sigma,O0625);苏木精&伊红染液(南昌雨露实验器材有限公司);油红O染色液(Sigma,O0625);97% BSTFA+1% TMCS(上海阿拉丁生化科技股份有限公司,B118473);吡啶(上海阿拉丁生化科技股份有限公司,P111512);甲氧胺(百灵威科技有限公司,533032);色谱级甲醇(Sigma,34860);十九烷酸(Sigma,N5252);高脂高糖高胆固醇(HFFC)饲料(D09100310)购自北京博奥派克生物科技有限公司。ImageQuant LAS4000化学发光成像仪(General Electric,0682345);普通光学显微镜(Olympus,BX43);气相色谱与质谱联用仪(Agilent GC/MS,7890B)。
1.3 实验方法
1.3.1 AMPK△Mφ小鼠的基因型鉴定
以cre-loxp技术,将AMPKfl/fl小鼠及lyz2-cre小鼠杂交获得子代,提取组织DNA以PCR的方法鉴定小鼠基因型;提取小鼠骨髓来源原代巨噬细胞(BMDM)蛋白以Western blot的方法检测AMPKα表达情况鉴定敲除结果,获得巨噬细胞AMPKα1特异性敲除的AMPK△Mφ小鼠。
1.3.2 NAFLD模型
随机选取4周龄健康的AMPKfl/fl和AMPK△Mφ小鼠给予HFFC饮食12周,分组为AMPKfl/fl对照组、AMPK△Mφ对 照 组、AMPKfl/flHFFC组和AMPK△MφHFFC组。
1.3.3 口服葡萄糖耐量实验(OGTT)
小鼠空腹12 h后测定0 min时血糖浓度,将100 μg/mL的葡萄糖溶液以20 μL/g剂量灌胃,测定15、30、60、120 min的血糖浓度。
1.3.4 HE染色
肝组织脱水并石蜡包埋后制作石蜡切片,于65℃烘箱30 min,二甲苯脱蜡,梯度乙醇复水,苏木素染色1 min 30 s,流水返蓝30 min,伊红染色10 s。
1.3.5 油红O染色
肝组织蔗糖脱水后制作冰冻切片,于60%异丙醇水溶液润洗5 min,置于油红工作液中避光染色30 min,于60%异丙醇水溶液中分化,苏木素染色1 min,流水返蓝30 min。
1.3.6 GC-MS非靶向代谢组学
(1)样品制备:将小鼠麻醉后以毛细采血管对小鼠眼眶静脉采血,室温静置5 min,4℃ 5000 r/min离心15 min,取上层血清置于-80℃待用。取小鼠血清50 μL,加入10 μL的1 mg/mL的十九烷酸甲醇溶液,加入250 μL萃取溶液(水v:甲醇v:氯仿v=2∶5∶2),混匀后4℃静置20 min,13 300 r/min离心15 min,取200 μL上清于新的1.5mL EP管中,真空干燥,加入80 μL甲氧胺吡啶(15mg/mL),37℃ 孵育90 min,加入80 μL的含1% TMCS的BSTFA溶液,70℃孵育60 min,样品转移至微量反应瓶中,上机。
(2)气相色谱-质谱条件:色谱条件:Agilent HP-5MS石英毛细管柱,进样体积为1 μL,模式为不分流进样,载气为He(1 mL/min),进样口260℃,传输线240℃,程序为:初始60℃(1 min),8℃/min至100℃(保持5 min),15℃/min至170℃(保持5 min),10℃/min至210℃(保持5 min),15℃/min升温至350℃(保持5 min),运行条件为350℃,7 min。质谱条件:离子源(230℃),四级杆(150℃),离子化方式为EI,电子轰击能量为70 eV,离子扫描模式为全扫描模式,溶剂延迟为12 min。
1.4 统计学方法
本研究中病理图像数据用Image pro plus 6.0图像分析软件进行统计,实验数据主要用Graphpad prism 9.0进行分析及可视化。GC-MS结果均用Agilent Masshunter Qualitative Analysis B.07.00定性软件和NIST 14.L数据库对混标进行定性分析得到化合物信息,用Agilent Masshunter定量分析B.07.01根据混标化合物表对化合物定量分析,结果用Simca Version 14.1.0.2047进行PCA分析获得VIP>1及P<0.05的化合物,KEGG在线数据库比对获得KEGG ID,在Metaboanalyst 5.0在线进行富集分析及通路分析。P<0.05为具有统计学差异。
2 结果
2.1 AMPK△Mφ小鼠基因型鉴定
对小鼠脚趾组织抽提DNA后,以PCR的方法鉴定AMPK△Mφ小鼠基因型,PCR产物进行琼脂糖凝胶电泳,根据电泳结果PCR扩增产物长度判断基因型。
如图1A所示,对比DL1000 DNA Marker条带,Lyz2-cre条带为700 bp,野生型条带为350 bp。AMPKα1flox/flox条带为450 bp,野生型条带为334 bp。如图1B所示,与AMPKfl/fl对照组小鼠相比,AMPK△Mφ小鼠敲除巨噬细胞AMPKα1后,巨噬细胞AMPKα不表达,说明巨噬细胞特异性敲除AMPKα1的AMPK△Mφ小鼠构建成功。
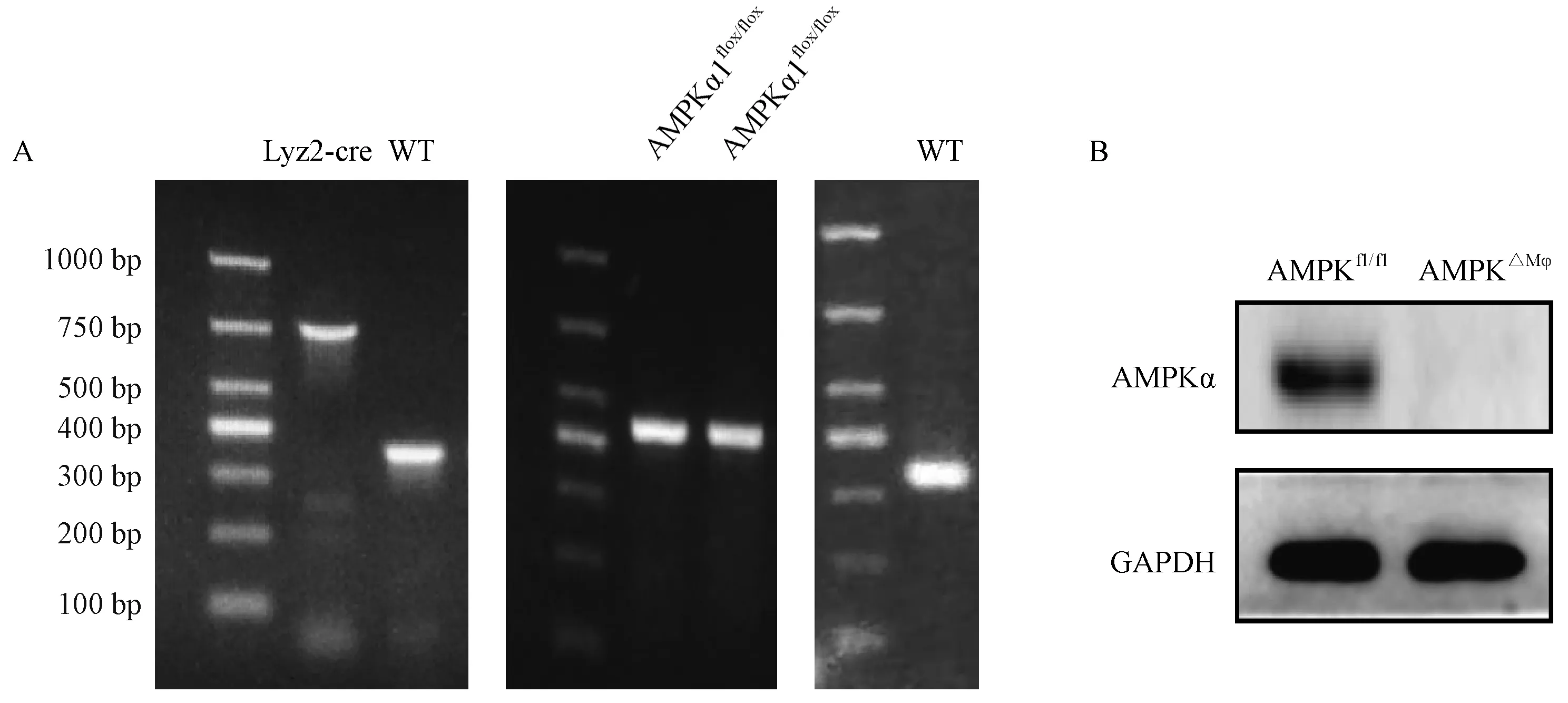
图1 小鼠基因型鉴定结果Figure 1 The results of mouse genotype identification
2.2 小鼠口服葡萄糖耐量(OGTT)检测
给予AMPKfl/fl小鼠及AMPK△Mφ小鼠高脂高胆固醇高糖饮食(HFFC)12周后进行口服葡萄糖耐量检测。如图2所示,饥饿12 h后AMPKfl/fl小鼠组空腹血糖(9.33±0.97)mmol/L,AMPK△Mφ组小鼠组(7.46±1.34)mmol/L,两者无统计学差异(P>0.05)。两种小鼠血糖在灌胃葡萄糖溶液后迅速升高,15 min时达到峰值,随后逐渐下降,在120 min时基本恢复空腹时血糖水平,两组小鼠血糖变化规律基本一致。15 min时AMPKfl/fl组小鼠血糖(17.5±3.5)mmol/L,AMPK△Mφ组小鼠血糖(22.5±1.9)mmol/L,两者有显著差异(P<0.05),提示巨噬细胞特异性敲除AMPKα1在NAFLD诱导后出现糖耐量异常。

图2 巨噬细胞AMPK敲除对HFFC饮食小鼠口服葡萄糖耐量的影响(n=5)Figure 2 Effects of AMPK knockout in macrophages on oral glucose tolerance(OGTT)in HFFC-fed mice
2.3 血清甘油三酯(TG)检测
为探究巨噬细胞特异性敲除AMPK对HFFC饮食下小鼠体内脂质代谢的变化,我们检测小鼠血清甘油三酯(TG)水平,如图3所示,与对照组AMPKfl/fl组小鼠相比,AMPK△Mφ组小鼠血清甘油三酯水平显著提高(P<0.05)。
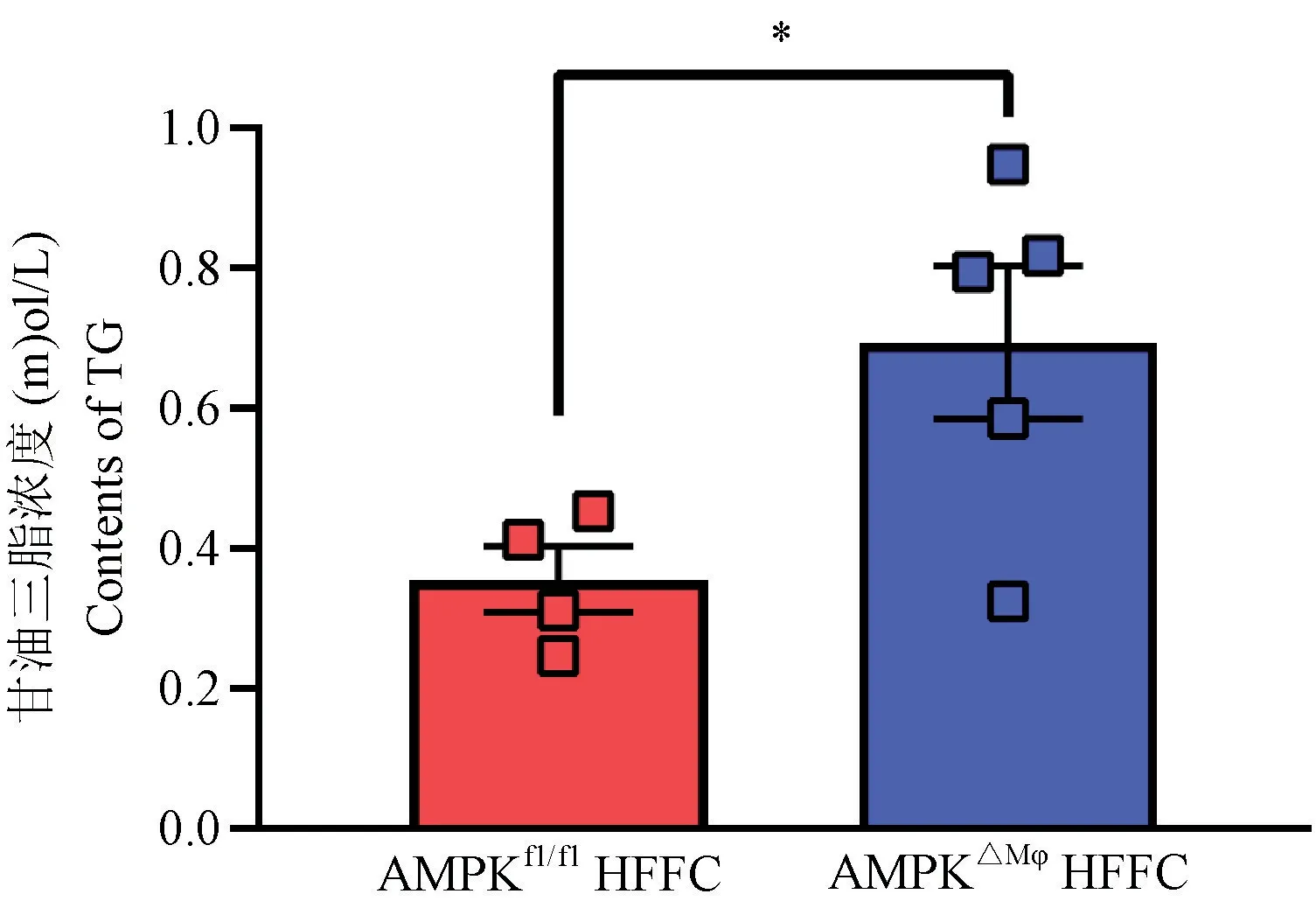
图3 巨噬细胞AMPK敲除对HFFC饮食小鼠血清甘油三酯水平(n=4)Figure 3 Serum triglyceride levels in macrophage AMPK knockout HFFC diet mice
2.4 HFFC饮食小鼠肝组织病理学观察
如图4所示,小鼠肝HE染色可以发现,AMPKfl/fl组小鼠肝出现轻微的小空泡样变性,但肝基本结构正常,小叶结构完整。AMPK△Mφ组小鼠肝基本结构不清晰,肝小叶结构紊乱,肝出现严重的弥漫性空泡样变性,空泡增大,部分肝索结构消失,肝细胞细胞核偏移至细胞边缘,肝细胞大小不均一,部分肝细胞体积膨大,核膜边界不清晰。油红染色结果显示,AMPKfl/fl组小鼠肝细胞中堆积的红色脂滴数量少、体积小,与对照组AMPKfl/fl组小鼠相比,AMPK△Mφ组小鼠肝细胞内红色脂滴数量明显增多(P<0.01),体积变大,颜色较为鲜艳,说明AMPK△Mφ组小鼠肝细胞脂质沉积多于AMPKfl/fl组小鼠。

图4 巨噬细胞敲除AMPK小鼠肝病理结果(n=3)Figure 4 Pathological results of liver in macrophage knockout AMPK mice
2.5 NAFLD小鼠血清代谢组学分析
基于GC-MS对样品进行分析,将混标原始数据导入Agilent Masshunter Qualitative Analysis B.07.00定性软件,获得249个峰信号化合物,如图5总TIC结果,各峰在保留时间上可见有良好的重现性,各组代谢轮廓存在一定差异。
图5 小鼠血清GC-MS总离子流图(TICs)(n=5)Figure 5 Mouse serum GC-MS total ion current map (TICs)
如图6A所示,各组小鼠血清代谢物在PCA图上能较好的分离,并且组内可以很好的聚合起来,R2X[2]=0.302。如图6B所示,对PCA模型进行Hotelling’sT2检验所有样本检验值均明显低于T2(95%),PCA模型拟合度较高。基于PCA模型建立有监督的PLS-DA模型及HFFC组两组间OPLS-DA模型对249个差异化合物进行分析。如图6C所示,PLS-DA各组之间可以很好的分离开来,R2X[2]=0.305。将PLS-DA结果进行200次的置换检验,图6D可见,Q2与Y轴交点低于0,PLS-DA模型具有较好的拟合度,模型可靠性及预测性强。将PLSDA模型的AMHF组(AMPKfl/fl+ HFFC组)及ALHF组(AMPK△Mφ+ HFFC组)进行OPLS-DA分析结果显示(图6E),R2X0[1]=0.235,两组可以很好的分离,组内聚合度较高,OPLS-DA模型进行200次置换检验结果显示(图6F),Q2与Y轴交点明显低于0,说明模型可靠。

图6 小鼠肝组织代谢轮廓分析Figure 6 Metabolic profile analysis of mouse liver tissue
如表1所示,以OPLS-DA模型进行VIP预测差异化合物,得到VIP>1共15个化合物。其中P<0.05的差异化合物中,(R)-3-羟基丁酸、对辛弗林、乙烯发生上调(FC>0),丙酸、N,N-二乙基甘氨酸、D-乳酸、羟基乙酸、十三烷、9-十六碳烯酸发生下调(FC<0)。
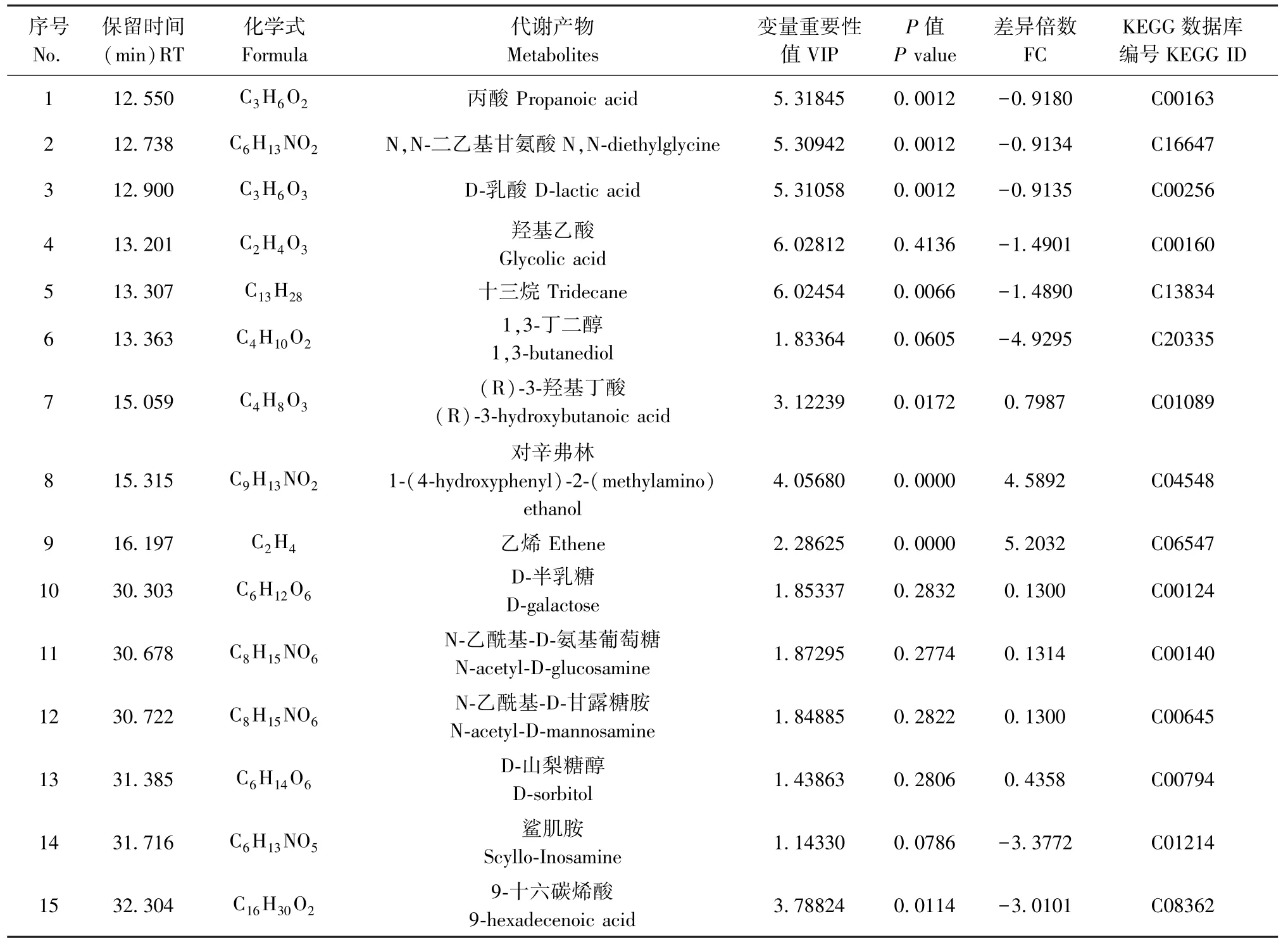
表1 HFFC饮食下AMPKfl/fl组及AMPK△Mφ组小鼠血清差异代谢物Table 1 Differential metabolites in serum of mice in AMPKfl/flgroup and AMPK△Mφgroup under HFFC diet
进一步对筛选化合物进行富集分析(图7A)这些差异化合物的相关代谢通路主要包括半乳糖代谢、氨基糖和核苷酸糖代谢、酮体的合成和降解、丁酸代谢、果糖和甘露糖代谢、丙酮酸代谢及丙酸代谢。对差异化合物进行基因-化合物网络分析,如图7B所示,包括ACSL1、GUSB、ABHD6、DECR1、SLC16A1、GCG、CAT、LDHD。在genecards在线综合数据库及NCBI gene数据库查询可以发现,ACSL1编码长链脂肪酸辅酶A连接酶的同工酶,在脂质生物合成及脂肪酸代谢中发挥关键作用,相关途径包括脂肪酸β-氧化和PPARα调节脂质代谢。GUSB编码葡萄糖醛酸酶β,在葡糖苷酸分解代谢中起作用。ABHD6启用酰基甘油脂肪酶活性,参与酰基甘油分解代谢过程。DECR1编码蛋白参与不饱和脂肪烯醇辅酶A酯的β-氧化。SLC16A1编码一种单羧酸盐转运蛋白,相关代谢途径包括丙酮酸代谢及TCA循环反应,在高脂饮食中影响营养吸收、白色脂肪及体重增加,同时也对血糖稳态产生影响。GCG编码胰高血糖素的前体蛋白,胰高血糖素在葡萄糖代谢中起重要作用,通过增加糖异生和减少糖酵解来调节血糖。CAT编码过氧化氢酶,是机体抵御氧化应激的关键抗氧化酶,保护细胞免受过氧化氢的毒性作用,其相关代谢途径包括嘌呤代谢及DNA损伤反应。LDHD编码乳酸脱氢酶D,相关代谢途径为乳酸分解代谢,位于线粒体中。
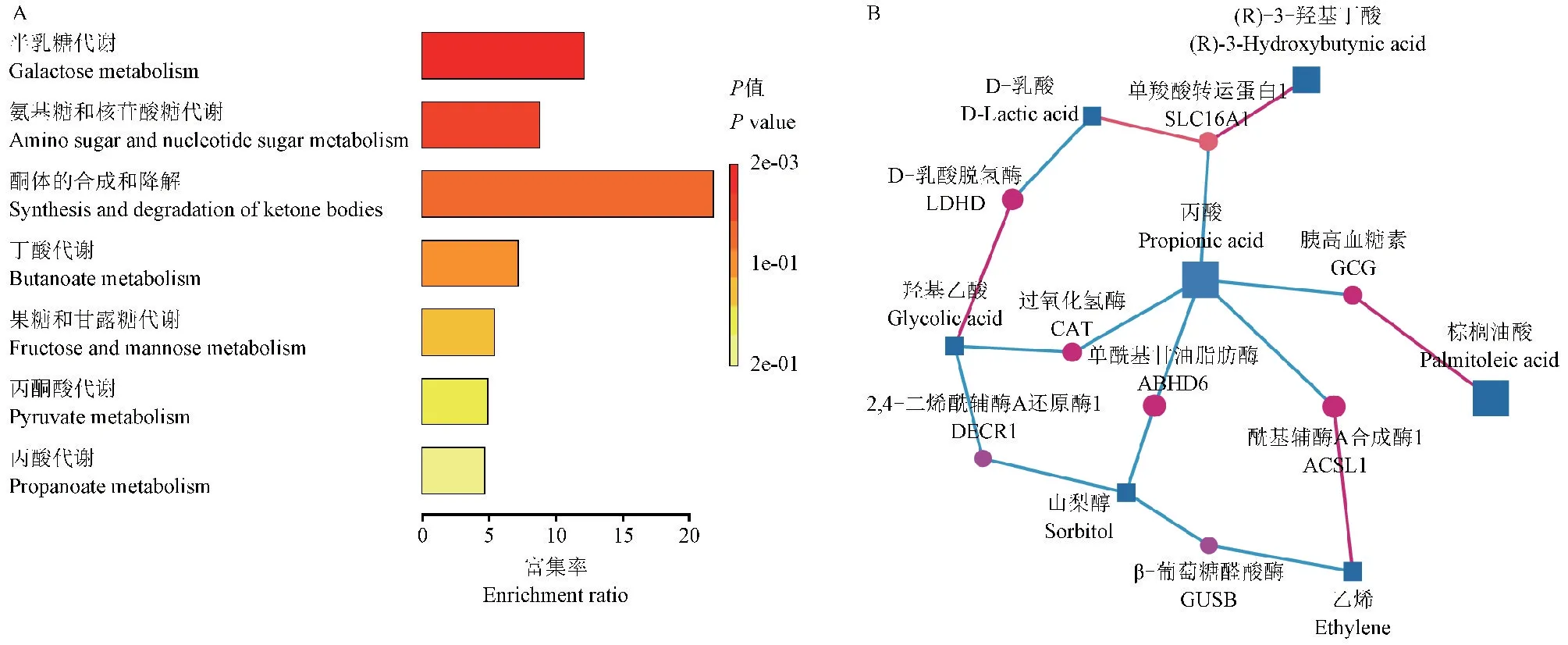
图7 差异代谢物通路富集分析及基因-化合物通路分析Figure 7 Differential metabolite pathway enrichment analysis and gene-compound pathway analysis
3 讨论
HFFC饮食诱导的NAFLD模型中,巨噬细胞AMPKα1敲除促进肝脂质沉积。OGTT结果显示巨噬细胞AMPKα1敲除小鼠糖耐量受损,且血清甘油三酯(TG)水平上调,提示巨噬细胞AMPKα1敲除可加重NAFLD引起的小鼠糖脂代谢异常,推测可能由于肝细胞损伤加重,AMPKα1敲除的巨噬细胞向M1极化而产生促炎细胞因子,持续炎症刺激导致肝细胞胰岛素抵抗。组织学检测结果进一步证实,巨噬细胞AMPKα1敲除促使肝细胞中脂滴增多,肝脂肪变性加重,考虑到肝脂肪变性可引起全身糖脂代谢异常,在小鼠模型的血清非靶向脂质组学研究中,对筛选出的15个化合物进行富集分析,可以发现与AMPKfl/fl小鼠相比,巨噬细胞AMPKα1敲除小鼠血清中丙酸及乳酸下调。有报道指出,在饮食中添加丙酸可以降低肝和血中的脂肪酸含量[13],据此推测NAFLD模型中巨噬细胞AMPK敲除小鼠血清丙酸及乳酸下调可能与肝脂肪变性加重有关。但血清中丙酸含量与炎症之间的具体机制未见报道,我们还尚不明确。
综上所述,我们初步证实,巨噬细胞AMPKα1敲除导致NAFLD小鼠模型口服糖耐量受损,血清甘油三酯上调,肝脂肪变性,以及血清中丙酸与乳酸水平下调,血清代谢物的差异变化与基因ACSL1、GUSB、ABHD6、DECR1、SLC16A1、GCG、CAT、LDHD有关,具体机制有待进一步探究。
