环境雌激素壬基酚通过SRXN1促进结直肠癌细胞增殖、侵袭和迁移的作用研究
2023-03-13黎凯恺张远威张念杰尹硕何念万磊陈旭杨雪峰
黎凯恺张远威张念杰尹 硕何 念万 磊陈 旭杨雪峰
(遵义医科大学第二附属医院,贵州 遵义 563006)
结直肠癌(colorectal cancer, CRC)是世界范围内最常见的恶性肿瘤之一,也是导致癌症死亡的重要原因,结直肠癌确诊时已经处于中晚期,转移及复发是导致其死亡的重要原因[1-3]。深入研究结直肠癌的发生及进展的分子机制,筛选结直肠癌早期诊断的候选靶点,是结直肠癌防治的关键。课题组前期研究发现,血清壬基酚(nonylphenol, NP)浓度在结直肠癌组显著高于正常组[4];体内、体外研究均发现NP可激活ERK通路,促进结直肠癌细胞增殖[5-7]。NP是环境内分泌干扰物(endocrine disrupting compounds, EDCs)典型代表,主要是由烷基酚聚氧乙醚(alkylphenol ethoxylates,APE)分解产生,APE广泛应用于塑料制品、纺织品、农药以及洗涤剂、油漆等家庭用品,生活中随处可见。由于NP具有亲脂性,导致其极易在组织和器官中聚集,造成内分泌紊乱、免疫异常、生殖功能障碍和肿瘤的发生[8-9]。上皮-间质转化(epithelial-mesenchymal transition, EMT)是肿瘤侵袭和迁移的重要原因[10]。NP促进vimentin及抑制E-cadherin的表达而促进卵巢癌的侵袭及迁移[11]。NP是否影响结直肠癌的侵袭及迁移,目前还未见报道。课题组通过转录组测序分析发现,SRXN1(sulfiredoxin-1)在NP干预后的人结直肠癌细胞COLO205中被显著上调。SRXN1属于保守的内源性sulfiredoxin抗氧化家族的成员之一,具有调节氧化应激反应、发挥神经保护作用[12]。最近研究发现,SRXN1的异常表达可促进卵巢癌及肝癌细胞的增殖、侵袭和迁移[13-14]。本文通过临床及细胞水平,观察NP与结直肠癌增殖、侵袭及迁移的关系及与SRXN1相关性,初步阐明NP通过SRXN1促进结直肠癌增殖、侵袭和迁移作用。
1 材料和方法
1.1 实验材料
1.1.1 细胞
结直肠癌COLO205细胞购自中国科学院典型培养物保藏委员会细胞库,由本实验室保存。
1.1.2 结直肠癌临床样本
30对结直肠癌患者肿瘤及配对的癌旁组织均为2020年1月~2020年12月在我院胃肠外科住院,经肠镜病理检查明确诊断为结直肠癌患者。患者年龄54~77岁,平均年龄60.00岁,其中男、女各15例。肿瘤及其配对的癌旁样本,取材后,等分成两份,一份置于4%多聚甲醛固定,经梯度乙醇脱水后,石蜡包埋;一份置于液氮保存。每位患者均签署知情同意书,协议由遵义医科大学第二附属医院伦理委员会审查批准(遵医伦审[2019]H-008号)。
1.2 主要试剂与仪器
壬基酚购自中国Aladdin公司(货号:84852-15-3);CCK-8(货号:CA1210)及免疫组化(货号:SP0041)检测试剂盒购自于北京索莱宝科技有限公司;qRT-PCR检测试剂盒购自于美国Thermofisher公司(货号:4472903);Anti-ERK1+ERK2 antibody(货号:ab109282)、Anti-ERK1+ERK2 (phospho T202 + Y204) antibody(货 号:ab201015)、Anti-PI 3 Kinase p85αantibody(货号:ab191606)、Anti-PI 3 Kinase p85α (phospho Y607) antibody(货 号:ab182651)购自于英国 abcam 公司;Anti-Akt antibody(货号:60203-2-Ig)、Anti-SRXN1 antibody(货号:14273-1-AP)、Anti-Phospho-AKT (Ser473) antibody(货号:80455-1-RR)、Anti-Wnt3a antibody(货号:26744-1-AP)、Anti-β-catenin antibody(货号:51067-2-AP)及Anti-GAPDH antibody(货号:60004-1-Ig)购自于武汉三鹰生物技术有限公司。si-SRXN1(si-SRXN1-1: 5’-GCCGGCUCCAAAUUCCC AATT-3’;si-SRXN1-2:5’-GGACUACAUUCAGCUG CAATT-3’)及 si-NC(negative control)(5’-TAATTGAUUGGGTTAAAGGCC-3’)购自上海吉玛制药技术有限公司。qRT-PCR引物SRXN1(Forward:5’-CAGGGAGGTGACTACTTCTACTC-3’;Reverse:5’-CAGGTACACCCTTAGGTCTGA-3’)及GAPDH引物(Forward:5’-GGAGCGAGATCCC TCCAAAAT-3’;Reverse:5’-GGCTGTTGTCATAC TTCTCATGG-3’)由生工生物工程(上海)股份有限公司合成。
HERAcell 150i1型CO2培养箱购自于美国Thermo公司;Lightcycler480型qRT-PCR仪购自于美国Roche公司;NIKON DS-U3正置荧光显微镜购自于日本尼康;Multiskan Sky全波长酶标仪购自于美国Thermo公司;FACS Calibur 流式细胞仪购自于美国BD公司;PowerPace Basic型电泳仪购自美国Bio-rad公司。
1.3 实验方法
1.3.1 细胞培养
COLO205细胞复苏后,分别置于RPMI-1640+10%胎牛血清的培养基中,37℃、5% CO2培养箱中培养,待细胞联合度达到80%~90%时,按照1∶2~1∶3的比例传代,备用。
1.3.2 RNA-seq分析
将COLO205细胞随机分成空白对照组(Control)、壬基酚(10-6mol/L)组(NP),处理24 h(NP浓度及作用时间参考[5-7])。收集细胞,样品经过RNA抽提、纯化、建库之后,采用第二代测序技术(next-generation sequencing,NGS),基于Illumina测序平台,对这些文库进行双末端(Paired-end,PE)测序;筛选差异表达基因(筛选标准:|log2FoldChange|>1,P<0.05)。测序及初步分析委托上海派森诺生物科技股份有限公司协助完成。
1.3.3 TCGA分析肠癌中SRXN1表达
UALCAN(http://ualcan.path.uab.edu/index.html)是基于癌症基因组图谱(the cancer genome atlas, TCGA)数据库构建的在线分析平台。通过UALCAN数据库分析SRXN1在肠癌中的表达情况,其中包括肿瘤样本241个,正常样本41个。
1.3.4 qRT-PCR检测SRXN1表达
将COLO205细胞随机分成空白对照组(Control)、壬基酚(10-7mol/L、10-6mol/L、10-5mol/L)组(NP),干预24 h后,收集细胞,提取RNA,逆转录成cDNA,qRT-PCR检测SRXN1的表达。同时提取结直肠癌患者肿瘤及其配对的癌旁组织RNA,逆转录成cDNA后,qRT-PCR检测SRXN1的表达变化。数据以2-△△CT表示;△CT=目的基因Ct值-内参基因Ct值,△△CT=实验组(Ct(目的基因)- Ct(GAPDH))-对照组(Ct(目的基因)- Ct(GAPDH))。
1.3.5 免疫组化检测结直肠癌组织SRXN1表达
结直肠癌患者肿瘤及其配对的癌旁组织利用4%多聚甲醛固定,石蜡包埋切片,脱蜡、水化及抗原修复后,5%BSA抗原阻断,滴加SRXN1抗体(1∶200),4℃孵育过夜;PBS清洗3次,每次5 min,滴加HRP标记的二抗,37℃孵育30 min,PBS清洗3次,每次5 min;DAB显色,苏木素复染3 min,1%盐酸乙醇分化。利用徕卡显微镜(DM1000)采集照片。利用Image-pro plus 6.0分析软件计算每个样本中SRXN1表达的平均光密度值(IOD)。
1.3.6 细胞分组及转染
取对数生长期的COLO205细胞,1×104cells/mL的细胞量传于6孔板,将COLO205细胞随机分成:空白对照组(Control)、SRXN1干扰对照组(si-NC)、壬基酚(10-6mol/L)组(NP)、SRXN1干扰组(si-SRXN1)、壬基酚+SRXN1干扰组(NP+si-SRXN1)。si-NC及si-SRXN1按照Lipofectamine 2000脂质体转染试剂盒说明书转染入COLO205细胞12 h后,再利用NP干预24 h。
1.3.7 CCK-8检测
按照CCK-8试剂盒操作说明,每孔加入10 μL CCK-8溶液,在细胞培养箱内继续孵育4 h,用酶标仪(450 nm)检测各组细胞的吸光值(OD值)。
1.3.8 克隆形成实验检测
以每皿200个COLO205细胞分别接种于37℃预温10 mL培养液的皿中,并轻轻转动,使细胞分散均匀,置37℃,5% CO2的细胞培养箱中培养14 d。弃去上清液,用PBS小心清洗2次。4%多聚甲醛固定15 min,弃去固定液,加适量吉姆萨染色液(GIMSA)染色30 min,然后洗去染色液。Nikon显微镜(TS100-F)拍照后,计算克隆形成数量。
1.3.9 Transwell检测
COLO205细胞血清饥饿24 h后,将细胞按照5×104接种到Transwell小室上层内,下层的24孔板中加入含10% FBS的RPMI-1640培养基,置于37℃、5% CO2培养箱中培养24 h后;每孔加入1 mL 4%多聚甲醛溶液,室温固定10 min;吸去固定液,用1×PBS清洗,加入1 mL 0.5%结晶紫溶液染色30 min,1×PBS洗3次,每次3~5 min;用棉签小心擦去Transwell小室内没有迁移的细胞,置于200×显微镜下观察,计数每个视野中的细胞数。
1.3.10 Western blot检测
收集细胞,利用RIPA裂解,冰上孵育20 mim后,4℃,10 000~14 000 r/min离心3~5 min,取上清,BCA定量,每孔按照20 μg蛋白量上样,SDSPAGE电泳后,转膜,分别以兔抗SRXN1(1∶800)、ERK1/2(1∶800)、p-EKR1/2(1∶800)、PI3K(1∶1000)、p-PI3K(1∶800)、Akt(1∶1000)、p-Akt(1∶800)、Wnt3a(1∶1000)、β-catenin(1∶1000)及GAPDH(1∶10000),4℃、孵育过夜后,TBST漂洗3次,加入HRP酶标抗兔二抗。加入ECL发光液膜置于全自动化学发光分析仪中扫描,通过TANON GIS软件读取相关条带灰度值。
1.4 统计学方法
所有实验均重复3次,数据以平均数±标准差(±s)表示。实验数据采用GraphPad Prism 6.0分析及绘图。多组间数据的比较采用单因素方差分析,组内两两比较采用LSD-t检验,组织标本中SRXN1表达采用配对t检验,P<0.05为差异有统计学意义。
2 结果
2.1 NP对结直肠癌COLO205细胞中SRXN1表达的影响
RNA-seq分析发现,NP引起COLO205细胞中154个基因表达异常,上调基因107个,下调基因57个,其中SRXN1的log2FoldChange为2.17倍(图1A)。与空白对照组(Control)比较,不同浓度NP(10-7、10-6、10-5mol/L)分别作用COLO205细胞后,SRXN1 mRNA及SRXN1蛋白表达均显著升高(均P<0.05)(图1B、图1C)。与Control组比较,SRXN1特异性si-SRXN1-1、si-SRXN1-2均显著抑制SRXN1表达(t=7.23、5.14,均P<0.01),si-SRXN1-1的抑制效果最明显,后续实验均使用si-SRXN1-1特异性抑制SRXN1(图1D~图1F)。与si-SRXN1-1组比较,不同浓度的NP(10-7、10-6、10-5mol/L)分别作用COLO205细胞后,SRXN1 mRNA及SRXN1蛋白表达均显著升高(P<0.01)(图1G~图1I)。以上结果说明NP能够促进结直肠癌COLO205细胞中SRXN1的表达。
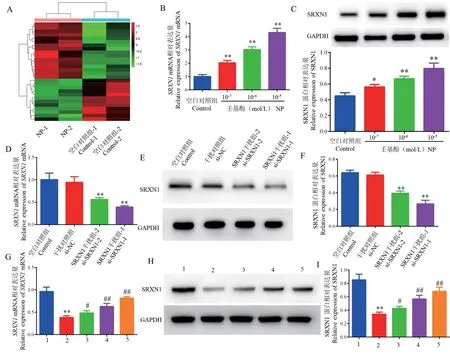
图1 SRXN1在COLO205细胞中的表达Figure 1 Expression of SRXN1 in COLO205 cells
2.2 SRXN1在结直肠癌中的表达分析
TCGA分析发现,在肿瘤样本中,SRXN1的表达显著高于正常肠组织(P<0.01)(图2A)。qRT-PCR检测收集的结直肠癌肿瘤组织样本中SRXN1 mRNA表达量显著高于癌旁组织(t=10.23,P<0.01)(图2B);IHC检测分析发现,结直肠癌肿瘤组织样本中SRXN1的表达显著高于癌旁组织(t=6.64,P<0.01)(图2C、图2D)。以上结果说明,在结直肠癌中,SRXN1的表达显著升高。

图2 SRXN1在结直肠癌中的表达Figure 2 Expression of SRXN1 in colorectal cancer
2.3 SRXN1抑制后,NP对结直肠癌细胞增殖影响
CCK-8检测发现,与Control组比较,NP组细胞活力显著高于Control组(t=4.64,P<0.01),而si-SRXN1组细胞活力显著低于Control组;与si-SRXN1组比较,NP+si-SRXN1组细胞活力显著增加(t=5.72,P<0.01)(图3A)。与Control组比较,NP组克隆数显著高于Control组(t=5.64,P<0.01),si-SRXN1组显著低于Control组(t=10.76,P<0.01);与si-SRXN1组比较,NP+si-SRXN1克隆数显著增多(t=4.24,P<0.05)(图3B、图3C)。

图3 COLO205 细胞增殖能力检测Figure 3 COLO205 cell proliferation capacity assay
2.4 SRXN1抑制后,NP对结直肠癌细胞侵袭及迁移能力的影响
NP组细胞侵袭数著高于Control组(t=2.31,P<0.01);si-SRXN1组COLO205细胞侵袭数显著低于Control组(t=4.99,P<0.01)。与si-SRXN1组比较,NP+si-SRXN1能够促进细胞的侵袭(t=2.97,P<0.01)(图4A~图4C)。NP组COLO205细胞迁移数显著高于Control组(t=2.45,P<0.01);si-SRXN1组COLO205细胞迁移数显著低于Control组(t=4.19,P<0.01)。与si-SRXN1组比较,NP+si-SRXN1能够促进细胞的迁移(t=2.07,P<0.01)(图4A~图4C)。

图4 COLO205细胞侵袭及迁移能力变化Figure 4 Changes in invasion and migration ability of COLO205 cells
2.5 SRXN1抑制后,NP对增殖、侵袭相关通路激活的影响
课题组前期研究发现NP可通过激活ERK1/2促进结直肠癌细胞增殖[5-7]。PI3K/Akt、Wnt/βcatenin在多种肿瘤中异常激活,调节肿瘤的增殖及EMT。Western blot检测发现:与Control组比较,NP显 著 促 进p-ERK1/2、p-PI3K、p-Akt、Wnt3a、βcatenin的表达(t=3.34、3.04、4.80、6.81、5.71,均P<0.01),而si-SRXN1组抑制p-ERK1/2、p-PI3K、p-Akt、Wnt3a、β-catenin的 表 达(t=13.34、8.75、11.74、8.65、12.47,均P<0.01);与si-SRXN1组比较,NP+si-SRXN1组中p-ERK1/2(t=4.80,P<0.01)、p-PI3K(t=3.82,P<0.01)、p-Akt(t=3.78,P<0.05)、Wnt3a(t=4.48,P<0.05)、β-catenin(t=6.90,P<0.05)的表达显著升高。以上结果说明NP能够促进ERK1/2、PI3K/Akt、Wnt/β-catenin通路的激活,而SRXN1显著抑制上述通路的激活影响COLO205细胞的增殖及侵袭能力(图5)。

图5 Western blot检测PI3K/Akt、ERK、Wnt3a/β-catenin通路表达Figure 5 Expression of PI3K/Akt, ERK1/2 and Wnt3a/β-catenin pathways detected by Western blot
3 讨论
随着现代工业的发展,大量化学物质释放到自然环境中,造成极大的环境污染,其中一类外源性化学物质可模仿或部分模仿性激素,并通过与性激素受体结合或影响细胞信号途径等方式发挥毒性作用,这类物质被称为环境内分泌干扰物(EDCs)亦称环境雌激素[15]。研究发现EDCs能够引起人类生育能力降低和诱发多种疾病,如肥胖症、糖尿病和癌症[16]。NP是EDCs的典型代表,由于NP具有亲脂性,导致其极易在组织和器官中聚集,与肿瘤的发生密切相关[8-9]。深入阐明NP与肿瘤的发生、进展的关系,对肿瘤的防治具有重要的意义。
肿瘤的发生及进展受氧化应激水平调节,活性氧通过调节炎症、线粒体功能、激活MAPK及AMPK等通路促进肿瘤的发生及进展[17-18]。NP能够引起机体氧化应激水平的失衡,促进ROS及炎症因子的释放促进心脏毒性、胃粘膜炎症、卵巢颗粒细胞的凋亡和自噬[19-20]。RNA-seq及qRT-PCR检测发现,NP引起SRXN1表达显著上调。SRXN1属于保守的内源性Sulfiredoxin 抗氧化家族的成员之一,可通过调节活性氧的释放,发挥神经保护作用[12]。最近研究发现,SRXN1 在多种恶性肿瘤中具有促进增殖及转移的能力[21-22],SRXN1通过影响过氧化物酶活性,调节ROS水平,以使组织免受氧化应激损伤,进而促进肿瘤细胞增殖及EMT的发生[23-24]。本文研究发现,抑制SRXN1 的表达后,结直肠癌COLO205细胞的增殖、侵袭及迁移能力显著降低,而NP则得到相反的结果。暗示NP促进结直肠癌细胞增殖、侵袭及迁移可能与SRXN1表达相关,但NP如何影响SRXN1表达以及与氧化应激的关系,还需通过实验进一步研究。
调节细胞增殖及转移的主要通路为ERK1/2、PI3K/Akt及Wnt/β-catenin等,ERK1/2、PI3K/Akt在多种肿瘤中异常激活,调节肿瘤的增殖、分化及EMT[25]。ERK1/2的异常激活,促进增殖相关蛋白(CyclinD1、C-myC、PCNA)的表达,促进结直肠癌细胞增殖[7],抑制PI3K/Akt通路后,显著抑制卵巢癌细胞EMT及增殖[26]。SRXN1可通过激活Wnt/βcatenin[27]、ERK1/2[28]及PI3K/Akt[29]通路。通过Western blot检测发现,NP显著促进p-ERK1/2、p-Akt及Wnt3a、β-catenin的表达,暗示NP能够显著激活ERK1/2、PI3K/Akt及Wnt/β-catenin通路;SRXN1抑制后,NP对ERK1/2、PI3K/Akt及Wnt/βcatenin通路的激活作用被减弱,暗示NP激活ERK1/2、PI3K/Akt及Wnt/β-catenin通路与SRXN1表达相关。
综上所述,NP可促进SRXN1的表达,调节结直肠癌细胞的增殖、侵袭及转移,其分子机制与ERK1/2、PI3K/Akt及Wnt/β-catenin等通路激活有关;但NP与SRXN1具体调控机制,还有待进一步研究。
