自噬在慢性肾病血管钙化中的作用研究
2023-03-13婷毛海霞林佳如朱婷婷张丽玲张冬梅吴蔚桦欧三桃
康 婷毛海霞林佳如朱婷婷张丽玲张冬梅吴蔚桦欧三桃*
(1.西南医科大学附属医院肾病内科,四川 泸州 646000; 2.四川省肾脏疾病临床医学研究中心,四川 泸州 646000)
慢性肾病(chronic kidney disease, CKD)是心血管疾病独立的风险因素,反过来心血管疾病也是CKD患者高死亡率的首要原因.有研究发现血管钙化是导致CKD患者心血管疾病发病率和死亡率呈倍数增长的主要危险因素[1]。目前认为血管钙化是一种血管平滑肌细胞由收缩表型向成骨样表型转分化的生物学过程[2]。CKD血管钙化的发生机制非常复杂,近期有研究发现尿毒症患者钙化的肾动脉较移植肾的肾动脉自噬相关蛋白明显增加,自噬可能参与了尿毒症患者血管钙化的形成[3]。由于自噬是一种动态的调节系统,越来越多的研究发现自噬在血管钙化中的作用会受疾病过程、诱发因素以及周围微环境等多种因素的影响,甚至在血管钙化中有保护性自噬和非保护性自噬两种观点,其机制尚不完全清楚[4]。目前,自噬与CKD血管钙化的关系研究较少,自噬在血管钙化中的作用很复杂,因此本研究旨在通过体内、外实验探讨自噬在高磷诱导的CKD血管钙化中的激活情况及其作用,为CKD血管钙化的防治提供新策略。
1 材料和方法
1.1 实验材料
1.1.1 实验动物
选用SPF级SD雄性大鼠30只,6周龄,体重250~280 g,购自西南医科大学城北校区动物中心[SCXK(川)2018-0017],于西南医科大学城北校区动物房饲养[SYXK(川)2018-0065]。该实验经西南医科大学实验动物伦理委员会审批(IACUCSWMU2020262),并遵守实验动物的3R原则。
1.1.2 细胞
大鼠胸主动脉平滑肌细胞株(A7R5),购自中国科学研究院(上海细胞库)。
1.2 主要试剂与仪器
腺嘌呤(V900471,美国Sigma公司);1.8%高磷饮食(北京科奥协力);钙含量测定试剂盒(C004-2-1,南京建成生物有限公司);β-甘油磷酸钠(βglycerophosphate, β-GP)及氯喹(chloroquine, CQ)(G9422,C6628,美国Sigma公司);雷帕霉素(rapamycin,RAP)及 3-甲基腺嘌呤(3-methyladenine, 3-MA)(S1039,S2767,Selleck公司);α-SMA多克隆抗体(BS70000,南京巴傲得生物科技有限公司);兔抗RUNX2多克隆抗体(bs-20003R,北京博奥森生物技术有限公司);Beclin-1兔单克隆抗体、LC3B兔单克隆抗体及鬼笔环肽(Phalloidin)(#3495,#3868,#8953,美国CST公司)。光学显微镜(Nikon公司);全自动生化分析仪(西门子,德国)。
1.3 实验方法
1.3.1 动物分组及造模
将SD大鼠随机分为对照组(Control,15只)和CKD血管钙化模型组(CKD,15只)。模型组大鼠给予腺嘌呤混悬液(200 mg/(kg·d))灌胃+1.8%高磷饮食,而对照组大鼠予以相应等体积的生理盐水及正常饮食,持续灌胃给药6周。
1.3.2 取材
成模后用代谢笼收集24 h尿液用于检测24 h尿蛋白,取材当天使用1%戊巴比妥钠按照40 mg/kg剂量腹腔注射麻醉大鼠,取下腔静脉血检测生化指标;取右肾做常规石蜡包埋、切片;游离胸腹主动脉,部分做常规石蜡包埋切片,部分新鲜组织做钙含量测定。
1.3.3 生化指标检测
采用自动生化分析仪检测血尿素氮(BUN)、肌酐(Scr)、血钙(Ca)、血磷(P)及24 h尿蛋白。
1.3.4 HE染色
常规脱蜡复水,苏木素染5 min后,1%盐酸酒精分色2 s,0.5%氨水返蓝1 min,75%乙醇2 s,1%伊红30 s,脱水透明封片。
1.3.5 茜素红染色
石蜡切片常规脱蜡复水,滴加茜素红S液染色30 min,用双蒸水洗5 min共3次,常规脱水、透明、封片。
1.3.6 Masson染色
按照Masson染色试剂盒说明书进行操作。常规脱水、透明、封片,在光镜视野下观察拍摄。
1.3.7 钙含量测定
大鼠主动脉组织匀浆后取上清液,按照试剂盒说明书加入工作液及上清液,混匀后使用酶标仪测定OD值,BCA法测定主动脉总蛋白浓度,主动脉钙含量(mmol/g pro)=(测定OD值-空白OD值)/(标准OD值-空白OD值)×标准品浓度(1 mmol/L)/待测样本蛋白浓度(mmol/g)。
1.3.8 免疫组化法检测胸腹主动脉蛋白的表达
常规脱蜡水化,修复抗原,蒸馏水浸泡5 min,3% H2O2孵育15 min,山羊血清室温封闭20 min。分别滴加一抗(RUNX2、α-SMA、LC3B、Beclin-1),4℃冰箱过夜,依次滴加相应的二抗、辣根酶标记链霉卵白素工作液,37℃孵育20 min,DAB显色液,显微镜下观察显色情况,棕黄色或棕褐色为阳性表达。蒸馏水充分冲洗,苏木素复染20 s,脱水,透明,封片。
1.3.9 细胞培养及分组
将大鼠胸主动脉平滑肌细胞(aortic smooth muscle cell, ASMC)培养在含有15%胎牛血清DMEM高糖完全培养基的基础培养基中作为正常组(Normal),加入10 mmol/L β-GP刺激诱导细胞钙化的细胞作为高磷组(β-GP)。干预分组:用25 μmol/L CQ干预自噬的降解过程,预处理30 min后再分别加入基础培养基和含有10 mmol/L β-GP的培养基,分为氯喹组(CQ)、高磷+氯喹组(β-GP+CQ),并与正常组(Normal)、高磷组(β-GP)做对照。再分别用100 nmol/L RAP及5 mmol/L 3-MA干预自噬强弱,预处理细胞30 min后分别加入含有10 mmol/L β-GP的培养基,分为高磷+雷帕霉素组(β-GP+RAP)、高磷+3-甲基腺嘌呤组(β-GP+3-MA),并与正常组(Normal)、高磷组(β-GP)作对照。将不同时间点的不同组别细胞做好标记后置于37℃、5% CO2培养箱继续培养。
1.3.10 细胞免疫组化
将细胞固定,破膜,滴加10%正常山羊血清封闭液室温下20 min,,滴加α-SMA抗体或RUNX2抗体,于4℃冰箱孵育过夜,滴加二抗工作液,室温孵育20 min,滴加辣根酶标记链霉卵白素工作液,室温孵育20 min, DAB溶液显色,PBS冲洗后苏木素复染细胞核5 min,PBS洗净后吸水纸吸干爬片上的液体,封片。
1.3.11 细胞免疫荧光
将细胞固定,破膜,滴加10%山羊血清封闭30 min,滴加LC3B抗体,于4℃冰箱过夜,滴加10%山羊血清稀释的荧光二抗孵育1 h,避光滴加鬼笔环肽染细胞质,再滴加DAPI细胞核,避光清洗后,封片,荧光显微镜下观察。
1.3.12 钙含量测定
1.5 mL 0.6 mol/L盐酸进行细胞脱钙,24 h后收集细胞上清液,根据钙测试盒说明书(微板法)测定钙含量;PBS洗涤细胞后加入1.5 mL 1 mol/L NaOH/0.1% SDS裂解细胞,并提取细胞上清液,BCA法测定蛋白含量,结果以钙含量/蛋白含量(mmol/g pro)表示。
1.3.13 Western blot
裂解并提取细胞蛋白,依照碧云天公司的BCA蛋白定量试剂盒说明书测定上清液蛋白浓度,SDSLoading buffer进行稀释,干煮,配胶,上样,在不同浓度的SDS-PAGE凝胶中电泳,转膜,封闭,加入LC3B、Beclin-1、RUNX2及α-SMA孵育,在4℃冰箱过夜,再用二抗稀释液室温孵育1~2 h,显色液显色,曝光检测。
1.3.14 电镜
收集细胞后依次0.5%戊二醛、3%戊二醛、1%四氧化锇固定,丙酮脱水,环氧树脂渗透液进行渗透,包埋,制成超薄切片后,依次用醋酸铀、枸橼酸铅染色,室温下染15~20 min,透射电镜下观察。
1.4 统计学方法
用SPSS 22.0软件进行统计学处理。计量资料用平均数±标准差(±s)表示,组间均数比较采用独立样本t检验或单因素方差分析,方差不齐时采用Kruskal-Wallis H检验,Pearson做两个变量之间的相关性分析,以P<0.05为有统计学意义。
2 结果
2.1 两组大鼠生化指标比较
与对照组大鼠相比,CKD钙化组大鼠Scr、BUN、P及24 h尿蛋白均有不同程度的升高,Ca降低,差异具有统计学意义。见图1。

图1 两组大鼠生化指标的比较Figure 1 Comparison of biochemical indexes in two groups of rats
2.2 两组大鼠肾病理改变
对照组大鼠肾小球大小正常,肾小管及肾间质结构与形态无明显异常。CKD钙化组大鼠肾HE染色结果显示肾小球及肾小管中可见大量的棕黄色物质沉积,肾小球囊腔有轻度扩张,部分肾小管扩张,肾间质纤维化;Masson染色结果显示:肾小球基底膜增厚,同时可见少数的肾小球硬化,肾间质广泛蓝染的胶原纤维。见图2。

图2 两组大鼠肾HE及Masson染色Figure 2 HE and Masson staining of kidney in two groups of rats
2.3 两组大鼠主动脉钙化情况
HE染色可见对照组大鼠主动脉染色均匀,血管壁完整,弹性纤维连续;而CKD钙化组大鼠主动脉中膜层颜色加深,弹性纤维明显断裂,血管平滑肌细胞排列紊乱。茜素红染色结果显示与对照组相比,CKD钙化组大鼠主动脉中膜层广泛分布红染的钙结节沉积。此外,CKD组主动脉钙含量也较对照组更高,差异具有统计学意义。见图3。

图3 两组大鼠胸腹主动脉钙化情况Figure 3 Calcification of thoracoabdominal aorta in two groups of rats
2.4 大鼠主动脉成骨样分化及自噬相关蛋白表达
免疫组化结果显示:对照组大鼠主动脉平滑肌细胞质中可见α-SMA蛋白均匀分布,而RUNX2无明显表达。CKD大鼠动脉血管壁中膜弹性纤维断裂,中膜层平滑肌细胞可见α-SMA蛋白表达明显减少,而RUNX2蛋白表达增加,差异具有统计学意义。LC3B、Beclin-1是目前最常用的自噬相关蛋白标记物,可用于静态观察自噬的激活情况。免疫组化结果显示:对照组大鼠动脉血管壁各层细胞中均有少量的LC3B、Beclin-1蛋白表达,而CKD大鼠动脉血管壁中膜层平滑肌细胞排列紊乱,棕黄色染色明显加深,LC3B、Beclin-1蛋白表达增强,差异具有统计学意义。见图4。

图4 两组大鼠主动脉免疫组化染色Figure 4 Immunohistochemical staining of aorta in two groups of rats
2.5 相关性分析
Pearson相关分析显示,大鼠主动脉钙含量与Beclin-1及LC3B蛋白表达呈正相关关系,RUNX2蛋白与Beclin-1及LC3B蛋白表达也呈正相关关系。见图5。

图5 主动脉钙含量及蛋白的相关性分析Figure 5 Correlation analysis of calcium content and protein in aorta
2.6 β-GP诱导大鼠ASMC钙化及成骨样分化
使用10 mmol/L β-GP刺激ASMC 3、5、7 d后,茜素红染色结果显示β-GP组较正常组(Normal)有明显的橘红色钙化结节,且随时间的的延长逐渐增多。免疫组化结果也显示,随着时间的延长,β-GP组较正常组细胞质内α-SMA表达逐渐减少,而分布在细胞核内的RUNX2表达则逐渐增加,以上结果提示β-GP成功诱导了ASMC钙化,并逐渐向成骨样分化,且具有时间依赖性。见图6。
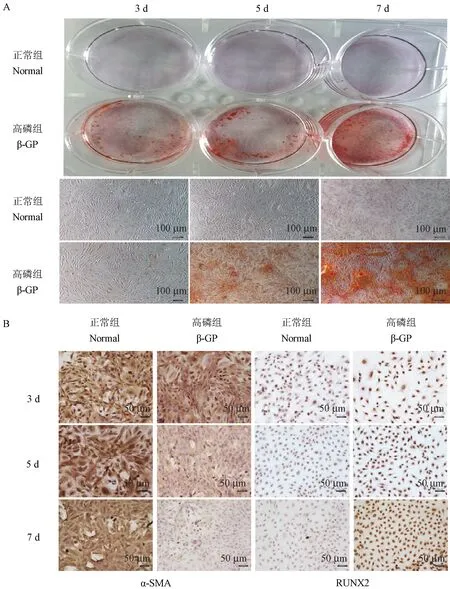
图6 两组大鼠ASMC不同时间点茜素红染色及免疫组化结果Figure 6 Alizarin red staining and immunohistochemical results of ASMC in two groups at different time points
2.7 β-GP诱导大鼠ASMC自噬增强
β-GP刺激大鼠ASMC 48 h后,免疫荧光结果显示:两组细胞红色荧光信号的平滑肌细胞质骨架及蓝色荧光信号的细胞核结构清晰,β-GP组较正常组绿色荧光信号LC3B表达明显增强,Merge后显示LC3B呈斑点状分布在细胞质中(见图7A)。透射电镜检测结果显示:与正常组相比,β-GP组大鼠ASMC细胞质中可见溶酶体与自体吞噬体融合,自噬小体明显增多,提示β-GP诱导的ASMC钙化模型中存在明显的自噬(见图7B)。Western blot结果显示:β-GP组较正常组LC3BII蛋白相对表达量增加,加入溶酶体抑制剂CQ抑制自噬的降解过程,可见β-GP+CQ组较β-GP组LC3BII表达明显增多,同时β-GP+CQ组较CQ组LC3BII表达也明显增多(见图7C)。以上结果提示β-GP对大鼠ASMC的刺激促进了自噬激活过程。

图7 β-GP诱导自噬在ASMC中的激活情况Figure 7 β-GP induced autophagy activation in ASMC
2.8 增强及抑制自噬对大鼠ASMC钙化的影响
为进一步研究自噬对ASMC钙化表型的影响,加入自噬抑制剂3-MA及激活剂RAP干预7 d后观察其变化。结果见图8,Western blot显示β-GP组较正常组ASMC中LC3BII、Beclin-1蛋白表达升高,加入3-MA后LC3BII、Beclin-1蛋白表达下降,说明3-MA成功地抑制了自噬过程;反之,加入RAP后LC3BII、Beclin-1表达明显升高,说明RAP成功地诱导了自噬增强。同时,β-GP组较正常组α-SMA蛋白表达减少,RUNX2蛋白表达升高,β-GP+3-MA组与β-GP组比较,α-SMA蛋白表达明显进一步减少,而RUNX2蛋白表达明显进一步升高;反之,β-GP+RAP组与β-GP组比较α-SMA蛋白表达明显升高,而RUNX2蛋白表达明显减少(见图8A)。免疫组化显示β-GP组较正常组ASMC内α-SMA蛋白表达减少,而细胞核内RUNX2蛋白增多,加入3-MA后α-SMA蛋白表达明显进一步减少,RUNX2蛋白仍有大量表达,而加入RAP后α-SMA蛋白有所增加,RUNX2蛋白表达减少(见图8B)。茜素红染色结果显示正常组未见明显钙化结节,β-GP组可见均匀分布的橘红色钙化结节,β-GP+3-MA组橘红色钙化结节明显增多,而β-GP+RAP组只散在分布少许的钙化结节(见图8C)。钙含量测定结果也与此一致,与正常组相比,β-GP组大鼠动脉平滑肌细胞钙含量增多,加入3-MA后钙含量进一步升高,而加入RAP后钙含量明显降低(见图8D)。以上结果表明抑制自噬可以加剧β-GP诱导的大鼠ASMC钙化及成骨样分化,而增强自噬则可以减轻钙化及成骨样分化。

图8 3-MA及RAP干预自噬对ASMC钙化的影响Figure 8 Effects on ASMC calcification after 3-MA and RAP intervention on autophagy
3 讨论
CKD血管钙化最初被认为仅发生在终末期肾病,近期有研究发现CKD早期也可发生血管钙化[5-6]。一项研究纳入439例中度CKD但无心血管疾病的患者,亚组分析发现,血磷每升高1 mg/dL,冠状动脉钙化风险增加21%,胸主动脉钙化增加33%,主动脉瓣钙化增加25%,二尖瓣钙化增加62%[7]。大量研究表明,血磷已成为CKD血管钙化的关键调节因子,能以多条途径启动和推进血管钙化的发生[8]。因此将高磷作为血管钙化诱导因素对研究CKD血管钙化机制具有重要的意义。由于单用磷酸盐造模周期长且模型不稳定,腺嘌呤可以在体内通过黄嘌呤氧化酶生成难以溶解的代谢产物沉积在肾小管和肾小球,破坏肾的滤过功能,影响磷酸盐的排泄,进而加重高磷血症。故本研究采用高磷饮食联合腺嘌呤诱导CKD血管钙化大鼠模型,生化结果显示模型组大鼠较对照组肾功能显著下降,血磷及24 h尿蛋白定量等显著升高,肾病理提示肾间质纤维化改变,主动脉中膜α-SMA表达减少而RUNX2表达增加,钙含量明显增加。细胞实验采用β-GP刺激大鼠ASMC,可见随着时间的延长,细胞钙化及成骨样分化越明显。提示成功建立CKD血管钙化大鼠模型及ASMC钙化模型。
作为真核生物中普遍存在的对细胞内物质及成分进行降解再利用的基本过程,自噬在各种生理和病理过程中均有发生,生理范围内的自噬发挥保护作用,但病理性自噬可能产生过多或过少的活化,参与人体多种病理过程如感染、癌症、神经变性和衰老以及心脏、肝和肾系统等疾病[9]。巨自噬是自噬的经典途径,也是本研究所涉及的自噬类型。在典型的自噬过程中,Beclin 1与多个分子形成复合体诱导自噬体形成,LC3B系统参与自噬体的运输和成熟。自噬相关蛋白已经成为疾病干预的新的候选靶标,Beclin 1及LC3B已成为自噬相关蛋白常用的标记物。本研究发现与对照组相比,CKD血管钙化大鼠主动脉在发生血管钙化及成骨样分化时,存在LC3B及Beclin 1的表达明显增加。相关性分析结果显示自噬与钙化可能呈正相关关系。曾有研究者在含有0.9%磷饮食及0.75%腺嘌呤诱导的大鼠腹主动脉钙化中检测到LC3B荧光斑点及LC3B蛋白表达增加[10],这与我们的发现一致。为进一步明确自噬在CKD血管钙化中的激活情况,本研究通过免疫荧光染色和电镜发现β-GP诱导ASMC发生钙化同时其LC3B表达及自噬小体较对照组明显增多。为证实钙化组是否有自噬流的增强,即LC3B或自噬小体的增加不是自噬降解过程障碍所致,而是由于自噬起始过程诱导增强,我们采用监测自噬流的常用方法即用溶酶体抑制剂CQ抑制自噬降解过程后观察LC3BII蛋白表达情况[11],结果发现β-GP可以诱导大鼠动脉平滑肌细胞自噬流增强。这提示血管钙化的同时存在明显的自噬增强。
目前对于自噬增强究竟是促进还是抑制钙化存在争议。既往有研究发现3-MA抑制自噬后加剧维生素D3和尼古丁诱导的血管壁钙沉积[12];二甲双胍可通过AMPK-mTOR途径激活自噬从而减轻β-GP诱导的ASCM钙化[13]。然而也有研究发现自噬激活可能是尿毒症毒素硫酸吲哚酚诱导CKD血管钙化的关键机制之一[14]。黄芪甲甙通过ERK抑制自噬并减轻β-GP诱导的ASCM钙化[15]。自噬增强会促进AGEs诱导的人血管平滑肌细胞成骨样转化和凋亡[16]。为了进一步探索自噬在β-GP诱导的ASMC中的具体作用,本研究通过抑制或者促进自噬,观察其对钙化的影响。通过免疫组化、Western blot、钙含量测定以及茜素红染色等发现RAP促进自噬后,高磷刺激下的大鼠ASMC的钙沉积减少,钙含量水平明显降低,RUNX2蛋白表达减少,α-SMA蛋白表达增多,而3-MA抑制自噬后其结果与之相反。这表明自噬参与β-GP诱导的动脉平滑肌细胞的钙化及成骨样分化,可能作为一种内源性保护作用的反馈机制而被β-GP诱导增强,与既往支持自噬激活可以减轻血管钙化的发现一致。我们推测自噬对血管钙化的抑制作用可能与自噬可降解特异性蛋白有关。既往有研究发现自噬可降解肺动脉平滑肌细胞表面的BMPR2[17]。Frauscher等[18]通过体内、体外实验发现自噬主要通过减少RUNX2并增加α-SMA、SM22α蛋白转录水平从而抑制成骨转分化。此外,自噬可能还与减少释放基质小泡、抑制细胞凋亡等有关[10,19]。
总之,本研究通过体内、外研究发现高磷诱导血管钙化同时存在自噬的激活,自噬的发生与钙化密切相关;自噬在CKD血管钙化中可能具有内源性保护作用,增强自噬可以抑制血管钙化,为未来将自噬作为治疗CKD患者血管钙化新的手段又增添了一个有力的依据。今后将进一步探讨自噬影响CKD血管钙化的具体机制,为血管钙化的防治提供新的思路。
