青年急性大血管闭塞性卒中病因及血管内治疗效果
2023-03-13潘晓虎朱发勇曹月洲贾振宇
潘晓虎, 朱发勇, 曹月洲, 贾振宇, 刘 圣
(1. 江苏省盱眙县人民医院 神经内科, 江苏 淮安, 211700;2. 南京医科大学第一附属医院 介入放射科, 江苏 南京, 210029)
脑卒中目前已成为中国居民致死、致残的首位病因[1], 急性大血管闭塞性卒中(ALVOS)是导致脑卒中患者高致残率和高病死率的主要原因[2]。近年来发生缺血性脑卒中的青年人群(18~45岁)占比有升高趋势,但是发病率依然较低[3]。与中老年患者不同,青年卒中患者在病因学、危险因素、临床特点等许多方面有复杂性和特殊性,临床诊治经验不足[3]。本研究回顾分析了2018年1月—2021年12月2家卒中中心所有应用血管内治疗的青年ALVOS患者的临床及影像资料,并评估了血管内治疗的有效性和安全性,旨在为临床诊疗提供更多依据。
1 资料与方法
1.1 一般资料
回顾性分析2018年1月—2021年12月2家卒中中心收治的接受血管内治疗的40例青年ALVOS患者的临床及影像资料,患者本人或家属术前均签署知情同意书。纳入标准: ① 发病时患者18~45岁; ② 前循环闭塞符合《2019AHA/ASA缺血性卒中指南》的入组标准; ③ 后循环大血管闭塞发病在24 h以内; ④ 所有患者发病4.5 h内,且具有静脉溶栓的适应证,可先行静脉内溶栓者。排除标准: ① 对造影剂过敏者; ② 影像学检查提示存在大面积脑梗死者; ③ 颅内出血者; ④ 重要脏器功能障碍或衰竭者。所有入组患者或者家属均签署知情同意书,本研究经医院伦理委员会批准。
1.2 方法
1.2.1 术前影像评估: 头颅CT、CT血管造影(CTA)、CT灌注成像(CTP)由128排螺旋CT(optima CT 660, GE Healthcare, Milwaukee, WI, USA)扫描完成,所有入组患者的CTP原始数据均使用RAPID软件(iSchemaView, Menlo Park, CA)量化的核心梗死和缺血半暗带。
1.2.2 血管内治疗: 由4名具有副高以上职称的神经介入医师完成,常规采用支架联合中间导管抽吸的方式,一般采用局部麻醉,躁动者使用约束带将四肢及头部固定,必要时可静脉用丙泊酚镇静。常规介入术前准备,采用改良Seldinger方法穿刺右侧股动脉,先行常规脑血管造影,全面评估头颈部血管情况。确定责任血管后,尽可能将8F Envoy导引导管(美国Cordis公司)或6F长鞘置于颈内动脉岩骨段(若责任血管为基底动脉,则将导引导管置于椎动脉),经导引导管引入Navien颅内支撑导管(美国ev3公司),微导丝与微导管配合穿过闭塞部位到达闭塞血管远端后撤出微导丝,经微导管造影证实远端血管通畅。经微导管引入SolitaireAB支架(美国ev3公司)或Trevo支架(美国stryker公司),透视下精确定位于闭塞段后缓慢释放支架,造影了解支架释放后血管通畅情况,停留5~8 min, 取栓同时由助手通过引导管进行持续负压吸引,以最大程度减少继发的栓子脱落堵塞远端血管。撤出支架系统,取栓后再次造影了解血管再通情况,必要时可重复上述过程2~3次。
1.2.3 术后治疗: 成功再通患者,术后需控制血压至正常水平; 将再通失败患者的血压目标值维持在收缩压≥150 mmHg。术后即刻行DynaCT检查排除颅内出血情况。术前应用阿替普酶(rt-PA)静脉溶栓者术后24 h复查头颅CT, 以排除颅内出血。考虑病因为大动脉粥样硬化形成时采用双联抗血小板治疗; 考虑为心源性卒中时采用口服抗凝药物治疗; 口服阿托伐他汀20 mg稳定斑块治疗。
1.3 评价标准
(1) 按照急性卒中试验 (TOAST)分型[4]标准,本研究中纳入的ALVOS包括大动脉粥样硬化(LAA)型、心源性栓塞(CE)型、其他原因(SOE)型及不明原因(SUE)型。(2) 血管再通评价: 血管再通采用改良脑梗死溶栓分级系统(mTICI)评估, mTICI≥2b级定义为血管再通成功。(3) 症状性颅内出血: 所有患者术后72 h内复查颅脑CT, 采用海德堡标准[5]评估颅内出血情况。新发颅内出血满足以下任何1项,且无其他可解释的神经功能恶化的原因,即可诊断为症状性颅内出血: ① 与神经功能恶化前相比,美国国立卫生研究院卒中量表(NIHSS)评分增加≥4分; ② NIHSS评分中任何1项增加≥2分; ③ 导致需要病变侧去骨瓣减压术、脑室外引流、气管插管或其他重要处理措施。(4) 临床效果评价: 发病后90 d时采用改良Rankin量表(mRS)评价患者血管内治疗的长期预后, 0~2分为预后良好, 3~6分为预后不良。TOAST分型、症状性颅内出血由2名具有高级职称的神经内科医师进行评定。
1.4 资料收集与术后随访
收集所有患者的性别、年龄、基础病、临床症状、基线和出院前NIHSS评分、时间信息(发病时间、到院时间、穿刺时间、血管再通时间)、血管再通情况、术中取栓次数、是否使用辅助治疗措施、临床预后评分等。术后1~3个月由医师或护士对患者进行随访(门诊或住院),记录患者一般情况、神经功能等。
1.5 统计学分析
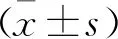
2 结 果
2.1 青年ALVOS血管内治疗患者临床资料
入组的40例患者占同期所有急性缺血性卒中血管内治疗患者总数的4.52%(40/885), 其中男32例(80.0%), 女8例(20.0%), 年龄41.5(36.0, 44.0)岁。术前基线NIHSS评分为12(6.3, 15.8)分; 发病至就诊时间为254.5(187.0, 343.3) min; 股动脉穿刺到再通时间为74.0(55.8, 103.5) min; 取栓一次再通11例(27.5%), 取栓次数为2.0(1.0, 3.0)次; 前循环取栓36例(90.0%), 后循环取栓4例(10.0%); 再通情况为38例患者成功再通(95.0%), 2例再通失败(5.0%); 术后发生症状性颅内出血6例(15.0%)。随访90 d, 40例患者mRS评分为2.0(0, 3.0)分, 5例死亡(mRS评分为6分),其中1例死亡原因为感染性心内膜炎, 2例死于心力衰竭,另外2例死亡原因为肺栓塞; 2例重度残疾(mRS评分为4分), 4例中等残疾(mRS评分为3分), 29例患者预后良好(mRS评分 0~2分),预后良好率72.5%, 预后不良率27.5%。
2.2 预后良好与预后不良患者临床资料比较
预后良好患者、体质量指数(BMI)、手术时间、取栓次数、症状性颅内出血与预后不良患者比较,差异有统计学意义(P<0.05), 见表1。

表1 青年ALVOS血管内治疗预后良好与预后不良患者资料比较
2.3 患者基线与出院时NIHSS评分比较
40例ALVOS患者出院时NIHSS评分为2.0(0.3, 7.5)分, 较基线NIHSS评分[12.0(6.3, 15.8)分]降低,差异有统计学意义(P<0.05)。
2.4 典型病例
本组1例27岁烟雾病患者,因“左侧肢体乏力4 h”入院,急诊CTA提示核心梗死87 mL, Tmax >6 s的250 mL, Mismatch2.9, 造影示右侧大脑中动脉M1段闭塞,急诊取栓后血流难以维持,遂解脱Solitaire 4 mm×20 mm支架,再通成功,术后MR提示烟雾病,患者出院时症状完全缓解,术后3个月随访无新发缺血症状(见图1)。
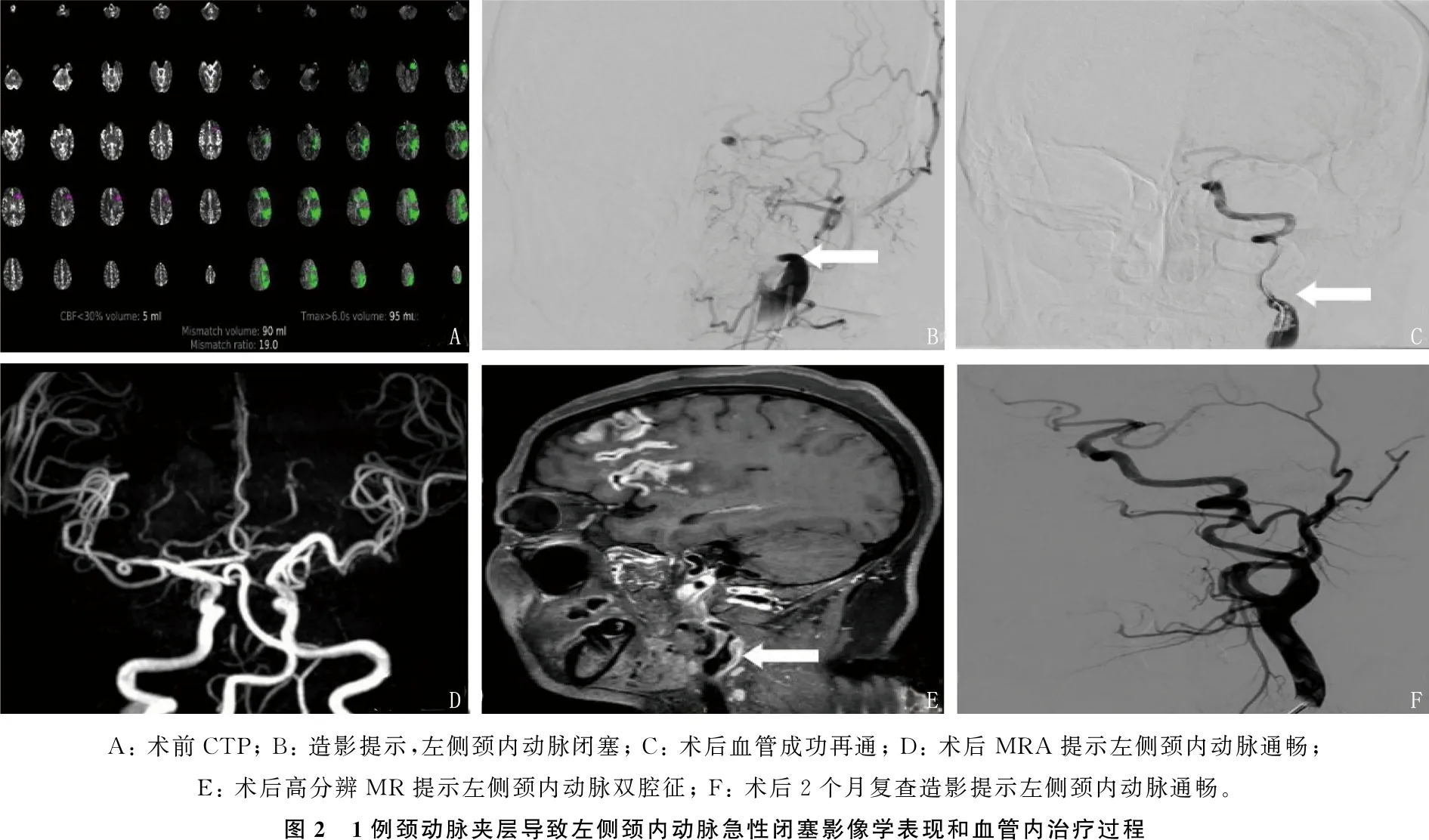
本组1例41岁女性患者,因“口齿不清、右侧肢体无力34 h”入院,急诊CTA提示核心梗死5 mL, Tmax >6 s的95 mL, Mismatch19.0, 药物治疗效果差, DSA提示颈内动脉起始部闭塞,存在颈动脉夹层的可能,予以单纯球囊扩张后远端血流恢复,遂未置入支架,术后1周MRA显示管腔通畅,术后高分辨MR提示,颈内动脉起始部“双腔征”,提示有夹层,术后1个月症状完全缓解,术后2个月复查造影提示管腔通畅(见图2)。
3 讨 论
机械取栓是早期ALVOS中老年患者的首选治疗方案,但关于青年ALVOS的研究报道较少。ALVOS的发病率较低,均为少见病例,临床诊治经验不足。本研究纳入的40例患者为中国国内青年最大组病例报道。既往研究[6]报道,目前青年缺血性脑卒中占所有缺血性脑卒中的15%~18%,本研究纳入的青年患者占比较低主要是因为本研究中入组的均为大血管性脑卒中患者,也可能与人群差异有关。本研究结果显示,国内青年卒中以男性发病为主, LAA型和CE型患者占比较高,血管内治疗对ALVOS同样安全有效。

本组纳入的40例急性大血管闭塞性脑卒中患者中,男性多于女性,且大多LAA型卒中患者为男性,与既往研究[7]一致,考虑与青年男性烟酒嗜好、肥胖占比高于女性有关[8]。此外,青年女性体内较高的雌激素可通过抑制血小板聚集、调节脂质代谢等途径发挥神经保护作用[9]。相比之下,一项关于108例高龄患者ALVOS血管内治疗的研究[10]中,男性患者少于女性(35.2%、64.8%)。
目前缺血性脑卒中病因学分型仍采用国际上公认的TOAST分型标准, SPORNS P B等[11]对187例中老年(年龄72岁)前循环ALVOS患者的血栓进行病理分析发现, CE型患者占比最高(41.0%), 其余依次为SUE型(34.2%)、LAA型(19.0%)、SOE型(6.0%)。与中老年患者不同,青年脑卒中的病因多样,病理过程复杂[3]。本组40例青年ALVOS患者TOAST分型中的LAA型患者占比最高(45.0%), 其余依次为CE型(30.0%)、SOE型(20.0%)、SUE型(5.0%), SOE型占比高于既往研究[12-13], 其中颈动脉夹层6例(15.0%), 烟雾病1例(2.5%), 动脉瘤术后支架内血栓形成1例(2.5%)。
颈动脉夹层是脑卒中的少见原因,但却是青年脑卒中的常见原因[14], 其发病机制主要为: ① 血栓脱落引起远端血管栓塞性梗死,也是颈动脉夹层诱发ALVOS的主要原因; ② 夹层动脉壁间血肿引起内皮损伤,进而诱发血栓形成,导致颈动脉管腔狭窄、闭塞,发生分水岭梗死[14]。MOREL A等[15-16]报道,颈动脉夹层合并大血管闭塞患者的病死率为23.0%。《急性缺血性卒中血管内治疗中国指南2018》[17]明确提出, 18岁以上、急性前循环ALVOS患者应尽早实施血管内介入治疗,但目前颈动脉夹层导致ALVOS的治疗方案仍有争议。本组6例颈动脉夹层患者血管内治疗90 d良好预后率为83.3%(5/6), 提示血管内治疗对颈动脉夹层相关ALVOS安全、有效,但是由于病例数较少,需进一步研究证实。
急性脑梗死血管内治疗的多中心随机临床(MR CLEAN)试验、小梗死灶和前循环近端闭塞血管内治疗并强调CT至再通时间最短化(ESCAPE)试验、Solitaire支架取栓治疗急性缺血性卒中(SWIFT PRIME)试验等急性缺血性卒中血管内治疗的8项随机对照试验研究(平均年龄65左右)经过严格入组筛选, 90 d良好预后率为47.5%[17]。本组青年ALVOS患者血管内治疗的成功再通率为95.0%, 90 d良好预后率72.5%, 且29例患者术后24 h内症状好转。因此青年ALVOS患者血管内治疗的再通率、良好预后率高,神经功能恢复周期短。原因可能为: ① 青年患者脑血管代偿情况较好; ② 组织修复能力强; ③ 围术期并发症少。此外,肥胖与脑卒中预后的相关性目前仍有争议,既往研究[18]显示,相对于正常体质量患者,超重患者的病死率、严重致残率更低,具体机制尚不清楚,可能与低体质量患者术后感染,并发症发生率高有关。本研究显示,低BMI与不良预后相关,与既往研究[19]不符。ALAWIEH A等[20]研究显示,随着取栓次数的增加,手术时间的延长,患者症状性颅内出血等并发症的发生率升高,手术时间、取栓次数及症状性颅内出血与取栓治疗预后有相关性。
综上所述,青年ALVOS病因以LAA型、颈动脉夹层较为常见,患者以男性多见,且病变部位前循环最为多见,各种病因引起的青年ALVOS血管内治疗安全、有效,且BMI、手术时间、取栓次数、症状性颅内出血可能影响青年ALVOS患者血管内治疗的预后。但本研究样本数量尚少,临床诊治经验不足,还需要多中心、大样本的临床试验进一步验证。
