脂蛋白相关磷脂酶A2水平与阻塞性睡眠呼吸暂停综合征患者并发心血管疾病的关系
2023-03-13许梅杰钱文霞许梅花
许梅杰, 钱文霞, 许梅花, 张 洵
(1. 苏州大学附属张家港医院 呼吸与危重症医学科, 江苏 张家港, 215600;2. 南京医科大学, 江苏 南京, 210009)
阻塞性睡眠呼吸暂停综合征(OSAS)是一种常见的疾病,以反复发作的夜间呼吸停止为特征,其可显著增加高血压[1-2]、心力衰竭[3-4]、心律失常、冠心病[5-6]等心血管疾病(CVD)的风险。睡眠呼吸暂停患者经常表现出交感神经激活、氧化应激和代谢失调,提示OSAS与CVD之间可能存在联系[7]。脂蛋白相关磷脂酶A2(Lp-PLA2)是一种由单核细胞、巨噬细胞和T淋巴细胞产生的炎症酶,在动脉粥样硬化斑块中上调[8], 其对血管性炎症具有高度的特异性。相关研究[9-10]探讨了Lp-PLA2在OSAS患者中的作用,但中国关于Lp-PLA2与OSAS患者并发CVD的研究较少。本研究通过检测OSAS患者外周血Lp-PLA2水平,判断Lp-PLA2可否作为OSAS患者并发CVD的有效预测指标。
1 资料与方法
1.1 一般资料
选取2020年6月—2022年7月在苏州大学附属张家港医院就诊的238例疑似OSAS的患者作为研究对象。依据中华医学会呼吸病学分会睡眠呼吸障碍学组(2011年)修订的《阻塞性睡眠呼吸暂停低通气综合征诊治指南》[11], 呼吸暂停低通气指数(AHI)<5次/h为非OSAS组, AHI 5~15次/h为OSAS轻度组, AHI>15~30次/h为中度组, AHI>30次/h为重度组。非OSAS组53例, OSAS组185例(轻度42例,中度68例,重度75例)。排除标准: 多导睡眠监测(PSG)时间<7 h患者; 中枢性睡眠呼吸暂停综合征患者; 严重肝、肾功能障碍或血液系统疾病患者; 恶性肿瘤患者; 肺源性心脏病、风湿性心脏病、扩张型心肌病、肥厚型梗阻性心肌病及先天性心脏瓣膜病患者; 电解质紊乱患者。本研究经患者或家属知情同意,并经医院医学伦理委员会批准(ZJGRY2020-013)。
1.2 方法
收集人口特征学资料[年龄、性别、体质量指数(BMI)], 既往史(吸烟史、高血压、糖尿病、高脂血症)、PSG参数[AHI、氧减饱和度指数(ODI)、最低动脉血氧饱和度(SaO2)、平均SaO2、血氧饱和度<90%的时间占监测总时间的百分比(TS90%)], 实验室指标[Lp-PLA2、甘油三酯、总胆固醇、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)]水平。
CVD定义为患有心力衰竭或冠状动脉粥样硬化性心脏病或心律失常[12]。吸烟者定义为一生中连续或累积吸烟6个月或以上者。ODI指平均每小时SaO2下降≥4%的次数。AHI指平均每小时呼吸暂停与低通气的次数之和。高脂血症定义为血清LDL-C≥4.1 mmol/L, 或总胆固醇>6.2 mmol/L, 或甘油三酯≥2.3 mmol/L, 或HDL-C<1.0 mmol/L[13]。OSAS患者中并发CVD者为74例。
1.3 观察指标
所有入组对象于PSG监测后当天清晨抽取空腹静脉血5 mL, 以1 000转/min 离心15 min, 上清液储存于-80℃直至使用。统一解冻血上清后,通过酶联免疫吸附测定试剂盒(Alpha Diagnostic International公司)检测血Lp-PLA2, 检测方法严格按照试剂盒说明书进行操作。
1.4 统计学分析
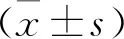
2 结 果
2.1 各组基线资料比较
非OSAS组、轻度OSAS组、中度OSAS组、重度OSAS组在高血压、CVD、AHI、ODI、最低SaO2、平均SaO2、TS90、Lp-PLA2、甘油三酯、总胆固醇、HDL-C及LDL-C水平方面比较,差异有统计学意义(P<0.01), 见表1。

表1 各组基线资料比较
2.2 合并CVD与不合并CVD的OSAS患者人口特征、PSG及实验室指标比较
合并CVD的OSAS患者年龄、AHI、ODI、Lp-PLA2高于不合并CVD的OSAS患者,差异有统计学意义(P<0.05)。2组在性别构成、BMI、最低SaO2、平均SaO2、TS90、甘油三酯、总胆固醇、HDL-C、LDL-C方面比较,差异无统计学意义(P>0.05), 见表2。

表2 合并CVD与不合并CVD的OSAS患者人口特征、PSG及实验室指标比较 P75)]
2.3 不同严重程度OSAS患者合并CVD与不合并CVD的 Lp-PLA2表达
在轻度、中度、重度OSAS患者中,合并CVD组的Lp-PLA2水平均高于不合并CVD组[(177.8±9.1) ng/mL与(124.1±11.1) ng/mL,P<0.001; (190.8±15.5) ng/mL与(144.2±9.4) ng/mL,P<0.001; (245.9±28.7) ng/mL与(166.0±9.1) ng/mL,P<0.001], 差异有统计学意义。见图1。
2.4 ROC评估Lp-PLA2预测OSAS患者并发CVD的价值
当Lp-PLA2截断值为235.1 ng/mL时,最大Youden指数为0.598, 敏感度为68.2%, 特异度为91.6%, 阳性预测值为81.8%, 阴性预测值为83.8%, 曲线下面积为0.804(0.740~0.859),P<0.001, 见图2。


2.5 多因素Logistic回归分析
以OSAS患者是否并发CVD为因变量(否=0, 是=1), 以表2中有统计学意义的指标及既往史为协变量(具体赋值见表3), 统一纳入进行多因素Logistic回归分析,结果显示, AHI、ODI、Lp-PLA2及高血压是OSAS患者并发CVD的独立影响因素(P<0.01), 见表4。

表3 变量赋值方法

表4 OSAS患者并发CVD的多因素Logistic回归分析
3 讨 论
OSAS 是一种常见的睡眠障碍。睡眠呼吸暂停与高血压、冠心病、心律失常等发病率和病死率显著相关[14]。本研究探讨了Lp-PLA2水平与OSAS患者并发CVD的关系,结果发现, Lp-PLA2水平随着OSAS患者病情严重程度的增加而升高(P<0.05); 在不同严重程度的OSAS患者中,合并CVD组的Lp-PLA2水平均高于不合并CVD组(P<0.001); Lp-PLA2是OSAS患者并发CVD的独立危险因素。
OSAS与心脏疾病风险有关,其原因是缺氧、高碳酸血症、呼吸暂停期间交感神经激活增加以及呼吸暂停相关的氧去饱和状态导致心肌氧供需关系紊乱[15]。睡眠中呼吸暂停导致的间歇性缺氧是OSAS的主要生理特征,类似于缺血再灌注损伤。间歇性夜间低氧血症导致氧自由基的产生,导致局部炎症[16-17]。这些结果表明,炎症和氧化应激是OSAS患者并发CVD的重要因素。Lp-PLA2是一种丝氨酸脂肪酶,主要由活化的单核细胞和巨噬细胞产生[18], 其是近年来被广泛研究的动脉粥样硬化炎性标志物,又称血小板活化因子乙酰水解酶,是一类能催化脂蛋白和细胞膜上的甘油磷脂二位酰基酯键水解形成非酯化脂肪酸和溶血磷脂的酶族[19]。在血流中, 1/3的Lp-PLA2与高密度脂蛋白结合,其他的与低密度脂蛋白结合,载脂蛋白B100作为介质[20]。Lp-PLA2进入血管壁,催化低密度脂蛋白表面磷脂的水解,从而导致溶血磷脂酰胆碱和氧化脂肪酸的释放。这些介质触发炎症级联反应,诱导白细胞向动脉壁内膜下间隙趋化,并转化为泡沫细胞。因此, Lp-PLA2增强了动脉粥样硬化斑块脂质核心的生长和不稳定性,从而导致急性心血管事件[21]。一项来自32个前瞻性研究中心、共计79 036名入组对象的荟萃研究[22]发现, Lp-PLA2的活性和水平均与冠心病的风险呈显著相关性。基于这一证据,美国心脏病学会(ACC)、美国心脏病协会(AHA)和欧洲心脏病学会(ESC)的指南,将Lp-PLA2活性测定纳入无症状患者的风险分层,以优化降脂治疗。同样,本研究也发现, Lp-PLA2(OR=2.700,95%CI: 1.412~5.164)是OSAS患者并发CVD的独立危险因素,表明Lp-PLA2>235.1 ng/mL的OSAS患者并发CVD的风险是Lp-PLA2≤235.1 ng/mL患者的2.700倍。
本研究也存在一定的局限性:首先,这是单一地区、单诊疗中心的研究,可能存在一定的选择偏倚,且研究的样本量也有限,故有待于进行大样本量的多中心研究;其次,本研究为横断面研究,未对患者进行随访,故有待进行前瞻性随访研究;最后,本研究未探讨治疗对外周血Lp-PLA2水平的影响,还需进一步研究。
