脑小血管病:回眸2022
2023-03-12王伊龙陈玮琪叶瑾怡周梦圆江凌玲刘东邱宝山高颖赵一龙王赞李鹏飞
王伊龙,陈玮琪,叶瑾怡,周梦圆,江凌玲,刘东,邱宝山,高颖,赵一龙,王赞,李鹏飞
脑小血管病(cerebral small vessel disease,CSVD)是指由各种病因影响脑内小动脉及其远端分支、微动脉、毛细血管、微静脉和小静脉所导致的一系列临床、影像、病理综合征,是复杂且具有较强异质性的一大类脑血管综合征。CSVD的发病率与年龄呈正相关,多发于60岁以上人群,在中老年人群中发病率超过70%,可造成认知障碍、二便障碍、步态不稳等一系列问题,且显著增加卒中、血管性痴呆和阿尔茨海默病(Alzheimer’s disease,AD)的发生风险,是亟待解决的临床和大众健康问题。
2022年,国内外神经病学研究者带来了CSV D领域众多新的突破和发现,推动了CSVD机制探索、诊断、治疗和预后等方面的进步。CSVD临床试验设计框架规范重磅发布,脑心微循环障碍、遗传代谢、预后、新的靶点寻找等方面的研究也方兴未艾。同时,CSVD领域仍存在许多疑问,对该领域研究者未来的工作也提出了更高的要求。
新年伊始,让我们回眸2022年CSVD领域研究的主要进展和突破,共同梳理这些研究的意义和价值。
1 日臻完善:规范的脑小血管病临床试验设计框架
CSVD的发病率高,在全球范围内造成了巨大的疾病负担,但迄今为止仍没有被证明有效的治疗方法,特别是对有症状的患者[1]。既往研究纳入标准、研究设计和终点指标的异质性限制了荟萃分析的数据统计以及治疗指南的制定。使用新发或复发性卒中、认知障碍或痴呆等为临床终点的研究需要较大的样本量,因此有研究者主张在较小规模的Ⅱ期临床研究中使用替代终点以帮助确定最有希望的治疗措施,然后将其推进到更大规模的Ⅲ期临床研究中。目前研究者们正在通过遗传学和其他方法寻找CSVD潜在的干预靶点[2],但如果要在患者中快速有效地评估潜在的治疗方法,则需要改进临床研究方法。2022年,英国剑桥大学的研究团队在国际血管行为和认知障碍学会的支持下,建立了CSVD临床试验设计框架(framework for clinical trials in cerebral small vessel disease,FINESSE)(图1)[3]。该设计框架涵盖如何选择合适的研究人群以减轻样本量的压力,以及如何选择最佳临床终点等问题。

图1 脑小血管病临床试验设计框架
CSVD病程隐匿,临床表现异质性大,在设计相关临床研究时应考虑以下几个关键问题。首先,选择什么类型的CSVD?不同表型CSVD血管病理机制不同,对治疗的反应也不尽相同。因此,减少潜在的病理异质性可减少研究的样本量,可借助临床影像学确定CSVD亚型。其次,选择什么阶段的CSVD?MRI影像标志物的存在及其病变范围是临床事件(卒中及痴呆)发生风险增加的标志物,即使在无症状个体中也是如此。如果拟评价缓解疾病进展的干预措施,选择潜在可改善的疾病早期患者作为研究人群可能是合理的。再次,干预研究是什么临床阶段的?临床阶段不同,研究的目标人群也可能不同,这取决于临床试验的目的是在Ⅱ期临床研究中证明药物的生物学效应,还是在更大规模的Ⅲ期临床研究中证明药物的临床获益。同时,FINESSE还对检测和评估CSVD受试者的认知功能、影像和循环生物标志物进行了说明。此外,新颖的研究设计,如阶梯设计,也可在不影响研究的实用性、准确性或内部和外部效度的情况下提高效率。最后,确定CSVD临床研究的治疗策略、药物类别仍具有挑战性。孟德尔随机化研究或可为CSVD研究靶点的选择提供依据。
FINESSE为CSVD临床研究设计提供了实用且规范的标准。越来越多的对CSVD发病机制的新认识、新发现被提出,特别是遗传学研究进展为CSVD治疗靶点提供了新思路。与其他卒中亚型相比,针对心血管疾病的干预措施是否对CSVD具有特别的疗效更不确定。评估这些干预措施的效果需要稳健且统计学功效充足的临床随机试验数据支持,FINESSE提出的建议或可为此类研究设计提供有用的框架。
2 破冰之旅:脑小血管病系列干预靶点的临床研究初步评价
CSVD是腔隙性卒中的常见原因,可导致认知障碍甚至痴呆。CSVD常见于老年人群,在头颅MRI上可表现为弥漫性脑白质高信号(white matter hyperintensity,WMH)、局灶性缺血性病变和脑微出血(c erebral microbleed,CMB)[4]。目前尚无针对CSVD的疾病修饰疗法。
在病因机制探索上,目前研究认为CSVD与脑血流量(cerebral blood flow,CBF)减少有关,特别是与深灰质核、皮质下白质和WMH内部等皮质下区域的CBF减少密切相关[5-6]。CBF受包括一氧化氮(nitric oxide,NO)在内的多种因素调控。内皮细胞内源性NO可激活血管肌细胞的鸟苷酸环化酶,驱动环磷酸鸟苷(cyclic guanosine monophosphate,cGMP)形成,从而导致肌细胞舒张和血管舒张。细胞质中的cGMP可被磷酸二酯酶(phosphodiesterase,PDE),尤其是PDE5降解。PDE5存在于人脑神经元和皮质下白质内的血管肌细胞中[7-8]。他达拉非是一种血浆半衰期(16 h)较长的PDE5抑制剂,有证据表明其可通过啮齿动物和灵长类动物的血脑屏障[9-10]。他达拉非耐受性良好,目前已在心血管疾病中广泛使用。
2022年,英国的Pauls等[11]在Alzheimers Dementia上发表了第1项PDE5抑制剂治疗CSVD的临床随机对照试验,研究为双盲、安慰剂对照、交叉设计,旨在探索他达拉非单次给药是否会增加CSVD累及的皮质下区域的CBF。该研究将中老年症状性CSVD患者随机分为两组,一组受试者在访视1时接受他达拉非20 mg单次治疗,在访视2时接受同剂量安慰剂治疗;另一组受试者则在访视1时接受安慰剂治疗,在访视2时接受他达拉非20 mg单次治疗。两次访视至少间隔7 d,每次访视分别在给药前3 h和给药后3~5 h进行血压测量、MRI检查和系列认知测试。研究的主要终点是皮质下CBF的变化,分别在深灰质核、表观正常的脑白质和WMH中评估CBF。次要终点是皮质灰质CBF的改变。研究结果显示,他达拉非治疗后,上述3种类型的皮质下组织和总灰质中的CBF均增加。安慰剂治疗后深灰质核、表观正常的脑白质和总灰质的CBF也增加,但WMH中的CBF没有增加。事后分析显示,他达拉非治疗对收缩压[-7.8 mmHg(1 mmHg=0.133 kPa),P<0.001]和舒张压(-4.9 mmHg,P<0.001)均有显著的降低作用。
虽然数据统计未显示单次他达拉非治疗与安慰剂相比可改善皮质下血流,但他达拉非组的WMH灌注有增强的趋势(9.8%,P=0.096),提示他达拉非的治疗方案可能有临床获益。联合其他治疗措施或可达到改善脑血流量的效果。未来的研究应在老年(年龄≥65岁)人群中采用不同的治疗方案,同时需要有足够效力检测到WMH中10%的血流变化。
弥散张量成像(d i f f u s i o n t e n s o r imaging,DTI)网络整合了CSVD多种病理过程的损伤,可为评估脑白质超微结构损伤程度提供额外信息,是CSVD临床研究中潜在的替代标志物。
对CSVD治疗方面的研究突破,首先应提及的是Markus[12]主导的研究,该研究基于DTI脑网络指标评估了PRESERVE试验数据中的治疗相关指标,研究结果发表在2022年的Neurology上。
PRESERVE是一项为期2年的多中心随机临床试验,比较了重度CSVD患者强化降压和标准降压治疗的效果。研究纳入111例存在临床腔隙性卒中(MRI显示的腔隙性梗死),同时合并Fazekas分级≥2级的融合性WMH受试者,将其随机分配至标准降压(收缩压130~140 mmHg)或强化降压(收缩压≤125 mmHg)目标组,其中标准降压目标组56例,强化降压目标组55例。标准降压目标组和强化降压目标组的平均收缩压分别降低了13 mmHg和23 mmHg(P<0.001),结局指标分析显示,强化降压后患者脑弥散网络的完整性(加权全局效率P=0.002,加权局部效率P=0.002)得到了改善。但两组的单一MRI标志物,包括DTI直方图指标、脑体积或WMH的差异未达到统计学意义。
Markus等的研究为CSVD患者强化降压治疗提供了一定的证据支持,其结果提示,针对CSVD患者的多中心临床试验,脑网络指标可能比传统的DTI分析更敏感。有研究者担心,重度CSVD患者由于CBF减少和脑自动调节功能受损,对其进行强化降压可能导致CBF下降,从而加重患者的脑白质损伤和认知障碍。但Markus等的研究为CSVD强化降压提供了证据,其结果提示即使是重度CSVD患者也可从强化降压治疗中获益。
长期高血压是公认的CSVD危险因素。降压治疗可以降低CSVD的发生风险,但这种效应是单纯来自血压控制还是继发于某类降压药物[如钙通道阻滞剂(calcium channel blocker,CCB)可降低动脉血压变异性],目前尚不清楚[13]。
关于CSVD治疗方面的探索研究,其次需要提及的是2022年8月发表在Stroke上的大型随机对照试验——SPRINT-MIND,该试验在一个高血压控制良好的队列中考察了不同种类降压药物,特别是CCB与WMH进展风险的相关性[14]。SPRINT-MIND共纳入448例高血压患者,患者在基线和4年随访时完成两次头颅MRI检查,根据两次MRI扫描的WMH体积差异评估CSVD的进展。两次MRI检查期间的随访中记录患者服用降压药物的相关数据,统计11类降压药物中每类药物处方占随访期的时间百分比,同时根据WMH进展情况将患者分为最高三分位组和其余受试者组两个亚组。
SPRINT-MIND试验结果显示,最高三分位组的年龄[(70.1±7.9)岁vs.(65.7±7.3)岁,P<0.001]和收缩压[(128.3±11.0)mmHgvs.(126.2±9.4)mmHg,P=0.039]高于其余受试者组,其他血管风险因素与其余受试者组的差异无统计学意义。最高三分位组中的72例(48.3%)患者和其余受试者组中的177例(59.2%)患者接受了强化降压治疗。最高三分位组的平均WMH进展为(4.7±4.3)mL,其余受试者组为(0.13±1.0)mL(P<0.001)。血管紧张素转换酶抑制剂(angiotensin converting enzyme inhibitor,ACEI)(OR0.36,95%CI0.16~0.79,P=0.011)和二氢吡啶类CCB(OR0.39,95%CI0.19~0.80,P=0.011)与WMH进展延缓相关。但当将WMH作为连续变量进行分析时,二氢吡啶类CCB与WMH进展的相关性则未达到统计学意义。
综合以上结果,SPRINT-MIND研究的结论为口服ACEI能延缓高血压患者的WMH进展,且该效应独立于血压控制和年龄等因素。
Rho激酶(Rho-associated kinase,ROCK)是一种丝氨酸、苏氨酸蛋白激酶,有研究发现ROCK可能在脑血管疾病的病理过程中扮演着重要角色,ROCK抑制剂可促进长期脑白质损害后的神经功能恢复[15-16]。目前CSVD引起的皮质下白质损伤仍没有特效的治疗措施。Ayata等[17]在小鼠中观察了ROCK抑制剂法舒地尔对皮质下白质损伤后功能恢复的作用,研究结果发表在2022年的Stroke上。该研究将雄性C57/BL6J小鼠随机分为法舒地尔组和溶媒对照组,在接受L-N5-(1-亚胺乙基)-鸟氨酸盐酸盐注射诱导局灶性胼胝体病变模型后的第1天开始进行为期2周的治疗,采用静息状态功能连通(resting-state functional connectivity,RSFC)与网格行走(grid walk)试验来评估小鼠胼胝体损伤后的结局,并在35 d时进行组织学与免疫组化实验的测定(图2)。

图2 法舒地尔和溶媒对照治疗局灶性胼胝体病变小鼠的实验流程
在胼胝体损伤造模后第1天,小鼠脑半球间的连通性丧失。治疗2周后,溶媒对照组脑半球间的连通性未得到明显改善。法舒地尔组在造模后的第1天,脑半球间的连通性低于溶媒对照组,但在治疗2周后,法舒地尔组脑半球间的连通性得到了明显改善(P=0.0002)(图3)。
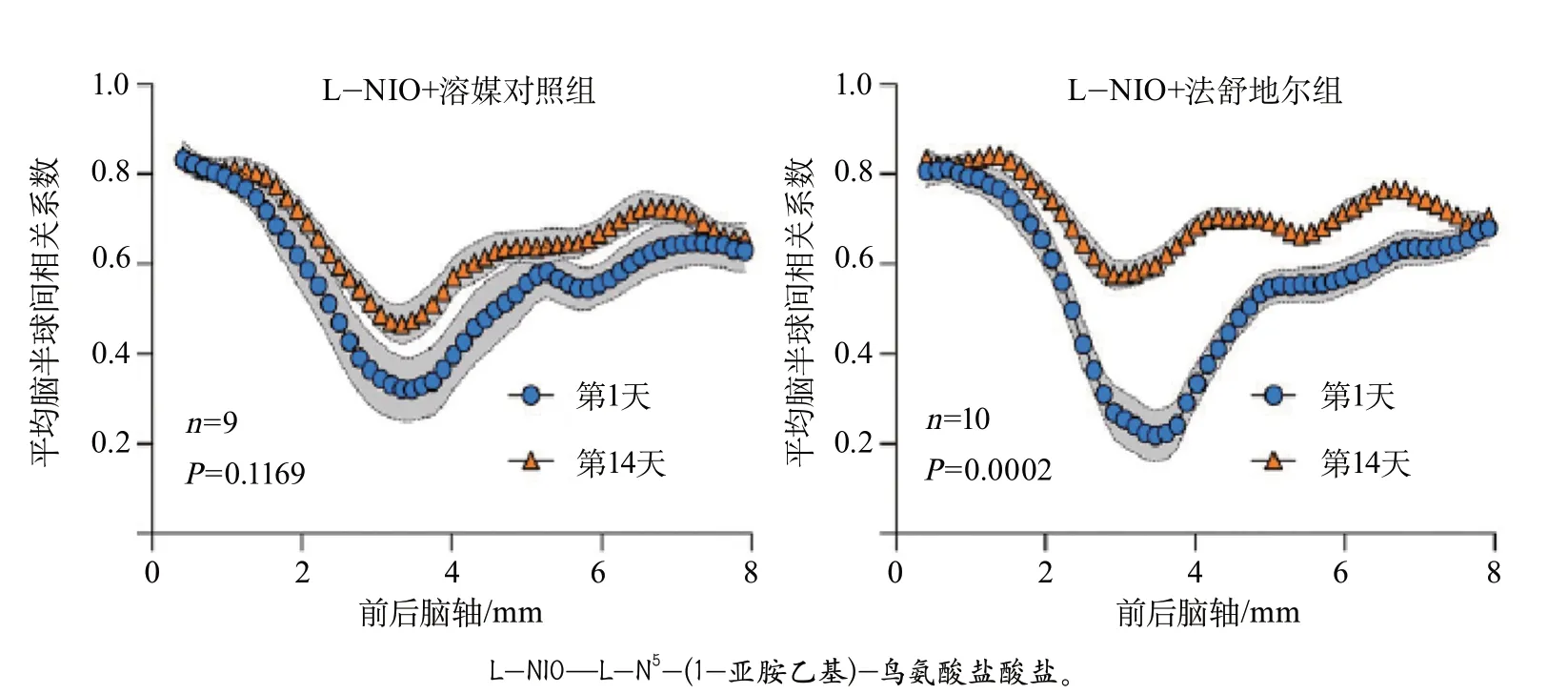
图3 法舒地尔和溶媒对照治疗后小鼠脑半球间的静息状态功能连通性
网格行走试验结果显示,溶媒对照组在胼胝体损伤后第1周发生了十分严重的运动协调缺陷,并至少持续4周(与基线相比P<0.05)。与之相比,法舒地尔组的小鼠在胼胝体损伤后的第1周到第4周均未出现明显的运动协调障碍(双向重复测量方差分析,与溶媒对照组相比,P<0.005)。研究数据提示,法舒地尔可改善小鼠胼胝体损伤后的运动协调性(图4)。

图4 法舒地尔和溶媒对照治疗后小鼠网格行走试验结果
此外,在该研究对法舒地尔改善脑白质损伤可能机制的探索中,研究者未发现法舒地尔组与溶媒对照组小鼠在反应性星形胶质细胞增生、皮质突触密度(synaptophysin)以及胼胝体成熟少突胶质细胞密度方面的差异有统计学意义(图5)。
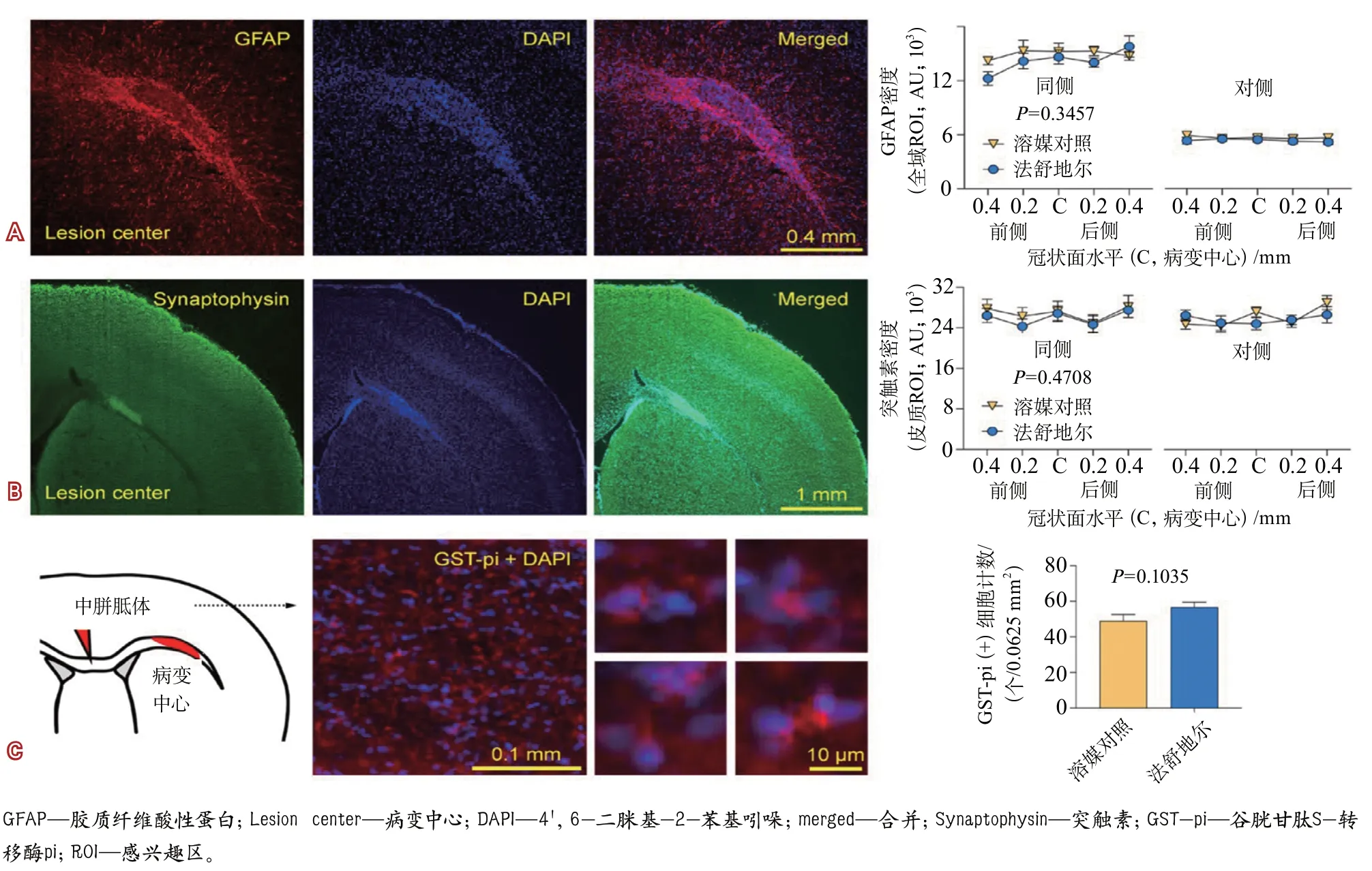
图5 法舒地尔和溶媒对照治疗局灶性胼胝体病变小鼠免疫组化检测结果
综上所述,采用ROCK抑制剂法舒地尔在小鼠脑胼胝体区域白质损伤后进行延迟性治疗,能改善脑半球间的连通性以及小鼠的运动协调能力,提示ROCK抑制剂可改善CSVD引起的皮质下白质区域损伤后的神经功能恢复,但仍需进一步的研究来探索ROCK抑制剂可能的作用靶点及其机制。该实验为CSVD治疗药物的探索提供了新思路。
CSVD尚无有效的治疗方法,尽管目前的指南共识建议使用抗血小板药物进行CSVD的预防和治疗,但其证据级别较低。SPS3研究显示,氯吡格雷联合阿司匹林抗血小板治疗相较于阿司匹林单药治疗并没有降低卒中风险的优势,且死亡率更高[18]。关于腔隙性卒中患者应用单一抗血小板药物相较于安慰剂的治疗效果的证据多来自大型临床随机对照试验的亚组分析,缺少独立设计的临床研究[19]。西洛他唑是一种选择性环磷酸腺苷(cyclic adenosine monophosphate,cAMP)PDE3抑制剂,可通过提高血管壁平滑肌细胞和血小板中的cAMP水平和升高蛋白激酶A的活性,发挥舒张血管和抑制血小板聚集的作用。2010年,日本的CSPS研究中腔隙性卒中亚组分析结果显示,西洛他唑与安慰剂相比,可使2年缺血性卒中风险降低49%,严重出血事件的相对风险降低54%,但西洛他唑预防卒中效果优于阿司匹林的趋势未达到统计学意义(HR0.75,95%CI0.54~1.04)[20]。上述西洛他唑研究初步的良好结果,以及西洛他唑潜在的血管内皮稳定作用[21],引起了研究者对其治疗CSVD作用的关注。
2022年,Stroke发表了2篇关于西洛他唑对CSVD患者脑血流动力学及脑白质病变的影响的研究。
2022年3月,韩国Choi教授团队[22]在Stroke上公布了旨在比较西洛他唑和阿司匹林对C SV D患者脑白质改变(wh it e matter changes,WMC)体积变化影响的CHALLENGE研究结果。CHALLENGE研究是一项研究者发起的多中心、双盲、随机对照、双臂平行设计试验,持续104周。研究纳入头颅MRI上显示中度或重度WMC且存在至少1个腔隙性梗死病灶的CSVD患者,主要结局指标是从基线到随访2年MRI显示的WMC体积变化。研究结果显示,西洛他唑和阿司匹林对CSVD患者2年内WMC进展的影响差异没有统计学意义。不过在CSVD患者中,西洛他唑相比阿司匹林可更好地减轻表观正常脑白质的超微结构损伤,并可更好地降低缺血性血管事件的风险。不过,对该研究次要结局的结果应谨慎解读。
另一项关于西洛他唑的研究是英国Wardlaw教授团队[23]的LACI-1研究,该研究测量了随机接受单硝酸异山梨酯(isosorbide mononitrate,ISMN)或西洛他唑单药治疗、联合治疗或未使用这些药物治疗的腔隙性卒中患者的脑血管反应性、CBF和脑脊液动力学。研究结果显示,使用ISMN和西洛他唑单药治疗患者较未服药患者的脑白质脑血管反应性增加,但联合治疗不增加脑血管反应性。单独使用西洛他唑可升高患者上矢状窦的灌注指数(perfusion index,PI),单独使用ISMN可降低椎动脉的PI。脑脊液搏动则无变化。该研究的样本量较小(57例),可能会造成结果的偏倚。
综合以上研究结果,目前西洛他唑对CSVD治疗的有效性仍缺乏强有力的证据。未来需要更完善的研究来进一步探索。
3 脑心相通:冠状动脉微循环功能障碍与认知障碍有关
缺血性心脏病和退行性脑疾病是死亡和残疾的两个主要原因[24]。过去的10年间,研究者们逐渐认识到心、脑共患疾病的意义,在心、脑两个器官微血管疾病方面的研究取得了重大进展。冠状动脉微循环功能障碍(coronary microcirculatory dysfunction,CMD)和CSVD有共同的危险因素(如高龄、高血压、糖尿病等),这些因素可能对心、脑的微血管床有相似的影响[25]。基于病理变化和危险因素之间的相似性,这两种疾病之间存在着潜在的联系[26],但在既往研究中,由于缺乏能够证明CMD和CSVD相关的大脑病理变化之间关系的客观证据,探索这一问题的研究进展受到了阻碍。
发表于Eur Heart J的C3研究结果显示,冠心病患者的CMD与CSVD影像学改变、脑血流动力学异常与认知障碍相关[27]。C3研究纳入67例冠状动脉疾病患者,对其进行冠状动脉生理功能评估、头颅MRI、TCD和认知功能评估,以探索CMD与CSVD之间的关系。冠状动脉微循环功能的评价指标包括血流储备分数(fractional flow reserve,FFR)、冠状动脉血流储备(coronary flow reserve,CF R)和充血微血管阻力(hy p er aem ic microvascular resistance,HMR)。研究结果显示,CFR异常(<2.0)的患者WMH负担更重(43.2%vs.20.0%,P=0.044)。CFR与灰质体积、白质微结构损伤参数各向异性分数(fractional anisotropy,FA)均呈正相关(P=0.027和P=0.027),与白质微结构损伤参数平均扩散率(mean diffusivity,MD)、径向扩散系数(radial diffusivity,RD)呈负相关(P=0.032和P=0.029)。存在CMD的患者,其TCD检查结果中阻力指数(P=0.022)和搏动指数(P=0.043)较高,神经认知功能评估中的MMSE、Addenbrooke认知评估量表Ⅲ(Addenbrooke cognitive examina Ⅲ,ACE-Ⅲ)中的注意力部分和连线测试A部分(trail making test A,TMT-A)得分较低(图6)。

图6 C3研究的流程和结果
在这项前瞻性研究中,研究者发现冠状动脉疾病患者中CMD的存在与CSVD的相关变化有关,包括WMH、脑白质微结构损伤、灰质萎缩和脑血流异常等。同时也发现CMD与认知障碍相关,CMD反映认知功能的亚临床损害。这些发现支持这样的假设:心脏和脑的微循环功能障碍是影响冠状动脉疾病患者微循环功能的重要环节。
4 拨云见日:脑小血管病的遗传、代谢病因探索
破译CSV D的遗传及代谢因素可以为CSV D的病理生理过程、生物学研究提供新的思路,从而有助于发现潜在的药物靶点。CSVD的遗传及代谢因素研究主要基于影像特征,尤其是WMH和腔隙。
既往对CSVD单基因变异频率、外显率和表型关联的研究主要来自病例报告、小病例系列和家庭谱系研究,因此,结果数据会受到各种偏倚的影响,包括调查偏倚、发表偏倚、报告偏倚等。基于大规模人群的研究,以系统、无偏的方式收集健康数据可以克服以上缺陷,并提供关于CSVD单基因罕见变异在不同环境下的频率及其对临床影响的额外信息。
2022年8月,Ferguson等[28]在Neurology G e n e t i c s上发表了英国生物银行(U K biobank,UKB)20万受试者中5个单基因CSVD罕见变异频率和表型相关性研究的结果。该研究通过对既往系统综述和ClinVar数据库的数据分析,确定了CTSA、TREX1、HTRA1和COL4A1/2等可能致病的罕见基因位点。研究者首先将与这些变异有关的表型及感兴趣的表型映射到UKB从入院、死亡记录和初级保健中关联的健康数据中使用的疾病编码系统。然后,在199 313例具有外显子数据的UKB参与者中,评估了携带≥1种变异的参与者比例、疑似表型的外显率,并采用二元(存在/不存在任何表型)和表型负担(参与者具有的表型数量的线性评分)方法,研究基因变异携带者状态与疑似表型之间的关联(图7)。研究结果发现,0.5%的UKB参与者存在≥1个基因变异,最常见的是HTRA1和COL4A1/2基因变异。根据入院和死亡记录,每例基因变异携带者中有4%~20%具有相关的表型,如果将初级保健记录包括在内,这一比例将增加到7%~55%。与未携带变异基因者相比,COL4A1基因变异携带者具有更高比例的COL4A1相关表型及表型负荷(OR1.29,P=0.006)。虽然在UKB人群中,单基因CSVD基因的假定致病罕见变异发生率为1/200,但只有大约一半的基因变异携带者在健康数据中记录了相关的疾病表型。这与既往多数报道中的遗传表型关联不一致,可能是外显率较低、高估了致病性和(或)统计效力有限等原因所致。

图7 英国生物银行受试者中CSVD单基因罕见变异频率和表型相关性研究
迄今为止,遗传学研究已报道了与CSVD相关的多种遗传变异,多数是通过单个CSVD影像表型进行的分析和探索。鉴于CSVD的复杂性,复合表型(如WMH合并腔隙)可能比单表型更能代表CSVD。2022年6月,Mishra等[29]在Brain上发表的研究基于CSVD极端表型基因分析表明TRIM47基因为CSVD的候选基因。该研究报告了关于极端复合CSVD表型(WMH合并腔隙)的全基因组关联研究和全外显子组关联研究。基于17个具有MRI测量和全基因组基因分型数据(41 326例)、全外显子组测序(15 965例)或外显子组芯片(5249例)数据的老年人群队列,分别为全基因组关联研究和全外显子组关联研究提供了13 776和7079个极端CSVD样本。全基因组关联研究发现8个基因位点变异与极端CSVD相关,其中chr12q24.11位点此前未报道与任何CSVD的影像标志物相关。全外显子组关联研究发现了11个CSVD相关的基因位点,包括EFEMP1基因5’UTR区域(chr2p16.1)的常见变异和TRIM47基因(chr17q25.1)上的错义变异(表1)。孟德尔随机化表明CSVD严重程度与卒中和AD风险增加存在因果关系。研究表明大脑和血管中的TRIM47表达与CSVD严重程度呈负相关。研究观察到TRIM47在小鼠分离的脑血管制剂中富集,与文献报道在单细胞水平上脑内皮细胞表达TRIM47相一致。在人脑内皮细胞中通过小干扰RNA降低TRIM47表达后,内皮通透性(CSVD重要的病理特点)增加。总之,该研究全面的基因定位分析和初步的功能评估表明TRIM47基因在CSVD的病理生理中具有一定的作用,可能是未来探索和转化工作的重要候选基因。

表1 脑小血管病极端表型全基因组关联分析与全外显子组关联分析[29]
代谢组学有助于识别新的疾病危险因素,以更好地了解发病机制、预测疾病的严重程度和进展。代谢组学已成功应用于众多心血管和神经系统疾病相关研究,但其应用于CSVD领域的研究较少。2022年7月,Harshfield等[30]在Brain上发表了一项CSVD代谢组学特征相关研究。该研究基于两项前瞻性队列研究中的624例症状性CSVD患者数据,采集患者入组时的基线血清样本,后续对患者定期进行头颅MRI扫描和认知测试,并进行长达14年的随访。研究者采用超高效液相色谱-质谱仪和核磁共振波谱检查,从369个已注释的代谢物和54 764个未注释的特征中获得了代谢和脂质组学特征,并分析了其与CSVD严重程度的关系。研究中使用MRI CSVD标志物、认知和全因痴呆的未来风险评估疾病严重程度。研究发现28种代谢物与CSVD影像标志物及患者的认知功能相关(图8)。多种甘油磷脂和鞘磷脂水平降低与CSVD负荷增加相关,具体表现为WMH体积增加,平均弥散系数降低,归一化峰升高,脑萎缩和认知损害加重。肌酸、脂肪酸[18:2(OH)]和鞘磷脂(D18:2/24:1)水平升高与腔隙数目增加、WMH体积增大和认知功能损害相关。基线肉碱和肌酐水平较低与骨架化平均扩散率的更高年变化率相关。脂蛋白亚类、氨基酸和外源性物质等25种代谢物与痴呆发病率相关。综上,这项研究证明多个不同的代谢特征与CSVD影像标志物、认知障碍和痴呆有关。后续研究应评估这些因素之间的因果关系并使用代谢组筛查以提高预测未来CSVD严重程度和患者痴呆风险的能力。代谢组图谱还可为疾病的发病机制提供新的观点,并帮助确定新的治疗方法。

图8 MRI标志物及认知参数与代谢产物水平升高的相关性
5 眼见为实:人体病理证实血管周围间隙与脑淀粉样血管病脑膜穿支β-淀粉样蛋白积聚相关
扩大的血管周围间隙(enlarged perivascular spaces,EPVS)是CSVD常见的一种影像学表现,反映了脑内血管周围清除可溶性废物的功能障碍。2022年3月,Perosa等[31]在Acta Neuropathol发表的研究探讨了EPVS的组织病理学特点及其与脑淀粉样血管病(cerebral amyloid angiopathy,CAA)患者β-淀粉样蛋白(amyloid β-protein,Aβ)水平的相关性。研究共纳入19例经尸检病理证实为CAA的病例(平均死亡年龄74岁)和5例非CAA病例(平均死亡年龄88岁),研究者在使用体外离体3T MRI、半自动分割和验证的基于深度学习的模型来量化与EPVS相关的组织病理学,其中16例CAA病例和4例对照组病例在死亡前也进行了头颅MRI(活体MRI)检查。研究结果显示,EPVS主要位于皮质穿通小动脉的白质部分周围,其负荷与相关动脉的CAA严重程度相关。此外,在单独受EPVS影响的血管中,平滑肌细胞减少,血管内Aβ积聚增加并延伸至白质。上述研究结果与EPVS反映小动脉物质交换功能受损的理念一致,对理解在CAA和AD的病理生理中起到重要作用的血管周围清除机制有重要意义[32]。
该研究的MRI结果显示,EPVS的体内负荷与体外MRI负荷相关。在活体和离体MRI上,与非CAA患者相比,CAA患者的半卵圆中心均可见更严重的血管周围间隙(perivascular space,PVS)。基底节区离体MRI中,CAA患者的PVS严重程度高于非CAA患者。活体与离体MRI评估的可见PVS严重程度呈正相关(半卵圆中心:Spearman’sρ=0.58,P<0.001;基底节区:Spearman’sρ=0.20,P=0.039)(图9)。总体来说,该研究证实在活体MRI中,与非CAA患者相比,CAA患者半卵圆中心的可见PVS程度更高,但基底节区的PVS程度无明显升高,与既往研究结果一致。该研究还显示,患者的颅脑组织在福尔马林中固定一段时间后,离体MRI也始终能反映PVS的严重程度。

图9 活体和离体MRI显示的血管周围间隙
此外,该研究还通过离体MRI对基底节和近侧白质区域的PVS严重程度进行了额叶、颞叶、顶叶和枕叶等区域性评估(图10)。在体外离体MRI上,局部MRI可见的PVS严重程度与组织病理学上的EPVS面积相关。在组织病理学上,MRI可见的PVS对应白质血管周围的间隙扩大。值得注意的是,大多数间隙似乎不是完全空的,而是包含部分细胞、网状外观细胞外基质等物质,偶尔有含铁血黄素沉积物。离体组织MRI扫描可见PVS区域评分与组织病理学上的EPVS面积百分比呈正相关(Spearman’sρ=0.408,P<0.001),上述结果表明,离体MRI上的PVS可准确反映组织病理学上的PVS扩大。此外,与非CAA患者相比,CAA患者存在组织病理学上更为严重的EPVS(P<0.001)。
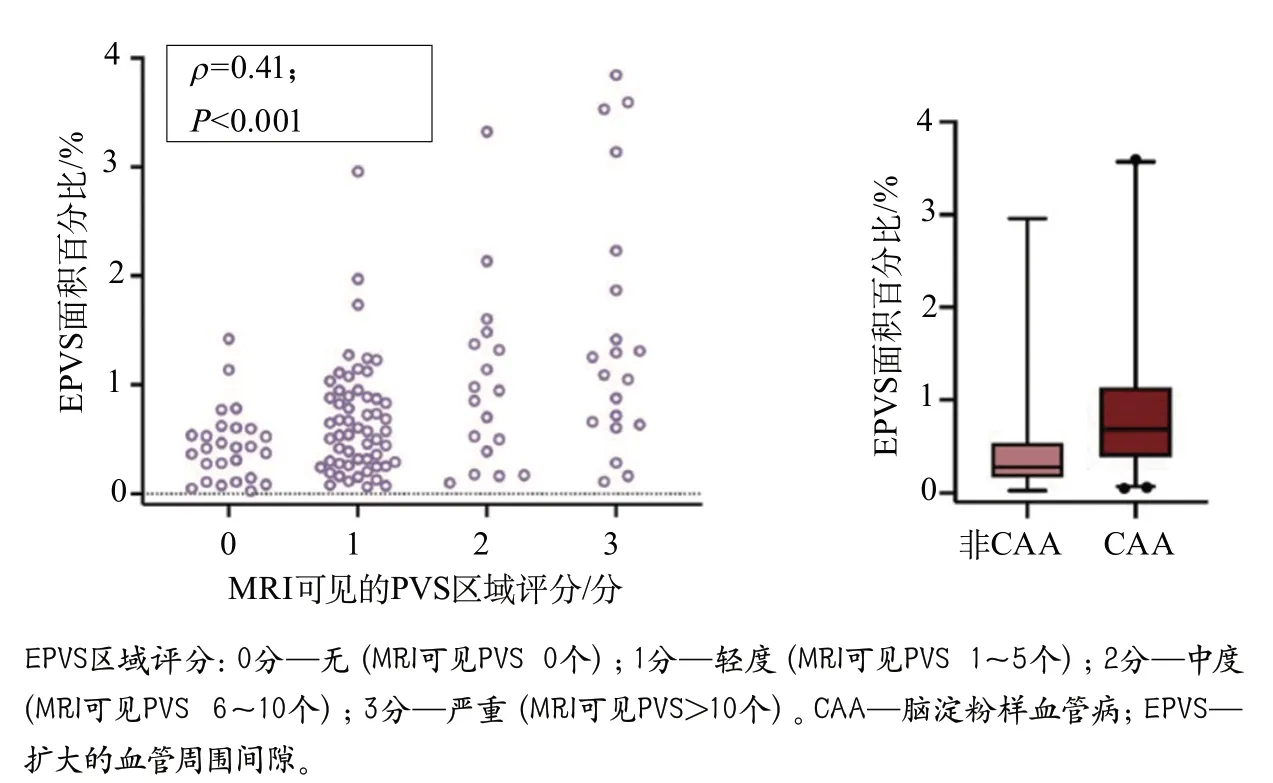
图10 CAA和非CAA患者体外离体3T MRI和组织病理学EPVS定量评分
EPVS与CAA严重程度呈正相关。研究者在CAA病例中使用线性混合效应模型,在模型的所有变量中,总CAA面积百分比和髓鞘稀疏程度与EPVS面积百分比呈正相关。总体最佳拟合模型包括总CAA面积百分比(皮质和软脑膜CAA合并)和髓鞘稀疏程度。研究发现白质中纤维蛋白阳性血管的面积百分比(血脑屏障渗漏的衡量标准)和皮质Aβ斑块的面积百分比(AD病理的衡量标准)对总CAA面积百分比没有显著影响(图11)。皮质和软脑膜血管壁上的Aβ沉积与潜在白质中的PVS增大有关,PVS增大与软脑膜CAA密切相关。

图11 总体CAA、软脑膜CAA面积百分比与EPVS面积百分比的相关性
研究者利用高分辨率MRI的T2WI序列对PVS和PVS相关血管的MRI可见形态进行了深入探索。体外离体3T MRI和临床活体MRI相比,空间分辨率更高,可以更详细地追踪单个PVS及其相关血管。该研究观察到两个关键现象:①在病变白质中发现EPVS围绕起源于脑膜表面的单个血管(即皮质穿通血管);②部分EPVS延伸至皮质,特别是在PVS扩大更严重的病例中。
上述研究结果提示,在经病理证实的散发性CAA人脑中,体内MRI可见的PVS负担反映了组织病理学上的EPVS严重程度。通过合并单支血管分析,证实皮质CAA与基底节白质中PVS增大之间存在相关性。EPVS主要位于皮质穿通小动脉白质部分周围而非小静脉周围,其负担与CAA的严重程度相关。平滑肌细胞和血管功能丧失可导致血管Aβ清除障碍和与同一血管相连的PVS增大(图12)。

图12 CAA与扩大的血管周围间隙的机制
6 罪魁祸首:内皮β位点淀粉样前体蛋白切割酶1通过紧密连接和内皮型一氧化氮合酶损害脑小血管
脑小血管损伤包括内皮紧密连接丢失、内皮细胞功能障碍、血脑屏障破坏等是AD、CAA、高血压相关CSVD共同的早期典型病理改变[33-35]。这些脑小血管的病理改变是否存在共同的机制?既往研究表明,CAA或AD患者的脑血管中β位点淀粉样前体蛋白切割酶1(β-site-APP cleavage enzyme-1,BACE1)水平显著升高,提示血管源性BACE1可能参与了脑小血管损伤的病理过程[36-38]。为了进一步了解血管源性BACE1在脑血管损伤中的作用,中国科技大学神经退行性疾病研究中心的申勇教授团队[39]结合细胞和分子技术、质谱、免疫染色方法以及功能验证,全面揭示了血管源性BACE1潜在的病理机制。
这项研究观察到高血压患者的大脑微血管中BACE1的表达增加了3.71倍(图13)。重要的是,研究者发现内皮细胞紧密连接蛋白闭合蛋白是一种内皮细胞BACE1的全新底物。BACE1通过切割闭合蛋白减少全长的闭合蛋白和产生闭合蛋白片段。BACE1升高引起的过度切割诱导膜内小凹蛋白的积累和随后小凹蛋白1介导的内吞作用,导致溶酶体降解其他紧密连接蛋白。同时,膜上小凹蛋白1增加了与内皮型一氧化氮合酶(endothelial nitric oxide synthase,eNOS)的结合,以及由升高的BACE1产生的循环Aβ水平升高,导致eNOS活性减弱,最终造成内皮功能障碍。此外,在内皮特异性BACE1转基因小鼠中,初始的血管内皮损伤会引起CBF缓慢降低、血脑屏障通透性增加、微出血、tau蛋白过度磷酸化、突触丢失以及认知障碍。相反,抑制异常的BACE1活性可以改善紧密连接蛋白损失、内皮功能障碍和记忆缺陷。

图13 高血压患者脑组织中内皮细胞BACE1升高和闭合蛋白降低
该研究建立了血管源性BACE1与脑小血管损伤之间的直接关系,揭示了内皮细胞BACE1水平异常升高是CSVD的新发病机制(图14)。
7 祸不单行:脑小血管病14年长期预后的预测因素
血管危险因素和基线CSVD严重程度目前已被认为是CSVD进展的决定因素。CSVD的进展程度和速度存在个体异质性,多数病程进展缓慢。目前研究多为横断面研究或随访期较短的队列研究,难以观察到CSVD影像标志物的长时程、动态变化并探索CSVD预后的预测因素。
迄今为止,CSVD最长时程随访研究来自荷兰。2022年,Leeuw教授团队[40-41]先后在Stroke和J Neurol Neurosurg Psychiatry上发表了他们的研究成果。该研究团队基于拉德堡德大学弥散张量与磁共振队列(Radboud University Nijmegen diffusion tensor and magnetic resonance cohort,RUN DMC),对503例散发性中老年(50~85岁)CSVD患者进行了长达14年的随访,随访期间对受试者进行4次神经影像学扫描和半定量评估、认知功能测评及临床结局采集。
Leeuw团队的研究显示,WMH体积平均年进展为0.6(0.7±4.0)mL。部分患者在随访期间的一段时间内曾出现WMH逆转,但这些WMH逆转大多被整体时间内的WMH进展所覆盖。14年随访期间,93%的受试者整体仍然表现为WMH进展,仅有4%的患者表现为净WMH减退。
同时,研究发现,高龄和基线为中度WMH(Fazekas评级2级)是WMH快速进展的有效预测因素,此外,CSVD病变的基线负荷(估计值0.31,95%CI0.25~0.37,P<0.001)和血管危险因素(估计值0.39,95%CI0.08~0.70,P=0.01)可独立且协同地预测WMH的进展,只有基线CSVD负荷可独立预测14年随访期间腔隙的发生(估计值1.52,95%CI1.27~1.85,P<0.001)。
既往研究认为,3%~4%的散发性CSVD患者存在DWI阳性病灶。由于患者并没有明显症状,且病灶在2周左右出现信号减退甚至消失,这些DWI阳性病灶在CSVD进展中的确切作用尚不明确。在RUN DMC队列的随访中,有8.9%的受试者检出DWI阳性病灶。相对DWI阴性组,DWI阳性组受试者的基线WMH体积更大,存在腔隙或CMB的比例更高。进一步分析发现,在至少完成1次随访的患者中,相对DWI阴性组,DWI阳性组在中位13.2年的随访中有更高的WMH体积进展率(β=0.36,95%CI0.05~0.68,P=0.023)、更高的腔隙发生率(RR2.88,95%CI1.80~4.67,P<0.001)和更大的认知功能下降幅度(β=-0.03,95%CI-0.05~-0.01,P=0.006)(图15),但两组全因死亡、卒中、全因痴呆等终点事件的发生率差异无统计学意义。

图15 DWI阳性和DWI阴性组14年随访期间WMH体积进展率、腔隙发生和认知指数进展率比较
过去,我们对CSVD的认识局限于临床经验和部分短时程随访研究。RUN DMC队列为我们展示了CSVD长时程的影像学和临床动态变化,进一步明确了CSVD不良预后的预测因素既包括传统的基线血管危险因素和CSVD影像学负荷,也包括DWI阳性病灶这类新的影像学标志物。这对识别处于快速进展风险中的患者并提供早期预警具有重要临床指导意义。
8 互为因果:脑龄差与脑小血管病相互影响
随着人类预期寿命的延长,年龄相关疾病也带来了日益严峻的挑战。对个体而言,生理年龄并不等同于实际年龄,两者的年龄差是导致年龄相关疾病的危险因素。通过头颅MRI数据库来整合和计算神经成像衍生的年龄相关特征,可评估脑的生理年龄。脑龄差(brain-age gap,BAG)基于预测脑龄(生理脑龄)和实际脑龄之间的差异,能较好地反映个体的脑衰老情况。BAG常用于评估神经系统疾病对脑衰老的影响,并预测临床预后[42]。CSVD是年龄相关的脑血管疾病,MRI上主要表现为WMH、腔隙和CMB等,可导致血管性认知障碍和痴呆[43]。但是,CSVD如何影响脑衰老及其与认知功能的相互作用尚不清楚。
2022年,Chung教授团队[44]首次报道了CSVD患者的脑老化情况,并探讨了全脑或特定区域的BAG是否影响CSVD相关认知障碍。该研究利用1482例健康个体(年龄18~92岁)的MRI灰质特征图像构建了全脑和区域性脑龄预测模型,并获得预测脑龄和实际脑龄的差异。然后将此模型应用于中国台湾宜兰县老龄化研究队列[年龄≥50岁的非卒中、非痴呆志愿者734例,其中124例发现存在CSVD(CSVD组)]。数据分析发现:①CSVD组的整体认知功能、言语记忆和执行功能等低于非CSVD组,差异有统计学意义(表2);②CSVD组的全脑BAG高于非CSVD组[(3.71±7.60)岁vs.(-0.43±9.47)岁,P=0.003,η2=0.012](图16);③CSVD组与非CSVD组在89个脑区(82个大脑皮质区、3个皮质下区和4个小脑区)存在明显的区域性BAG,其中7个脑区的BAG在CSVD与认知功能障碍中发挥中介效应(图17)。

图16 脑小血管病与非脑小血管病患者的区域性脑龄差比较

图17 区域性脑龄差在脑小血管病导致的认知功能障碍中的作用

表2 脑小血管病与非脑小血管病患者的认知功能对比
另一项Habes等[45]的研究结果证明预测的脑龄和WMH之间存在正相关性。不过,该研究没有纠正年龄或血管危险因素等混杂因素,也没有考虑CSVD的其他标志物的影响。Chung团队的研究首次评估了CSVD和预测脑龄的相关性,其结果表明,即使无症状性CSVD也可以加快脑衰老。该研究不仅有助于了解CSVD相关临床预后的潜在机制,而且有助于分析CSVD相关神经退行性疾病的潜在机制。未来旨在评估异常大脑衰老的疾病研究应考虑CSVD。
然而,Chung团队的研究也存在一定的局限,包括:①该研究依据T1WI的灰质特征,特
别是灰质体积来预测脑龄。后续应通过DTI或静息态功能磁共振(resting-state functional MRI,rs-fMRI)等检查进一步理解CSVD影响脑衰老的机制。②该研究的研究对象是既往无卒中或痴呆病史的中老年人,其CSVD病变程度相对较轻,尚需进一步研究来探索BAG与重度CSVD之间的关系。③该研究仅探索了CSVD患者BAG与认知功能障碍的空间关系,尚需纵向研究来阐明CSVD中各脑区异常衰老的先后顺序及其因果关系。
9 关键纽带:“认知弹性”依赖于脑白质连通性
除AD外,脑血管病,包括CSVD、卒中及CAA等所致的脑组织病理损害也是认知障碍的原因之一。不过,大脑损害与认知障碍的关系目前并不明确。部分具有明显脑组织损害病理改变的个体仍能保持正常的认知水平,被称为“认知弹性”,有研究者用“认知储备”假说来解释这种现象[46-47]。需要开发能客观反映认知储备的标志物,以探索大脑动态适应能力的机制。2022年,荷兰马斯特里赫特大学DeJong教授团队[48]开展了一项观察性、前瞻性、基于人群的队列研究。该研究旨在从脑结构连接组的角度分析不同大脑损害程度与认知水平之间的关联,从而加深对神经环路、认知功能及认知储备之间相互作用的理解。研究者提出了一项新的假说:更密集的、具有更高连通性的脑结构网络能够缓冲脑组织损害对认知功能的影响。
该研究纳入4759例中老年受试者(平均年龄59.2岁)。所有受试者均完成神经认知心理量表测试(包括记忆、信息处理速度及执行、注意功能3个方面),并完成MRI检查中的FLAIR、3D结构、DTI等序列扫描。采用全脑灰质、白质、脑脊液、WMH体积及WMH负担(Fazekas分级0~3级)、CSVD总负担(0~3分)作为大脑损害的标志物。采用自动解剖标记(automatic anatomical labeling,AAL2)脑图谱定义全脑结构网络的节点(包括94个脑区),采用纤维束体积与全脑体积的比值定义网络的边,从而构建全脑结构加权网络。采用多元线性回归分析评价脑结构连接网络标记(如节点度值,即每个脑区与全脑其他脑区的平均连接数目)与大脑损害标记之间的交互作用对认知水平的影响。
该研究结果显示,较低的灰质及白质体积、较高的WMH体积与较低的认知水平有关;相反,较高的网络节点度值与较高的认知水平有关(表3)。此外,较高的CSVD严重程度与较低的认知水平有关,且呈剂量依赖关系。进一步分析发现,以上脑损害标志物与认知水平之间的关联性随着网络节点度值的增加而明显减弱,提示存在明显脑损害的个体如具有较强的白质连通性则可能保持正常的认知能力(图18)。

表3 脑损害标志物及网络连通性测量与综合认知评分之间的关联
最后该研究从认知老化的角度探讨了网络节点度值如何调节CSVD严重程度与认知水平之间的关联。研究者发现,与CSVD评分0分的受试者相比,CSVD评分3分者的认知衰老加速9.3年;但在CSVD负担重(评分3分)的患者中,网络节点度值每增加1个标准差,可以降低认知衰老程度7年。
综上所述,大脑结构连接组的节点度值与认知功能呈正相关,并可影响脑损伤(包括脑萎缩和血管性损害)与认知功能之间的负性关联。该研究结果支持“认知储备”假说,表明大脑结构网络连通性与认知弹性相关,是研究神经储备结构组成的有效生物标志物。
10 通则不痛:急性缺血性卒中无效再通的微循环障碍机制
血管内治疗是大血管闭塞性急性缺血性卒中的有效治疗方法。然而,临床上在血管内治疗获得成功再通的患者中,仍有近一半预后不佳(即无效再通)[49]。血管再通后微循环障碍是无效再通的重要原因。缺血半暗带区各级血管段对缺血及再通的反应性可能不同,不同血管段的异常反应可能是再通后微循环障碍的重要机制。然而,目前尚无针对缺血再通后各级脑血管反应性的系统性研究。在此背景下,首都医科大学附属北京天坛医院王伊龙教授团队[50]通过双光子活体成像结合荧光报告转基因小鼠,系统性观察了急性缺血性卒中再通后缺血半暗带区各级血管的血流动力学变化,探究再通后微循环障碍的机制。
该研究首先利用特异性标记血管平滑肌细胞/周细胞的转基因小鼠,绘制了皮质脑血管网络的等级分布图(图19)。该研究发现急性缺血性卒中再通后半暗带区软脑膜动脉和穿支动脉显著收缩,软脑膜动脉血流显著下降,穿支动脉血流代偿性恢复;微静脉和软脑膜静脉管壁塌陷,血流量显著下降;毛细血管前微动脉和后微静脉显著收缩,血流速度下降,血流量下降;毛细血管广泛性收缩,血流速度下降,血流量下降。无论是周细胞胞体覆盖区域,还是单纯由周细胞足突覆盖的毛细血管,都出现显著收缩,且这两个部位的收缩程度差异无统计学意义(图20)。

图19 皮质脑血管网络不同层次与分级
该研究结果证实急性缺血性卒中再通后各级血管存在血流动力学异常,尤其是毛细血管前微动脉、后微静脉的显著收缩,可能是导致再通后微循环障碍的重要机制。该研究在清醒小鼠中未能观察到周细胞收缩与毛细血管无复流的直接关系,后期需要进一步结合周细胞敲除/药物干预方法,探究周细胞收缩在急性缺血性卒中再通后无复流中的作用及机制。
回眸2022,CSVD相关研究取得的各种进展,我们见证了两个重要规范的敲定、一系列临床试验的结果、相关免疫代谢研究的突破、潜在血管的新靶点的发现、长期预后研究的提出、血栓炎症机制的探索等等,我们将在新的一年,带着过去一年的成果,迎接新的挑战,也希望能有更多的中国CSVD临床研究走向世界舞台。
本文列举的各项研究的作者为该研究团队主要研究者而非对应参考文献的第一作者。

附录:本文涉及研究的缩写及中文全称
