外源γ-氨基丁酸通过调节肠道菌群改善神经系统疾病研究进展
2023-03-12扬子彪赵世伟徐秋怡
何 维,宋 贺,扬子彪,赵世伟,徐秋怡,姜 燕,
(1.大理大学公共卫生学院,云南大理 671000;
2.云南皇氏来思尔乳业有限公司,云南大理 671000)
γ-氨基丁酸(γ-aminobotyric acid,GABA)是自然界中广泛存在的一种非蛋白质氨基酸,在人和其他哺乳动物体内,以大脑区域的浓度最高,是目前发现最主要的抑制性神经递质,具有多种功能[1];此外,它还存在于发芽糙米、泡菜、酸奶等食品中。GABA作为哺乳动物神经系统中的抑制剂而存在,对神经元的兴奋程度有着重要的影响。
最新研究表明,GABA可以进入下丘脑周围区域等缺乏血脑屏障的大脑外周神经系统,抑制交感神经系统的兴奋性,并影响NO的代谢,从而改善焦虑行为[2]。GABA还可以通过介导NF-κB以及PI3-K/Akt信号通路抑制β细胞凋亡,缓解由于β细胞凋亡所致Ⅱ型糖尿病[3]。此外,GABA可以作为炎症抑制剂发挥作用以治疗免疫性疾病[4]。近年来发现,GABA还具有抗癌[5]、改善脑血栓[6]、治疗舞蹈症和精神分裂症[7]等功能。虽然GABA有上述多种功能,但其在人体中的含量随年龄增加而减少,因此在日常生活中补充GABA以改善机体健康具有重要意义[8]。
外源GABA不能透过血脑屏障以增加脑内GABA的含量,但有研究认为其可通过改善肠道微环境对机体发挥作用。本文主要从GABA与肠道菌群的关系、外源GABA对神经系统疾病的影响及其制备三方面阐述外源性GABA通过肠道微环境对神经系统疾病的改善作用及可能的作用机制,以期为GABA对神经系统疾病后续的相关研究提供借鉴,并为该领域提供有价值的研究方向。
1 外源GABA的制备方法
目前GABA制备的方法有化学合成法、植物富集法以及微生物法等[8]。其中,化学合成法是应用2-吡咯烷酮、γ-丁内酯、氯化亚砜等物质经化学反应生成GABA[9],其生产速度快、产量高,但所用原材料对人体有害[10],使得由该方法制得的GABA使用范围存在局限性,不能用于食品、药品等方面,该方法正在逐步被取代[11]。植物富集法是对食品加工原料进行处理以富集GABA[12],该方法虽安全可靠、操作简单,但产率低且分离和提取较难[13],处理周期较长,不能满足市场的需求[14]。
微生物发酵法是目前生产GABA最安全且常用的方法,它是利用酵母菌、益生菌等具有谷氨酸脱羧酶(glutamic acid decarboxylase, GAD)活性的微生物发酵制得,经该法制得的GABA含量高,且成本相对较低[15]。目前已证实包括细菌、真菌在内的多种微生物均可合成GABA,其中乳酸菌被认为是安全且最具潜力并已被广泛应用于食品工业中的微生物[16]。目前我国卫健委批准短乳杆菌和希氏乳杆菌发酵制备的GABA可以作为新食品原料应用于饮料、可可制品、巧克力和巧克力制品、糖果、焙烤食品、膨化食品,但不包括婴幼儿食品[17]。
Cataldo等[18]用短乳杆菌CRL 2013生产GABA,在最佳条件下其产量达到265 mmol/L;Harnentis等[19]应用来自于发酵水牛奶的植物乳杆菌N5生产GABA,对其发酵条件进行优化,在pH为5.5、36 ℃、谷氨酸浓度500 mmol/L的条件下以葡萄糖和蛋白胨作为碳源和氮源培养84 h,GABA产量达到211.169 mmol/L;张言慧等[17]优化了短乳杆菌GLB-127的发酵及转化条件,该菌株产GABA量及GAD活力均显著提高。为获得具有高产GABA潜力的菌株,孙世鑫等[20]以国内售卖的发酵食品为原料进行分离培养,经初筛、复筛得到乳酸乳球菌菌株,同时该课题组以该菌株为发酵剂、脱脂复原乳液为主要原料,优化其发酵条件使酸奶中GABA含量由(3.782±0.679)mmol/L提升至(9.988±0.291)mmol/L;并在最佳优化条件下将乳酸乳球菌乳酸亚种菌种与干酪乳杆菌进行双菌混合发酵,使酸奶中的GABA含量达到(39.760±0.970)mmol/L,较单菌种发酵提升3.78倍,且其各项指标均符合国家标准[21],表明在确保酸奶或其他发酵食品口感和营养的前提下,可经工艺优化增加发酵食品中的GABA含量。
随着年龄的增加,人体需要从外界获取GABA以满足机体的需要,所以目前对如何应用安全可靠的制备方式获得足以满足市场需求的GABA仍在进一步的研究中。微生物发酵法与其他方式相比具有竞争优势[22]。但是目前仍需提高微生物发酵法制备GABA的产量,并且其产量与GAD的活性和稳定性、生产系统的组成和条件均有关[23]。因此,开发更多可用于食品及医疗行业安全的可高效生产GABA的菌株、研究提高微生物制备GABA产量的工程策略等都将会是该领域有价值的研究方向,可以进一步提高微生物发酵法制备GABA的竞争力。
2 GABA和肠道菌群之间的关系
肠道微生物影响许多重要的宿主功能,包括免疫反应、内分泌系统、神经系统等[24]。GABA作为中枢神经系统的主要抑制性神经递质,多年来一直被认为在大脑中合成,但是近年研究发现在哺乳动物的肠道中同样可以产生GABA,并通过机体的其他系统进行调节而发挥作用[25]。GABA通过对肠道菌群的调节,发挥维持机体胃肠健康的功能,同时,调节微生物群可能会改变肠道内GABA水平[26],以无菌小鼠作为实验动物,将其分为无菌小鼠及移植正常菌群的无菌小鼠,发现无菌小鼠粪便和血液中GABA含量与移植正常菌群小鼠相比显著降低[27]。由此表明,小鼠的肠道不仅可以产生GABA,同时肠道微环境还可以影响其产量。
人类肠道菌群可能通过代谢产物与宿主大脑相互作用,二者之间存在信息交换,并在神经精神障碍的发病机制中发挥关键作用。近年来,肠道微生物在“脑-肠”双向交流机制中的作用不断强化,促成了“微生物-肠-脑轴(Microbiota-Gut-Brain Axis,MGBA)”这一概念的提出[28]。因此认为GABA对神经系统的影响是间接的,它是通过对肠道菌群的影响所介导的,也就是与MGBA这个概念有关,如图1所示。现有研究表明GABA可以有效改善肠道微环境,提高脑中GABA和5-羟色胺水平,调节大脑中枢神经系统功能[25]。肠道微环境产生的如单胺、谷氨酸等物质可以通过淋巴或循环系统与神经系统或大脑中的化学物质相互作用,影响大脑的发育成熟,影响人体的认知功能[29]。但肠道菌群与大脑的关系是复杂的,目前二者关系的研究与应用仍处于初步阶段,其相关机制有待进一步研究,将为治疗和诊断神经性疾病提供新的靶点。
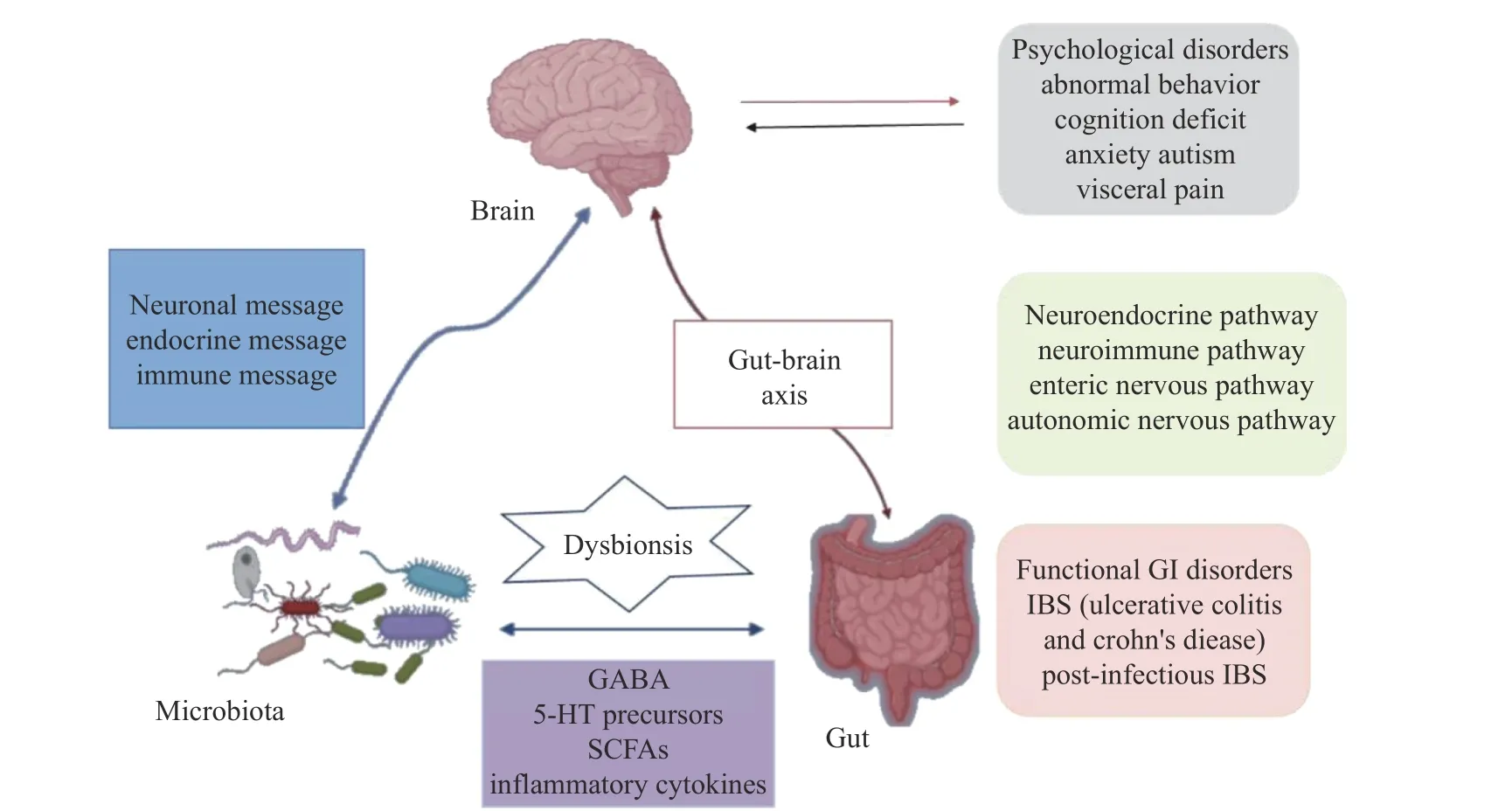
图1 肠道微生物通过肠-脑轴与大脑通信[30]Fig.1 Gut microbiota communicates with the brain via the brain-gut axis[30]
3 外源GABA通过调节肠道菌群改善神经系统疾病
神经系统疾病与大脑或神经系统的部分功能障碍有关,包括失眠、抑郁、阿尔兹海默症、癫痫等一系列病症。目前对于神经系统疾病通常采用药物治疗,但其副作用不容忽视,急需寻找新的靶点和治疗药物来改善现状。GABA在神经系统中发挥着重要的作用,其可以抑制神经退行性变化,改善大脑的记忆和认知功能[31]。GABA已被证实具有良好的改善机体神经系统的功能,尽管外源GABA并不能通过血脑屏障,但随着MGBA概念的提出,越来越多的研究表明其可通过影响肠道菌群间接改善神经系统疾病。研究显示通过饮食进行辅助治疗可以控制神经系统疾病的发展,同时可以减少药物副作用[32]。日本1996年已生产出面向消费者的富含GABA的食品,随着近年来的开发,已出现以GABA为主要成分的药物用于改善神经功能[14]。目前我国对于富含GABA功能性食品的研究越来越多。
3.1 外源GABA对失眠的改善作用
失眠是一种常见的睡眠障碍,已成为现代社会的健康问题,影响人们的生活质量、情绪和认知等。目前苯二氮卓类和非苯二氮卓类为治疗失眠的临床常用药物,但易产生耐受性和依赖性[33]。
现有研究表明GABA可能参与睡眠-觉醒机制[34]。研究显示口服GABA可缩短睡眠潜伏期,同时其在机体内迅速吸收代谢,血药浓度在30 min时最高,随后下降,且其血液中的GABA含量与服用前相比有所升高[35],表明GABA影响睡眠的早期阶段且该影响可能与其在血液中的水平有关,但其作用机制并未阐明。Hong等[36]以果蝇失眠模型研究GABA对无脊椎动物睡眠的影响,发现其可调节果蝇夜间活动、睡眠次数和夜间睡眠总时间,失眠果蝇活动与GABA用量呈现出明显的剂量依赖性,同时,其可调节无脊椎动物机体的GABA能信号传导并增加脑内GABA水平。随后,该课题组进一步研究GABA对脊椎动物的促睡眠作用,以小鼠为实验动物进行注射戊巴比妥钠的亚催眠实验,摄入60 mg/kg GABA的小鼠入睡率为66%;同时,GABA的摄入缩短了睡眠潜伏期、延长睡眠时间并降低苏醒时间,提示GABA可显著提高睡眠质量,在进一步的转录组学实验中,表明其有可能通过GABAA受体来调节睡眠质量[37]。以富含GABA酸奶作为干预物,发现含80 mg/kg GABA的酸奶可以有效改善小鼠的睡眠状态,并增加脑组织中甘氨酸(Glycine, Gly)和GABA含量,证明GABA确有促进睡眠的作用,且该作用可能与脑组织中抑制性神经递质Gly和GABA的增加有关[38]。Yu等[39]为验证GABA对睡眠的影响及可能机制,筛选出短乳杆菌DL1-11为GABA高产菌株并以6×107CFU/mL接种于脱脂牛奶中进行发酵,测定发酵乳中GABA产量为(8.156±0.260) mmol/L,以该发酵乳为干预物,发现高剂量发酵乳干预的小鼠与中、低剂量组小鼠的肠道微生物组成显著不同,提示一定浓度的GABA可以调节肠道内微环境,改变小鼠肠道的β多样性、菌群的相对丰度。此外,注射戊巴比妥钠评价小鼠的睡眠潜伏期和睡眠时间,结果发现随着GABA浓度的升高,小鼠的睡眠潜伏期逐渐缩短,同时延长睡眠时间,该影响仅在应用高剂量GABA发酵乳干预的小鼠中存在显著效果,表明GABA发酵乳可以改善小鼠的睡眠,并且其机制可能与GABA剂量及其对肠道微环境的影响有关。由此可见,外源摄入GABA后可改善睡眠质量,该作用与摄入GABA量呈现一定的剂量依赖性,可能与其在机体中含量的增加相关。
为验证GABA与睡眠的真实关系,Hepsomali等[40]回顾截至2020年2月发表的口服GABA与压力及睡眠关系的研究,排除动物试验及不符合纳入标准的研究,发现至少持续一周使用生物合成的GABA(100~300 mg)的患者的主观睡眠有所改善;持续使用1~8周可以改善早期的睡眠状态,同时推测继续以该剂量使用1~4周可以缩短睡眠潜伏期。但由于受试者和已发表文章数量的限制,使得该数据不足以证明外源GABA对人体睡眠的效果。因此,亟需开展更多关于GABA及其相关产品的临床研究,以确定其对机体的真实功效。
3.2 外源GABA对抑郁症的作用
抑郁症(major depressive disorder,MDD)是一种以显著且持久的心境低落为特征的一类神经系统疾病,是常见的心境障碍疾病[41]。该病发病机制复杂,目前尚未完全阐明。由于其高发病率和高致死率,该病的治疗、缓解和预防是急需解决的一个全球性的公共卫生问题。临床上以氟西汀、西酞普兰等为主要治疗药物,但该类药物存在疗效延迟期和毒副作用[42]。
在抑郁细胞实验中,应用GABA平均产量为2.764 mmol/L的双歧杆菌98,对皮质酮(CORT)刺激诱导的抑郁细胞进行干预,发现其可缓解CORT诱导的细胞损伤[43]。陈青峰等[44]检测淡豆豉炮制不同阶段的GABA含量,其中淡豆豉炮制再闷第6 d(Z6)GABA含量为53.908 mmol/L,再闷第15 d(Z15)GABA含量为81.575 mmol/L;将炮制过程中各阶段淡豆豉以不同剂量应用于慢性温和不可预知性(chronic unpredictable mild stress, CUMS)抑郁模型,观察不同组别小鼠的行为学指标,结果显示Z6组及Z15的中、高剂量组小鼠的抑郁样行为均有不同程度的改善。其中,不含GABA的淡豆豉及Z15阶段低剂量的淡豆豉对CUMS小鼠的抑郁行为无改善作用,表明含GABA的淡豆豉可以改善CUMS模型小鼠的抑郁样行为,其改善作用与GABA含量有关,但其相关机制和治疗靶点并不明确。周月等[45]建立CUMS大鼠抑郁模型,利用茶氨酸联合GABA进行干预,进一步观察其行为学指标并检测相关生化指标,高剂量组小鼠的相关行为学指标及抑郁相关的生化指标5-HT、DA、IL-6、BDNF、β-内啡肽均有明显改善,其效果与常用抗抑郁药西酞普兰无显著性差异。同时这也进一步说明了GABA对MDD的改善作用与其含量相关,以高剂量的作用最为显著,这一研究与陈青峰等的研究结果有相似之处。Di等[46]建立卒中后抑郁(PSD)小鼠模型,以腹腔注射方式对小鼠进行干预,发现以高剂量GABA绿茶对小鼠抑郁样行为的改善作用最为明显。由于茶经口进入人体,因此该课题组进一步研究口服GABA茶对PSD小鼠的作用,得到相似结果[47],证明其通过口服方式进入体内后仍可改善抑郁样行为,并在体内发挥抗氧化作用,改善小鼠脑内与氧化应激相关酶的含量。表明含GABA茶对PSD具有积极作用,且其作用与包括GABA在内的活性成分协同作用有关,但由于考虑到GABA影响神经系统的方式,该课题组对于其中GABA的影响并未给出明确的结论。由于GABA可以通过肠道菌群间接影响神经系统,因此在该研究基础上可基于MGBA对其影响深入研究。综上所述,目前的机制研究主要集中于氧化应激、中枢神经系统、相关生长因子等方面,GABA对MDD的治疗靶点仍需进一步研究。
抑郁症是应激、免疫失调和肠道菌群紊乱的产物,强调了MGBA概念在MDD中的重要性[48]。在慢性应激抑郁模型中,发现压力可以破坏肠道与大脑间色氨酸的传递和代谢,影响肠道微环境乃至破坏中枢系统的活动和功能,二者共同促进抑郁症的发生[49]。通过对肠道微环境的调节,可以改善神经递质活性,对中枢神经系统进行治疗,使抑郁样减轻[50]。屈婉等[51]应用双歧杆菌BB-12及植物乳杆菌P-8灌胃CUMS抑郁模型小鼠,结果显示二者均可以缓解抑郁相关症状及肠道功能紊乱,由于双歧杆菌及植物乳杆菌均可以发酵生成大量GABA,表明高产GABA益生菌可以缓解抑郁样症状,并且可能与对肠道菌群的调节有关,由此表明肠道微环境在MDD的发生发展中呈现出重要作用,但基于MGBA的治疗仍处于初步探索阶段,其因果关系有待深入研究;并且是否所有益生菌对于MDD的改善均具有一定作用、可高产GABA益生菌与GABA之间是否存在协同作用仍需进一步研究。
3.3 外源GABA对阿尔兹海默症的作用
阿尔兹海默症病(Alzheimer’s disease,AD)是老年人群中常见的一种神经系统疾病,老年人出现神经退化,导致行为或认知障碍[52]。临床常用的治疗药物虽可以减缓疾病的症状,但不延缓或阻止AD的发展[53]。AD患者的大脑神经元功能减退,其机体神经肌肉的完整性和身体功能通常受到损害,因此无论是刺激神经生长因子还是血清脑源性营养因子(brainderived neurotrophic factor, BDNF)增加,都可以保护老年人身体功能[54]。如表1所示,Choi等[55]制备发酵海带(fermented sea tangle, FST),使其GABA平均含量为528.510±0.689 mmol/L,并将其作用于53~63岁女性,进行持续8周的临床试验,证实FST可以有效提高血清BDNF以及生长相关因子、人类生长激素和胰岛素样生长因子水平。随后为研究FST是否可以被认为是一种可行有效的GABA补充剂,该课题组选入60名老年受试者进行临床实验,分析FST对老年人短期工作记忆的影响,发现连续6周每天服用FST的老年人神经元活性及神经心理功能明显改善;并证实FST可有效抗氧化,增强机体对氧化应激的防御能力,对DNA结构的完整性有保护作用[56]。该结果证实FST可以有效保护老年人的短期记忆,减缓身体功能的老化、退化,可以认为GABA对AD病人的认知障碍具有一定的治疗及保护作用。同时,该科研团队进一步通过行为学试验研究FST对东莨菪碱(Scopolamine, Sco)和乙醇(ethanol, Etoh)诱导的海马依赖性记忆障碍的影响[57],判断FST对小鼠短期记忆障碍的影响,发现FST更大程度地改善Etoh诱导的模型小鼠的短期记忆;同时,FST的治疗显著促进了海马区与记忆有关的p-CREB蛋白表达,该结果表明FST可以有效改善短期记忆损伤并提高空间记忆能力和学习能力,可以认为GABA能改善东莨菪碱和乙醇诱导的AD模型小鼠的认知障碍和神经可塑性障碍。但目前的研究更多限于通过刺激相关生长因子或增加血清BDNF以保证AD患者神经肌肉的完整性和功能,其更多的治疗靶点仍不确定。

表1 富含GABA发酵海带(FST)对阿尔兹海默症的作用Table 1 Effects of GABA - enriched fermented sea tangle (FST) on Alzheimer's disease
长期以来AD的病理学假说认为其是一类单纯的额脑部神经系统疾病,病因基于神经炎症、突触消失等神经退行性机制,与身体的其他器官和功能并不相关。但随着研究的深入,发现AD患者粪便微生物的多样性降低,肠道微生物中的肠杆菌科与AD患者关系密切,证实肠道微生态失调是AD发生的危险因素[58]。肠道菌群可能通过多种途径促进AD的发生[59],是淀粉样蛋白、LPS、小胶质细胞和其他毒素的来源,可导致炎症及生理屏障的破坏并增加神经毒性,诱发AD[60],因此通过益生菌调节肠道微环境可能是治疗AD的潜在手段[61],但目前对于GABA通过调节肠道菌群改善AD患者的认知功能还没有更深入的研究。鉴于双歧杆菌、植物乳杆菌等益生菌均可以发酵生成大量GABA,对于其可能对AD产生的治疗效果仍需进一步研究。
3.4 外源GABA对癫痫的改善作用
癫痫是常见的多因素导致的脑部疾病之一,其特征为无诱因的自发性癫痫发作[62],目前主要应用药物或手术进行治疗[63−64]。其发病机制复杂,还需要通过进一步的基础及临床研究确定其治疗靶点,以提供更有效的综合治疗方案。
许多研究表明大脑中GABA浓度降低会引发癫痫[65],对目前治疗癫痫的药物进行总结和分析,发现加巴喷丁、氨己烯酸等GABA类似物,在癫痫的治疗中具有重要作用,可有效治疗儿童痉挛,已有部分药物作为临床一线药物进行使用[66],证实GABA或加巴喷丁等类似物可以作为GABA补充剂应用于临床,从而减轻严重程度的癫痫发作[67]。Hou等[68]通过研究GABA对体内和体外神经元细胞损伤的机制,发现其可以降低癫痫发作的严重程度,降低癫痫小鼠脑组织的细胞凋亡,保护神经元细胞,且在体外细胞实验中呈现出相似结果,其神经保护作用与改善癫痫状态下的氧化应激有关。GABA对儿童、青少年及轻症癫痫患者治疗效果显著,目前一线癫痫药物结合GABA进行治疗,可减少抗癫痫药用量,降低副作用。
研究发现,癫痫患者常伴有胃肠道症状,同时肠道炎症可使癫痫发作的易感性增加[69]。抗癫痫生酮饮食被用作不适合手术的耐药性癫痫患者的非药物治疗,它可以调节肠道微生物的物种丰富度和多样性[70]。由于GABA可以通过改善肠道菌群间接影响神经系统,因此其是否可以由此改善癫痫症状可作进一步研究。Bagheri等[71]为研究乳酸菌对癫痫发作的影响,应用含鼠李糖乳杆菌、罗伊氏乳杆菌和比菲德氏菌的乳酸菌作为乳酸菌补充剂进行实验,表明乳酸菌降低了癫痫发作的严重程度;显著提高了大鼠的总抗氧化能力和脑内GABA浓度。由于鼠李糖乳杆菌等益生菌可以产GABA,可以认为乳酸菌治疗合理地增加了GABA活性,改善了癫痫大鼠的抗氧化剂/氧化剂平衡。但目前对于GABA通过肠道菌群以改善癫痫患者症状的研究较少,由于目前以微生物发酵法制备GABA最为安全常用,且其可以调节肠道微环境,因此在益生菌改善癫痫症状的基础上可以对其发酵产物GABA对癫痫的治疗效果及机制进行进一步的研究。
4 结论
GABA是一种重要的非营养物质,在动植物中广泛存在,对人体健康具有潜在作用,微生物发酵法是制备GABA的有效方法。GABA作为抑制性神经递质,对多种疾病具有治疗和改善作用,其已被证实对肠道微环境和神经系统疾病具有良好的改善作用,且对神经系统的改善作用与其大脑中GABA浓度的增加密不可分,该现象可能是通过多途径的作用协同产生。许多研究都证实了肠道微生物与大脑神经系统之间双向的联系,由于GABA难以透过血脑屏障,随着“微生物-肠-脑轴”概念的提出和该领域研究的进展,发现GABA可通过肠-脑轴影响情绪、行为及认知功能[72],为其对神经系统疾病的治疗及改善提供了新的研究靶点,但目前的研究仍基于单纯的肠道菌群的变化或通过GABA能系统对大脑中GABA含量的调节,仍未进一步将二者联系起来,因而在未来研究中,可就机体中GABA浓度的增加及肠道菌群的变化与改善神经系统疾病之间的关系进一步研究。
随着对GABA生理功能的不断深入研究,以GABA功效为基础研发的功能食品被认为能够预防或改善某些慢性疾病,成为极具发展前景的未来健康食品原料并已被广泛应用于食品行业,已研制出富含GABA的功能性燕麦、酸奶等食品,但其市场规模和研究进展与国外尚有差距,并且对于服用GABA的安全性和有效性仍需进一步观察和测试,因此在临床试验中的进一步验证是十分必要的。未来肠道微生物对神经及精神性疾病潜在治疗靶点以及GABA在食品或药物的开发应用将是研究的重点。
