沙棘花青素提取物对双氧水诱导的H1299细胞损伤的保护作用及Nrf2/HO-1通路的影响
2023-03-12郑玉荣李宝国
郑玉荣,陈 龙,王 晓,李 军 ,李宝国
(1.山东中医药大学,山东济南 250355;2.齐鲁工业大学(山东省科学院)山东省分析测试中心,山东济南 250014)
沙棘为胡颓子科沙棘属沙棘Hippophae rhamnoidesL.的干燥成熟果实,2020版《中国药典》记载其具有健脾消食、止咳祛痰、活血散瘀的作用[1]。沙棘中含有多种活性成分,包括黄酮类、萜类、甾醇类、挥发油类、多糖类等成分,另外还含有丰富的维生素、氨基酸和微量元素,在食品和医疗保健领域应用较为广泛[2]。药理学研究表明,沙棘具有抗炎[3]、抗氧化[4−6]、抗肿瘤[7−8]、抗衰老[9]、保肝[10]、抑菌[11]等作用。大量文献显示沙棘果实中含有较多的原花青素,其主要由不同数量的儿茶素和表儿茶素结合而成,含量可达90%以上[12−14]。沙棘原花青素不仅具有较强的抗氧化作用,还具有保护心血管、抗衰老和抗溃疡的作用[15−17]。
目前原花青素因具有多种药理活性,而被应用于多种疾病的治疗中[18]。研究表明,原花青素可以显著降低肾病小鼠的组织氧化损伤[19]。此外,有研究人员通过构建百草枯诱导的肺部纤维化损伤模型,研究了花青素对肺部纤维化损伤的影响,结果表明花青素能够降低肺部纤维化损伤,其作用机制可能与抑制上皮间充质转变有关[20],并且有研究表明,沙棘提取物可以通过提高抗氧化酶活性,减少脂质过氧化物的产生,从而降低小鼠肺组织氧化损伤[21]。上述研究均表明,花青素对于机体内肺组织氧化损伤具有良好的保护作用,然而其作用机制仍有待研究。因此,本研究利用过氧化氢诱导的人非小细胞肺癌H1299细胞氧化损伤模型,研究HRAE对H1299细胞氧化损伤的保护作用,并探讨沙棘花青素提取物对肺组织氧化损伤保护的作用机制。
1 材料与方法
1.1 材料与仪器
沙棘药材 亳州市华云中药饮片有限公司,经山东中医药大学李宝国教授鉴定符合2020版中国药典规定;H1299人非小细胞肺癌细胞株 上海中乔新舟生物科技有限公司;青链霉素、二甲基亚砜、双色预染蛋白Marker、胰蛋白酶-EDTA消化液(胰蛋白酶0.25%,EDTA 0.53 mmoL) 北京索莱宝生物技术有限公司;DMEM/High Glucose 武汉赛维尔生物科技有限公司;RIPA裂解液、BCA蛋白测定试剂盒、丙二醛试剂盒、谷胱甘肽试剂盒、活性氧检测试剂盒、SDS-PAGE凝胶试剂盒 碧云天生物技术有限公司;四季青胎牛血清 浙江天杭生物科技股份有限公司;β-actin抗体、Nrf2抗体、HO-1抗体、SOD1抗体、NQO1抗体、KEAP抗体、PPARγ抗体、P44/42 MAPK抗体 美国CST公司;正丁醇、无水乙醇、盐酸 天津市科密欧化学试剂有限公司;硫酸铁铵(0.5%)、原花青素标准品 阿拉丁。
HF90二氧化碳培养箱 上海力升科学仪器;Eclipse Ts2倒置显微镜 日本Nikon公司;HFsafe-1200LC生物安全柜 上海力升科学仪器有限公司;ChemiScope 6000 Touch一体式化学发光成像系统上海勤翔科学仪器有限公司;Spark多功能酶标仪瑞士Tecan公司;湘仪离心机 湖南湘仪实验室仪器开发有限公司;PowerPac300型电泳仪、170-3930型转膜仪 美国BIO-RAD公司。
1.2 实验方法
1.2.1 HRAE的提取及纯度测定 参照NY/T 2640-2014《植物源性食品中花青素的测定 高效液相色谱法》的提取方法,提取沙棘中花青素,具体过程如下:干燥的沙棘果用高速粉粹机粉碎后,过四号筛,备用;精密称取沙棘果样品约1.0 g于50 mL容量瓶中,加入体积比为2:1:1的无水乙醇、水、盐酸混合液至刻度线,超声处理(36 ℃,240 Hz)30 min,在10000 r·min−1的转速下离心10 min,取上清液浓缩,冻干得HREA固体粉末。参照文献[22]方法并加以改进,对沙棘花青素提取物的纯度进行测定,以原花青素含量计。
沙棘花青素提取物原花青素含量[22]:精密称定原花青素标准品10 mg于10 mL容量瓶中,加甲醇溶解并定容至刻度,得浓度为1.0 mg.mL−1的标准储备液。分别精密量取原花青素储备液0.00、0.10、0.25、0.50、1.00、1.50、2.00、2.50 mL于10 mL容量瓶中,加甲醇至刻度,摇匀。然后在各浓度梯度中取1 mL于具塞锥形瓶中,分别加入6 mL盐酸-正丁醇溶液(5:95),再分别加入0.2 mL硫酸铁铵溶液,沸水加热40 min,立即置于冷水中冷却15 min,在波长546 nm下检测,制作标准曲线。
供试品溶液:精密称取冻干后HREA固体粉末10 mg于10 mL容量瓶中,加甲醇至刻度,摇匀,备用。取1 mL用甲醇稀释10 mL,然后取1 mL稀释液按标准曲线制作方法操作,以相应试剂为空白,重复测定两次。计算公式:
式中:W表示试样中原花青素含量,%;c表示混合物中原花青素浓度,μg·mL−1;V表示待测样品总体积,mL;V1表示样液反应体积,mL;V2表示样液反应后体积,mL;m表示试样所代表的沙棘花青素提取物质量,mg。
1.2.2 细胞培养 取冻存的H1299细胞,37 ℃水浴快速融化后置于15 mL离心管中,1500 r·min−1,离心5 min;弃去上清液,将H1299细胞置于含10%胎牛血清和1%青链霉素的DMEM培养液中,放入37 ℃、5% CO2培养箱中培养。待细胞长满80%后进行传代培养。
1.2.3 H1299细胞氧化损伤模型的建立 取对数生长期的H1299细胞,以每毫升1×105个细胞密度,每孔100 μL接种于96孔培养板中,培养24 h后,弃去上清,分别加入100 μL不同浓度的双氧水溶液(800、400、200、100 μmol·L−1),继续培养4 h后,分别加入MTT溶液(1 μg·mL−1)50 μL,继续培养4 h后在490 nm下检测各孔吸光度,计算细胞活力,计算公式:
式中:A加药表示药物组溶液的孔的OD值;A0加药表示空白组溶液的孔的OD值;A空白表示没有细胞的孔的OD值。
1.2.4 HREA对细胞活力的影响 取对数生长期的H1299细胞,以每毫升1×105个的细胞密度,每孔100 μL 接种于96孔培养板中培养24 h后,弃去上清,分别加入100 μL不同浓度的HREA溶液(50、100、200、400、800 μg·mL−1),每组6个复孔,继续培养24 h后加入MTT溶液(1 μg·mL−1)50 μL,培养4 h后在490 nm检测各孔吸光度,计算细胞活力(计算公式同1.2.3)。
1.2.5 HREA对H2O2损伤H1299细胞活力的影响取对数生长期的H1299细胞,以每毫升1×105个密度将细胞接种于96孔板,培养24 h后,加入100 μL用含5%胎牛血清的DMEM培养液稀释的质量浓度为50、100、200 μg·mL−1的沙棘原花青素,每个浓度重复6孔,对照组只加含5%胎牛血清的DMEM培养液,继续培养24 h后,每孔加入含过氧化氢的基础培养基100 μL,使终浓度为200 μmol·L−1,空白组加入100 μL的DMEM培养液,培养4 h后,每孔加入50 μL的MTT溶液培养4 h,弃去上清液后每孔加入100 μL二甲基亚砜,在吸光度490 nm下进行检测,计算细胞活力(计算公式同1.2.3)。
1.2.6 HREA对细胞内MDA含量及SOD、GSH-Px、CAT 活力的测定 取对数生长期细胞,胰酶消化后按照每孔1×105的密度接种在6孔板中,培养24 h后,分别配制沙棘花青素提取物低(50 μg·mL−1)、中(100 μg·mL−1)、高(200 μg·mL−1)三个剂量,继续培养24 h后,除空白组外均加入200 μmol·L−1的双氧水溶液,继续培养4 h后,分别吸取细胞上清液,检测MDA含量。另外,每孔加入1 mL预冷的PBS缓冲液,利用细胞刮刀刮取细胞,使细胞悬浮,然后在4 ℃,11000 r·min−1条件下离心10 min,弃去上清,每孔加入60 μL RIPA裂解液,用RIPA裂解液裂解0.5 h后,相同条件下进行离心,离心后取上清液,分别按照试剂盒的说明书,检测SOD、GSH-Px及CAT的活力。
1.2.7 HREA对细胞内活性氧的影响 按照1.2.6上述分组进行种板及给药,加入双氧水4 h后弃去上清液,按照活性氧试剂盒说明书,用2',7'-二氯荧光黄双乙酸盐(2,7-dichlorodihydrofluorescein diacetate,DCFH-DA)荧光探针法检测细胞内ROS的含量,荧光显微镜下拍照。活性氧阳性对照Rosup是一种活性氧阳性诱导药物,浓度为50 mg.mL−1,根据其荧光信号强度,可分析活性氧的实际水平。
1.2.8 Western Blot 按照1.2.6上述分组进行种板及给药,加入双氧水4 h后弃去上清液,用预冷的PBS洗涤三次,加入60 μL的RIPA裂解液,裂解半小时后刮取细胞,11000 r·min−1离心15 min后,取上清液,采用蛋白定量测定试剂盒测定后加入Loading Buffer混合,煮沸5 min变性。取蛋白样品进行SDS-PAGE凝胶电泳,半干转至PVDF膜上,脱脂奶粉封闭1 h,洗膜,一抗封闭4 ℃过夜,TBST洗涤三次,37 ℃加入HRP标记的山羊抗兔IgG孵育1 h,显影,以β-Actin作为内参,分析各蛋白相对表达量。
1.2.9 沙棘花青素提取物关键药效成分与疾病相关靶点的分子对接 在TCMSP数据库(https://tcmspw.com/tcmsp.php)、PubChem数据库(https://pubchem.ncbi.nlm.nih.gov/)中检索表儿茶素和儿茶素的2D结构,存为mol2格式,导入Chemdraw 14.0软件中对各化合物分子进行能量最小化,并利用AutoDock Tools软件将其格式转换为pdbqt 后保存,作为配体备用。借助RCSB数据库(https://www.rcsb.org/)检索Nrf2(Q9Z2X8)靶点的蛋白序列,下载并保存,运用AutoDock 2.0软件对蛋白进行去水、加氢、添加原子电荷和设置原子类型,存为pdbqt格式,作为受体备用。最后,利用AutoDock 2.0软件对化合物与受体蛋白分别进行分子对接,并用Pymol软件将对接模式可视化,对各组间的结合能大小进行分析比较。一般认为,结合能<0 kJ·mol−1则配体与受体能够自由结合,并且结合能数值越小则结合能力越强,该活性成分为发挥药效的关键成分。在Discovery Studio中打开分子对接结果文件,设定参数,保存分析结果。
1.3 数据处理
实验数据采用Graphpad prism 5.0统计软件进行统计学分析作图,实验做3次重复,以均数±标准差表示,多组间比较采用单因素方差分析,以P<0.05为差异有统计学意义。
2 结果与分析
2.1 沙棘花青素含量测定结果
根据原花青素标准曲线测定法绘制标准曲线,用最小二乘法得到回归方程为y=0.0029x+0.1253,其决定系数R2=0.9948,沙棘花青素提取物中原花青素含量的平均值为8.71%。
2.2 双氧水诱导的H1299细胞损伤模型
由图1可知,与正常组相比,分别采用不同浓度的双氧水作用H1299细胞4 h后,细胞活力均出现不同程度的下降,在浓度达到200 μmol·L−1时,细胞活力在60%左右,出现极其显著的下降(P<0.001)。由于浓度在200 μmol·L−1时细胞活力保持在60%左右,因此后续试验选取200 μmol·L−1双氧水作用4 h,建立H1299细胞氧化损伤模型。
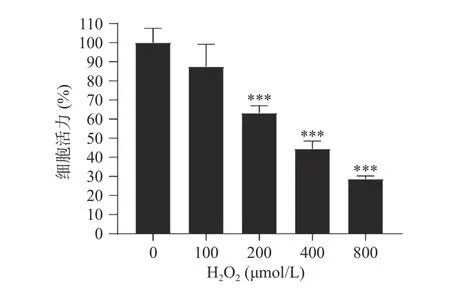
图1 双氧水对H1299细胞活力的影响Fig.1 Effect of hydrogen peroxide on H1299 cell viability
2.3 沙棘花青素提取物对H1299细胞活力的影响
由图2可知,不同浓度的沙棘花青素提取物对H1299细胞的活力具有不同的影响,与正常组相比,作用24 h后,在浓度达到200 μg·mL−1后,细胞活力呈现显著或极显著上升的趋势(P<0.05或P<0.01),表明沙棘花青素提取物对细胞无明显抑制作用。后续实验证明,浓度为200 μg·mL−1时,药效显著(P<0.05),因此后续实验选取50~200 μg·mL−1进行后续研究。
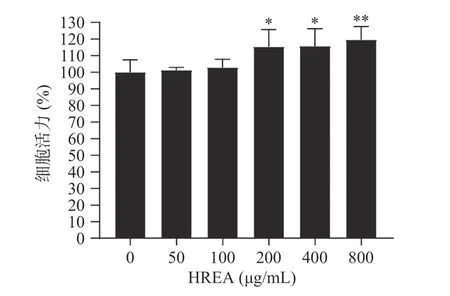
图2 沙棘花青素提取物对H1299细胞活力的影响Fig.2 Effect of anthocyanins from Sea-buckthorn on H1299 cell viability
2.4 HRAE对双氧水诱导的H1299细胞保护作用
由图3可知,与模型组相比,沙棘花青素提取物对细胞氧化损伤具有明显的保护作用,并且呈现剂量依赖性,浓度在200 μg·mL−1时的药效极显著(P<0.01),因此后续实验选取50~200 μg·mL−1。当浓度达到100~200 μg·mL−1时,沙棘花青素提取物对H1299细胞氧化损伤的保护作用表现出较为突出的水平(P<0.05或P<0.01)。
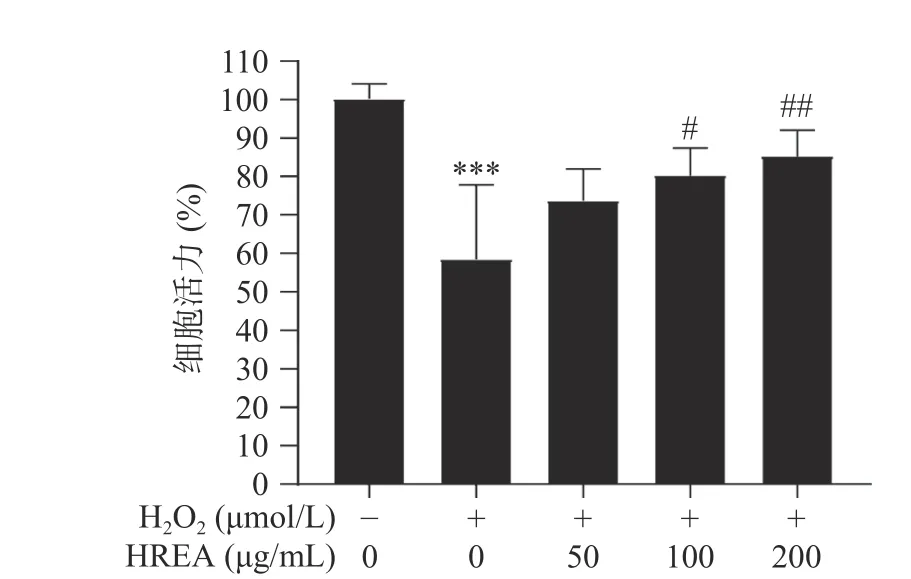
图3 HRAE对双氧水诱导的H1299细胞保护作用Fig.3 Protective effect of HRAE on H1299 cells induced by hydrogen peroxide
2.5 HRAE对H1299细胞内MDA、SOD、GSH-Px和CAT表达的影响
由图4可知,与正常组相比,模型组细胞MDA含量上升极其显著(P<0.001),SOD、GSH-Px和CAT活性显著降低(P<0.05或P<0.001);与模型组比较,HRAE低(50 μg·mL−1)、中(100 μg·mL−1)、高(200 μg·mL−1)剂量组H1299细胞内MDA含量出现极显著或极其显著(P<0.01或P<0.001)的下降,SOD、GSH-Px和CAT活性均有不同程度升高(P<0.05,P>0.05或P<0.01),这一结果表明沙棘花青素提取物能够降低细胞脂质过氧化损伤,并且能够改善双氧水对H1299细胞内SOD的抑制作用,提高受双氧水损伤的H1299细胞内SOD、GSH-Px和CAT活性,表现出较强的抗氧化活性。
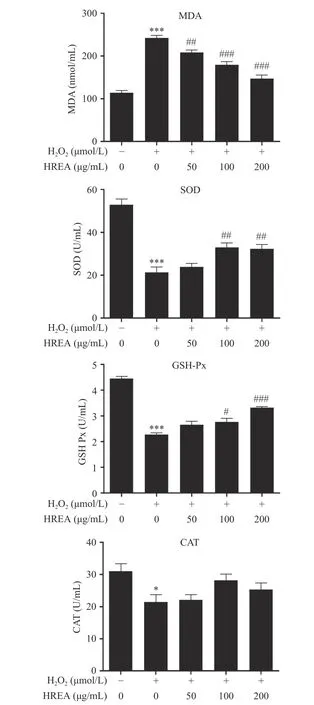
注:*表示与空白组对比差异显著(P<0.05);***表示与空白组对比差异极其显著(P<0.001);#表示与模型组对比差异显著(P<0.05);##表示与模型组对比差异极显著(P<0.01);###表示与模型组对比差异极其显著(P<0.001)。
2.6 HRAE对双氧水诱导的H1299细胞中ROS的影响
由图5可知,与正常组相比,模型组H1299细胞ROS含量会明显升高;与H2O2组比较,HRAE 50 μg·mL−1组、100 μg·mL−1组、200 μg·mL−1组H1299细胞内ROS明显下降,并且呈现一定的剂量依赖,ROS和脂质过氧化物MDA含量能够反映细胞内氧化应激的损伤程度,结合2.5中MDA的实验结果可以看出,沙棘花青素提取物能够明显降低双氧水诱导的细胞脂质过氧化损伤,并从而达到对细胞氧化损伤的保护作用。
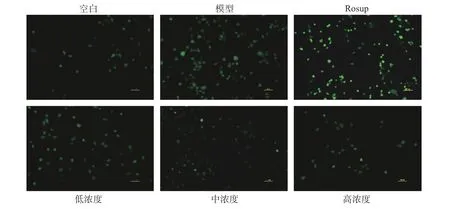
图5 HREA对H2O2诱导H1299细胞活性氧水平的影响(100×)Fig.5 Effect of HREA on ROS expressions in H2O2-exposed H1299 cells (100×)
2.7 Western Blot法检测氧化应激相关蛋白表达水平
为了探讨HRAE保护H1299细胞氧化损伤作用的机制,实验采用Western Blot法检测Nrf2、HO-1和KEAP1等蛋白的表达情况,见图6。给予双氧水损伤后,Nrf2、HO-1和KEAP1等蛋白的表达均呈现下降趋势,给予不同浓度的HRAE后,均呈一定的上升趋势。HO-1是Nrf2的下游基因,氧化应激状态下Nrf2被激活,入核后启动HO-1的转录表达,HO-1表达量增加从而催化降解血红素、一氧化碳等,抑制氧化应激损伤[23]。过氧化物酶体增殖子活化受体(PPARγ)与Nrf2启动子结合促进Nrf2表达[24],高浓度沙棘花青素可激活PPARγ,从而促进Nrf2表达。p44/42 MAPK参与细胞增值、凋亡的生长过程,并且其激活程度与Nrf2表达相关。综合上述结果可以看出,HRAE对双氧水诱导的H1299细胞氧化损伤具有显著的保护作用,保护机制可能与通过上调PPARγ、Nrf2、HO-1、KEAP1和p44/42 MAPK的表达从而激活Nrf2/HO-1信号通路有关,并且在高浓度(200 μg·mL−1)时保护作用尤为明显。
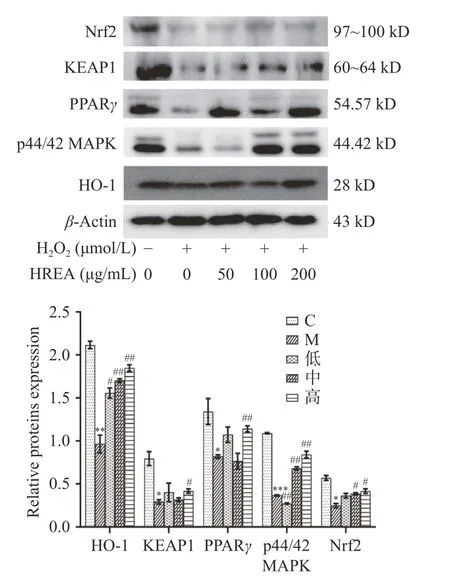
图6 HREA对H2O2诱导H1299细胞Nrf2、HO-1、PPARγ、p44/42 MAPK和KEAP1蛋白的影响Fig.6 Effects of HREA on Nrf2, HO-1, PPARγ, p44/42 MAPK and KEAP1 protein expressions in H2O2-exposed H1299 cells
2.8 沙棘花青素提取物“有效成分-疾病”靶点的分子对接结果
根据文献报道,沙棘花青素中主要组成成分为表儿茶素和儿茶素[12]。分子对接结果显示,沙棘花青素提取物中的表儿茶素和儿茶素2个关键活性成分[12]与氧化应激相关蛋白靶点以及Nrf2/HO-1通路的关键蛋白靶点Nrf2(Q9Z2X8)均具有良好的自由结合活性,结合能分别为−7.81和−6.80 kJ·mol−1,表明表儿茶素和儿茶素可能是沙棘花青素提取物抗氧化应激的潜在药效物质。结合能小于0 kJ·mol−1表明成分与靶点可以自由结合,结合能小于−5 kJ·mol−1则表明活性成分与靶点具有良好的结合能力,并且结合能越低越好[25]。其中,表儿茶素与潜在靶点的对接得分更小,说明其与受体蛋白的结合能力更强,为最关键活性成分。从价键角度看,表儿茶素可以与Nrf2蛋白残基ALA-466、VAL-604、LEU-557和GLY-367通过氢键相连;儿茶素可以与Nrf2蛋白残基ALA-466、VAL-606、ILE-559、VAL-514和GLY-367通过氢键相连,从而形成稳定的对接模式,本文选择结合能最低的构象对接结果进行2D可视化展示(见图7),结果表明它们均能与受体蛋白形成稳定构象,且具有较高的结合稳定性,这为以表儿茶素和儿茶素为主要活性成分的沙棘花青素提取物通过干预 Nrf2/HO-1通路的关键靶点Nrf2受体抗氧化应激提供了理论基础,并且与上述实验研究相呼应。

图7 沙棘花青素提取物与受体蛋白的对接模式图和2D展示图Fig.7 Docked pattern and 2D display of anthocyanin extracts from seabuckthorn and receptor proteins
3 讨论与结论
沙棘花青素提取物干预能显著提高肺细胞的细胞活力(P<0.05或P<0.01),细胞中ROS和MDA等含量也显著降低(P<0.01或P<0.001),提高SOD、CAT的活性(P<0.05或P<0.01),表明沙棘花青素提取物对人非小细胞肺癌H1299细胞具有保护作用。有研究表明,人体在摄入大量含有花青素食物后,能够产生一定抗氧化作用,从而保护组织器官,例如葡萄籽花青素(LGSP)具有明显的抗炎作用,研究人员通过RAW 264.7细胞和斑马鱼实验得到证实,其作用机制可能与抑制MAPK和NF-кB信号通路的激活,从而对RAW 264.7细胞中NO和促炎因子TNF-α、IL-6和IL-1β的产生具有较强的抑制作用,达到抗炎的疗效[26]。另有研究表明花青素具有显著保护肺部器官的作用[27],魏猛等[28]从细胞水平研究了原花青素对肺部氧化损伤的保护作用,该研究采用人支气管上皮细胞,以砷进行氧化损伤诱导,对MDA、ROS等相关氧化应激指标进行检测分析,该研究认为葡萄籽原花青素能够有效拮抗砷诱导的肺部氧化损伤,为花青素对肺部氧化损伤的保护作用研究奠定了基础。
由双氧水诱导的细胞氧化损伤,除沙棘花青素提取物直接清除ROS外,还可能通过调节细胞中相关蛋白的表达,如HO-1、KEAP1和GST等。这些蛋白增强了组织和细胞间抗氧化能力,保护细胞抵御氧化胁迫,从而减轻了过多自由基引起的相关病症。Nrf2-ARE与机体抗氧化系统具有密切的关系,正常情况下,细胞内的Nrf2与KEAP1相互绑定而静止于细胞质内[29−30]。当细胞受到外界氧化胁迫后,Nrf2将会从KEAP1上解偶联,转移到细胞核内并与核内特定DNA序列结合,启动相关保护酶基因消除由于氧化胁迫给机体带来的损伤[31]。Nrf2是内生性抗氧化酶合成的关键因子。在正常生理状态下,Nrf2与KEAP1在细胞质中处于结合状态,能够被蛋白酶降解而消失,当组织器官受到外界刺激,如组织过氧化损伤等,此时Nrf2与KEAP1解离,Nrf2与ARE在核内结合,从而使下游因子HO-1、KEAP1等表达,启动相关保护酶基因消除由于氧化胁迫给机体带来的损伤[23,32]。现已有报道称,在肺组织氧化损伤中Nrf2信号通路起着重要作用,该通路通过诱导人肺上皮细胞HO-1和NQO1的表达,对肺组织氧化损伤起到保护作用[33−34]。过氧化物酶体增殖子活化受体(PPARγ)与Nrf2启动子结合促进Nrf2表达[24]。ERK(p44/42 MAPK)参与细胞增值、凋亡的生长过程,并且有研究表明ERK(p44/42 MAPK)的激活程度和时间长短与Nrf2表达相关[35],本研究Western Blot的蛋白表达结果也证实了这一点。
沙棘花青素提取物能够显著上调HO-1、KEAP1和Nrf2的蛋白表达水平,从而激活Nrf2/HO-1通路,对肺组织细胞氧化损伤具有保护作用。综上所述,HRAE以浓度依赖降低双氧水导致的H1299细胞氧化损伤,其机制可能与Nrf2/HO-1信号通路的激活有关。
