肺癌免疫治疗耐药的现状和治疗策略
2023-03-12赵荆翻译校对
赵荆 翻译校对
主要目的:免疫检查点抑制剂(immune checkpoint inhibitors,ICI)的应用显著改变了晚期非小细胞肺癌(non-small cell lung cancer,NSCLC)的治疗现状。目前对耐药机制的认识仍在不断深入。本综述回顾了目前对肺癌ICI 治疗后疾病进展的管理和治疗新策略。
产生的重点知识:导致非小细胞肺癌对ICI 耐药的机制,可以是独立事件(如特定基因突变)发生,也可以相互关联(如肿瘤微环境[tumor microenvironment,TME]动态改变)。这些事件导致免疫逃逸及不同的临床条件下的耐药性。目前正在研究多种联合治疗策略和细胞治疗方法,以减少ICI 耐药的发生。
意义:识别免疫耐药模式有助于评估抗耐药方法的差异,并将有助于优化临床研究和转化研究设计。
针对程序性死亡配体-1(programmed death-ligand 1,PD-L1)或程序性死亡-1 (programmed death-1,PD-1)轴和细胞毒性T 淋巴细胞-4(cytotoxic T lymphocyte-associated antigen-4,CTLA-4)的ICI 显著改善了肺癌患者的生存获益。几项关键研究表明,无论单用或联用ICI,均显著改善了不伴EGFR或ALK基因突变的局部晚期、转移性NSCLC 或广泛期小细胞肺癌患者的临床疗效终点。尤其对于晚期NSCLC 患者,其中位缓解持续时间长达12~25 个月,ICI 无论是初治还是经治均可使患者长期获益,特别是PD-L1表达≥50%的患者。
尽管持久获益表明获得长期免疫记忆,但部分最初对ICI 有疗效反应而后来复发并发展为获得性耐药的患者,表现为临床和生物学上的免疫治疗失败。原发性和获得性耐药成为进一步改善晚期或转移性肺癌患者预后的关键阻碍。
在机体对ICI 的免疫应答中,TME 发挥着关键作用。同时,TME 基于不同的胚胎细胞遗传背景及肿瘤遗传组成不断演化。此外,TME 还受治疗干预(如放疗、手术、化疗和免疫治疗)和临床及疾病特征(如东部肿瘤协作组(Eastern Cooperative Oncology Group,ECOG)体能状况评分、吸烟习惯和特定转移部位)的影响,进而潜在影响ICI 单用或联用的疗效。
根据不同的进展时间和模式,肺癌患者免疫耐药的特征可分为:1)早期进展,包括快速进展(fast progression,FP)或所谓的超进展(hyper-progressive disease,HPD);2)初始治疗获益后的晚期进展。上述不同的进展时间和模式证实了异质性患者群体中不同的ICI 免疫耐药过程。
由于生物的复杂性以及免疫治疗在临床中的快速应用,目前尚未形成预防、定义和管理免疫耐药性的统一方法,仍需进一步研究。
值得注意的是,尽管已证实PD-L1 表达是肺癌免疫治疗的有效预测性生物标志物,但明确稳定可靠的预测性生物标志物是改进检查点阻断治疗患者筛选的重要瓶颈。
一直以来,PD-L1 的评估存在异质性且呈动态变化,尚无法充分表征TME。相比之下,肿瘤突变负荷已获得强有力的理论基础和初步研究证据,但其作为NSCLC 免疫治疗的预测性生物标志物仍有待进一步验证。
仅靠单一的生物标志物不太可能预测接受ICI 治疗患者的临床结局。因此,需要更深入地理解临床和生物学特征间的相互作用,以改善对ICI 耐药的管理,以便合理筛选适合行特定肿瘤免疫治疗的患者。
本文将回顾晚期肺癌现有免疫治疗耐药性的相关知识,讨论相关生物学特征、临床管理及诊治新策略。
1 ICI 耐药定义和机制
ICI 的先天性(原发性)和获得性(继发性)耐药概念是从其他抗肿瘤治疗(化疗和酪氨酸激酶抑制剂)的概念中逐渐转化而来。然而,其他抗肿瘤治疗对耐药的定义明确,但ICI 免疫耐药模式的定义仍未统一。目前最具影响力的概念由癌症免疫治疗学会(Society for Immunotherapy of Cancer,SITC)提出,SITC 共识区分了抗PD-1/PD-L1 治疗下3 种不同的耐药模式:原发性耐药、继发性耐药,以及全因停止治疗后进展。
原发性耐药定义为接受至少6 周(2 个周期)且不超过6 个月的ICI 治疗后出现疾病进展。对于达到临床获益即客观缓解或疾病稳定(stable disease,SD)持续6 个月或更长时间后出现的疾病进展则定义为继发性耐药。ICI 停药后耐药的定义包括与毒性相关和无关的耐药,包含完成计划治疗方案后出现的耐药,该定义也适用于仍在探索中的NSCLC 辅助/新辅助免疫治疗。有研究表明,抗PD-1 受体的结合会在末次给药2~3 个月后下降。因此,若患者停药前经ICI 治疗有获益,随后在末次给药12 周内出现疾病进展,则归类为继发性耐药,此类患者可能会从重启ICI 治疗中获益。对于既往使用ICI 治疗无获益的患者,因任何原因停药后出现的疾病进展归类为原发性耐药。但近期有专家小组建议,将所有初始客观缓解(不包括SD)后出现的复发,无论发生时间如何,均视为获得性耐药。
原发性耐药的机制可能由于先天性免疫系统的无效抗原呈递,导致正常免疫反应(包括T 细胞的启动、活化、转运和迁移)无法激活,以及肿瘤内T 细胞共抑制受体和免疫抑制细胞的过表达。因此,ICI 的耐药涉及肿瘤内源性和外源性机制。继发性耐药的机制与肿瘤细胞和TME 在免疫治疗暴露期间通过表观遗传调控或蛋白翻译修饰产生的适应性变化有关。同样,继发性耐药也可由肿瘤细胞的克隆进化所致,这种进化产生的特异性基因突变也会损伤抗肿瘤免疫反应。
更为深入地说,肿瘤内具有免疫调节功能基因的组成性或获得性突变,最终会导致新抗原表达和识别减少,使T 细胞激活受损。包括JAK1和JAK2突变,PTEN缺失介导的PI3K激活,丝裂原激活的蛋白激酶通路突变等,均可通过信号转换器和转录激活因子,调节干扰素-γ(interferon-gamma,IFN-γ)反应和抗原呈递通路(包括抗原加工机制),共抑制信号表达和主要组织相容性复合体(major histocompatibility complex,MHC)的表达。同样,具有免疫调节功能的基因突变也影响关键致癌通路的改变,如β-catenin、TP53、LKB1的缺失和MYC扩增,可能会影响免疫抑制的TME。无论MHC-I 类分子是否充足,IFN 信号的内在缺陷都是IFN 诱导的抗肿瘤反应受损的主要原因。相反,β-2 微球蛋白的缺失会影响MHC-I 类分子表达进而影响T 细胞抗原识别的潜力。上述两种改变均可导致细胞毒性活性降低。因此,需要使用不依赖MHC-I 的策略,如白介素(interleukin,IL)-2 激动剂,来激活CD8 和自然杀伤(natural killer,NK)细胞或CD4 和NK 细胞。
肿瘤外源性因素与TME 有关。事实上,TME 中的动态相互作用会打破免疫抑制、促炎细胞因子和介质间的稳态(包括共刺激和共抑制信号),导致骨髓源性的抑制细胞(myeloid-derived suppressor cell,MDSC)、肿瘤相关的巨噬细胞、M2 巨噬细胞和调节性T细胞的浸润增加。如缺氧可诱导血管内皮生长因子(vascular endothelial growth factor,VEGF)的表达并介导肿瘤部位MDSC 的动员和浸润。
值得注意的是,不同的耐药模式会影响后续治疗方案的选择。如可以通过增加辅助治疗来恢复获得性耐药患者的免疫敏感性,使其从免疫治疗中获益。当然,研究结果的有效性可能因患者入组标准的差异和不同的免疫耐药模式而受到影响。
2 在临床应用中管理免疫耐药
持久的临床获益是指对ICI 的疗效反应模式,包括至少6 个月的部分缓解(partial response,PR)或SD。
相反,对ICI 治疗不良预后模式的明确定义包括HPD 和FP。其中,关于HPD 的定义目前仍存在争议,最常用的定义为:与ICI 治疗前的影像学数据相比,肿瘤生长比率/肿瘤生长速率至少增加2 倍或肿瘤生长比率增加≥50%。FP 则定义为ICI 起始治疗后6 周内发生的疾病进展。对于经治的NSCLC 患者,可评估病例中分别有14% 和8% 的患者出现HPD 和FP。在ICI 初治后12 周内死亡定义为过早死亡,约占所有跨线治疗NSCLC 患者的1/3。
此外,既往研究报道了一种非常规的反应模式,即假性进展,表现为肿瘤体积最初增加甚至出现新的病变,然而在随后的影像学检查中消退。
虽然假性进展在NSCLC 中很少见,但仍应重视,特别是对于ICI 治疗后症状明显改善但出现非常规影像学进展的患者。这些临床改善的患者尽管出现了短时间内的影像学进展,但有可能从持续治疗中获益。
了解影响特定耐药模式发生的潜在临床和生物学特征,对于筛选适合免疫治疗的患者,以及预测和管理ICI 耐药至关重要。
值得注意的是,对于异质性患者群体,免疫疗法联合化疗可能通过协同免疫效应和(或)化疗或免疫疗法本身的活性诱导应答。因此,对于使用免疫疗法联合化疗有应答的患者,目前很难确定哪些成分是应答的驱动因素,导致难以确定对免疫疗法的耐药性。
从NSCLC 免疫治疗关键临床试验的亚组分析中,挖掘出了影响ICI 原发性耐药的临床特征,部分特征在真实世界数据研究中得到了进一步的探索和验证。如女性和不吸烟患者从ICI 单药治疗中获益较低,但化疗联合免疫治疗的疗效却不受性别或吸烟状况的影响。ECOG 体能状态评分≥2 分和特定转移灶(肝、胸膜、骨和脑)的数量则是疗效的负性预测因素,可用来识别早期进展的高风险患者,或ICI 治疗会产生不利影响的高风险患者。
同时,综合基因组分析数据强调了NSCLC 中特异性基因突变与免疫治疗疗效较差相关。实际上,大多数非鳞状NSCLC 的驱动突变(即EGFR、ALK、ROS1、RET和HER2)都是ICI 疗效的负性预测因子,可用于排除单用免疫治疗的患者;而KRAS及吸烟者中BRAF和MET外显子14 跳跃突变则可能是ICI疗效的正性预测因子。其他基因突变,包括STK11缺失或KEAP1突变等,与缺乏免疫反应的冷肿瘤的免疫浸润有关,可用来识别预后不良的特定NSCLC 亚型。
从临床角度看,除了优化患者筛选和抗ICI 耐药的新策略外,对疾病进展的最佳管理还需解决两种特殊情况,即寡进展性疾病和按计划停止治疗后疾病进展。
对于寡进展性疾病,共识指出应尽可能使用局部治疗并继续使用持续性全身免疫治疗。SITC 推荐对于单个淋巴结的寡进展行再活检确认。
对于按照治疗计划停止治疗≥6 个月后复发的患者,由于不属于继发性耐药,ICI 重启治疗能否获益仍不明确。目前尚缺乏局部晚期患者完成1年度伐利尤单抗治疗后出现疾病进展重启ICI 治疗的相关数据;相反,帕博利珠单抗重启治疗使一线治疗(50% SD,33.3%客观缓解)和二线治疗(35.7% SD,42.9% PR)患者的疾病控制显著获益。在CheckMate-153 研究中,经过1年固定时间的纳武利尤单抗治疗后出现疾病进展的患者,纳武利尤单抗重启治疗的结局不容乐观(仅10%的患者继续重启治疗)。然而,基于各地监管部门的要求,不同国家对于ICI 重启治疗的策略有所不同,因此不能作为临床实践标准执行。
3 预防和抗耐药的新策略
3.1 免疫抑制模式
鉴于CTLA-4 在淋巴调节性T 细胞启动中的作用,CTLA-4 成为最早被研究的免疫共抑制靶点。在CheckMate 227 和CheckMate 9LA 研究中,纳武利尤单抗(抗PD-1)+伊匹木单抗(抗CTLA-4)单用或联合短期化疗,无论组织类型或PD-L1 表达水平如何,均较铂类双药化疗提高了NSCLC 患者的生存期。近期的POSEIDON 研究中,抗PD-L1 度伐利尤单抗和抗CTLA-4 曲美木单抗联合化疗较单独化疗,使患者总生存期(overall survival,OS)延长。然而,目前尚无正式的数据报告,因此很难确定双免疫疗法是否比单用ICI 或联合化疗更有效。
这一问题在CheckMate 227 研究的探索性队列中进行了分析:该研究发现纳武利尤单抗+伊匹木单抗相比PD-L1 阳性亚组中单用纳武利尤单抗的患者(PD-L1≥1%为23.2 个月vs.15.5 个月,PD-L1≥50%为31.8 个月vs.17.5 个月)和PD-L1 阴性亚组中纳武利尤单抗联合化疗的患者(18 个月vs.8.3 个月)的应答时间更长,且中位OS 和无进展生存期(progressionfree survival,PFS)也显著增加(尚未获得正式的统计数据)。然而,目前尚无使用抗PD-1/PD-L1 治疗发生耐药的肺癌患者使用双重阻断治疗的疗效数据。
其他几种免疫共抑制靶点在肺癌中通常上调。
T 细胞免疫球蛋白和ITIM 结构域(T-cell immunoglobulin and ITIM domain,TIGIT)通过结合抗原呈递细胞和肿瘤细胞上的人脊髓灰质炎病毒受体配体,从而抑制T 细胞和NK 细胞功能。替瑞利尤单抗(Tiragolumab)是一种靶向TIGIT 的单克隆抗体,在Ⅱ期CITYSCAPE 研究和Ⅲ期SKYSCRAPER-01 研究中显示出良好的疗效与安全性。其中,Ⅱ期CITYSCAPE 研究评估了替瑞利尤单抗联合阿替利珠单抗作为一线治疗药物对PD-L1 阳性(肿瘤细胞阳性比例分数[Tumor Proportion Score,TPS]≥1%)的晚期或转移性NSCLC 患者的疗效。在总人群中,与阿替利珠单抗单药治疗相比,联合治疗的安全性较好,且由于部分患者为PD-L1 高表达(TPS≥50%),该研究的总缓解率(overall response rate,ORR)增加,PFS 延长。联合治疗组与单药组的ORR 分别为66%vs.24%,中位PFS 分别为未达到vs.4.1 个月(HR:0.30;95%CI:0.15~0.61)。Ⅲ期SKYSCRAPER-01 研究评估了阿替利珠单抗和替瑞利尤单抗联合治疗PD-L1 高表达的NSCLC 患者的疗效。另一项Ⅰ期研究及ICI 初验证性研究(总人群ORR 为29%;PD-L1 阳性患者的ORR 为46%,PFS 为8.4 个月)中证实,另一种抗TIGIT 抗体维博利单抗(vibostolimab),单用或与帕博利珠单抗联用,对抗PD-1/PD-L1 难治性NSCLC 均显示出良好的安全性和疗效(ORR 5%~7%)。目前一项Ⅲ期研究正在探索MK-7 684 和帕博利珠单抗的联合制剂(MK-7684A)作为一线治疗较帕博利珠单抗单药治疗对PD-L1≥1%的NSCLC 患者的疗效;以及单用或与多西他赛联用进行ICI 耐药研究(表1,2)。
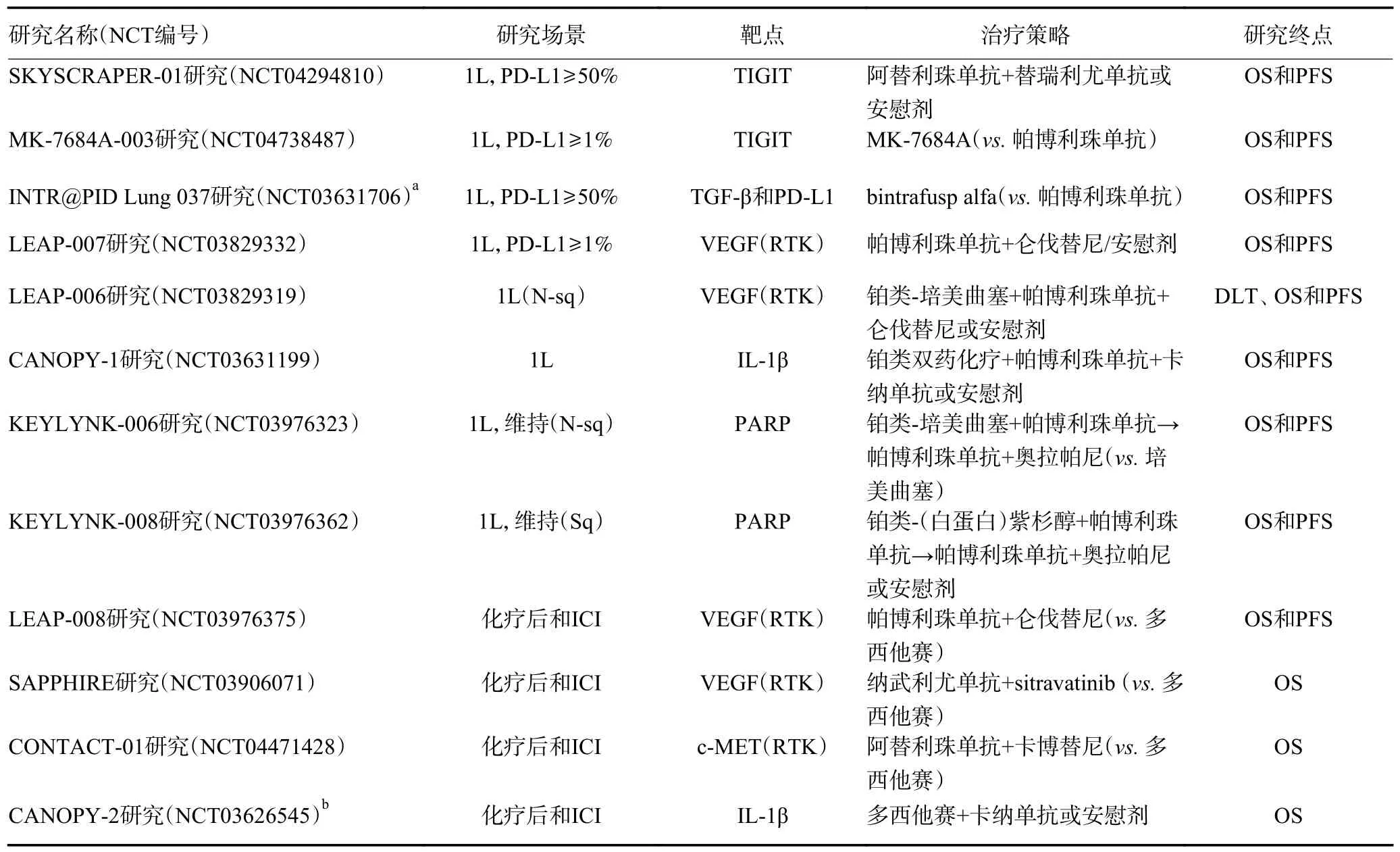
表1 晚期NSCLC 抗ICI 耐药策略的Ⅲ期临床研究
其他临床研究中针对共抑制信号的化合物包括但不限于抗V 结构域免疫球蛋白抑制T 细胞激活(Vdomain immunoglobulin suppressor of T-cell activation,VISTA)抗体、淋巴细胞激活基因-3(lymphocyte activation gene-3,LAG3)抗体、跨膜免疫球蛋白和黏蛋白域3(transmembrane immunoglobulin and mucin domain 3,TIM3)抗体和Siglec-15(S15)抗体等。上述靶点抑制剂在ICI 耐药的早期研究中,无论单用或与PD-1或PD-L1 抑制剂联用,均已显示出令人鼓舞的安全性和疗效。特别值得关注的是,靶向VISTA 和PD-L1的口服化合物CA170 在预处理NSCLC 患者中达到了75%的疾病控制率(表2)。

表2 早期(Ⅰ/Ⅱ和Ⅱ期)研究中预防或抗ICI 耐药的抑制/刺激新靶点a
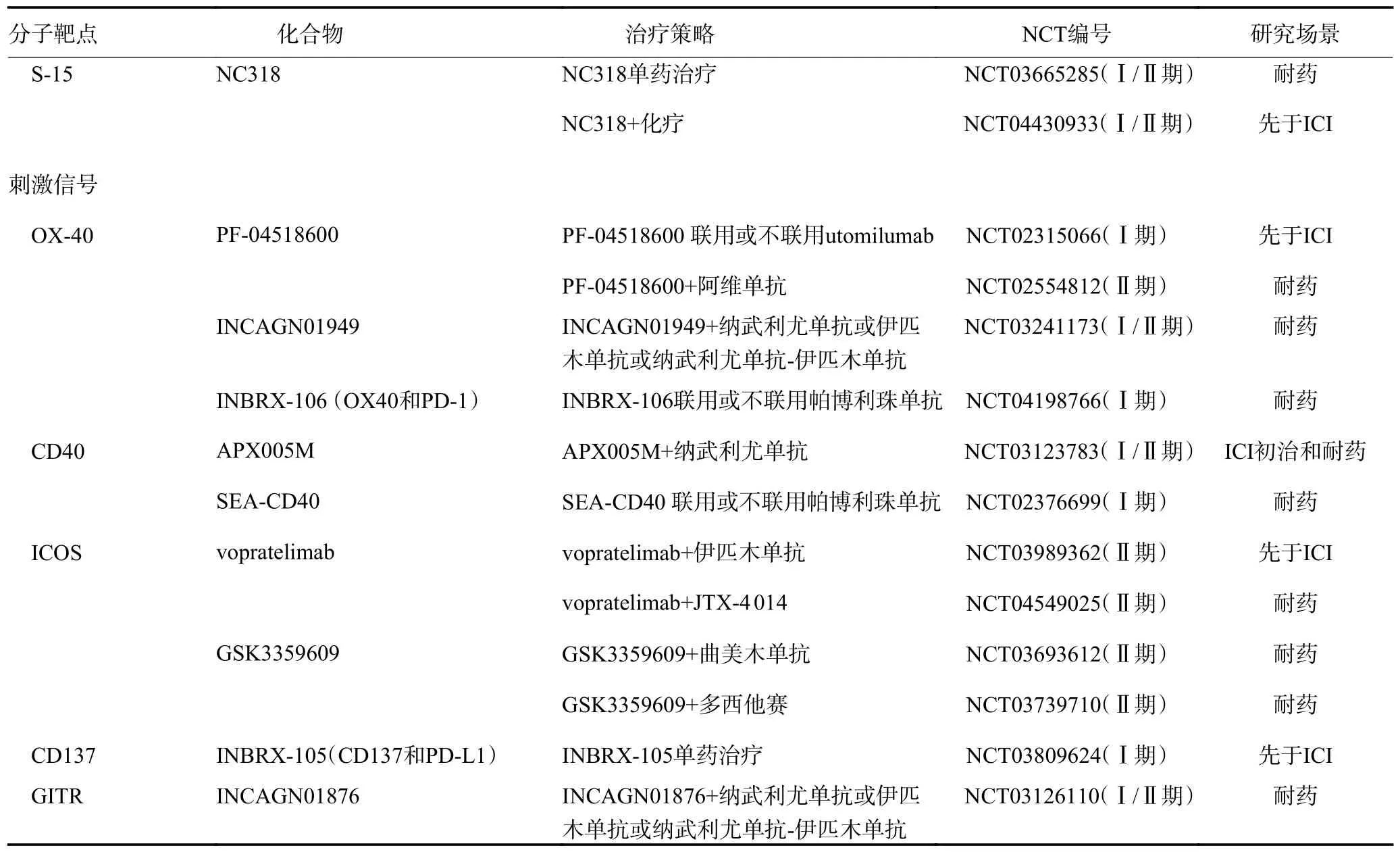
表2 早期(Ⅰ/Ⅱ和Ⅱ期)研究中预防或抗ICI 耐药的抑制/刺激新靶点a (续表2)
3.2 免疫刺激因子
与共抑制信号相反,靶向共刺激分子是基于激动剂抗体,增加免疫细胞的克隆扩增和表型转换。而肿瘤坏死因子受体家族成员的激动剂(如OX40、CD137、CD40、ICOS 和GITR)单药治疗在临床研究中未显示获益。但其联合治疗用于ICI 初治和耐药的NSCLC 患者的初步疗效数据令人鼓舞,且耐受性良好(表2)。
3.3 T 细胞启动:T 细胞工程和疫苗
增加T 细胞启动的新方法包括:以肿瘤浸润淋巴细胞(tumor-infiltrating lymphocyte,TIL)疗法、嵌合抗原受体T 细胞形式的过继细胞疗法,以及个体化疫苗。TIL 疗法是从肿瘤组织中分离出TIL,进行扩增和筛选以识别肿瘤抗原,然后再注入患者体内。TIL过继细胞疗法已在几种实体肿瘤中展现出疗效。目前也有临床研究正在比较单用TIL 过继细胞疗法或与ICI 联用对于ICI 初治和耐药的NSCLC 患者的疗效。近期公布的数据显示,对纳武利尤单抗无效的NSCLC 患者经TIL 治疗后,可评估的患者显示出肿瘤消退和疾病控制,其中1 例EGFR突变阳性患者达完全缓解。相反,嵌合抗原受体-T 细胞由T 淋巴细胞工程表达合成肿瘤抗原受体的抗体,因此不需要MHC 呈递来识别抗原。然而,尽管过继细胞疗法在血液恶性肿瘤中疗效良好,但迄今为止,此疗法在包括NSCLC 在内的实体肿瘤中尚未显示出显著疗效,表明需要更好的目标抗原(表3)。
基于肿瘤特异性新抗原的个体化疫苗是增强T细胞抗肿瘤反应的另一种策略。一项评估NEO-PV-01 个体化疫苗联合帕博利珠单抗和化疗作为NSCLC一线治疗的早期研究(NCT03380871)正在进行中。只有一小部分突变编码的新抗原能被T 细胞识别,其他潜在的新抗原包括来自单核苷酸变异的多肽、导致移码的插入和缺失、结构变异,以及病毒基因组整合介导的,甚至由异常RNA 剪接而发生的翻译后事件。为了确定哪些表位可以由MHC 呈递,从而被CD4或CD8 T 细胞识别,目前正在根据检测到的肿瘤基因组畸变,开发用于预测肽-MHC 结合的亲和力和稳定性的计算工具和基于新抗原呈递的T 细胞活化分析方法(表3)。
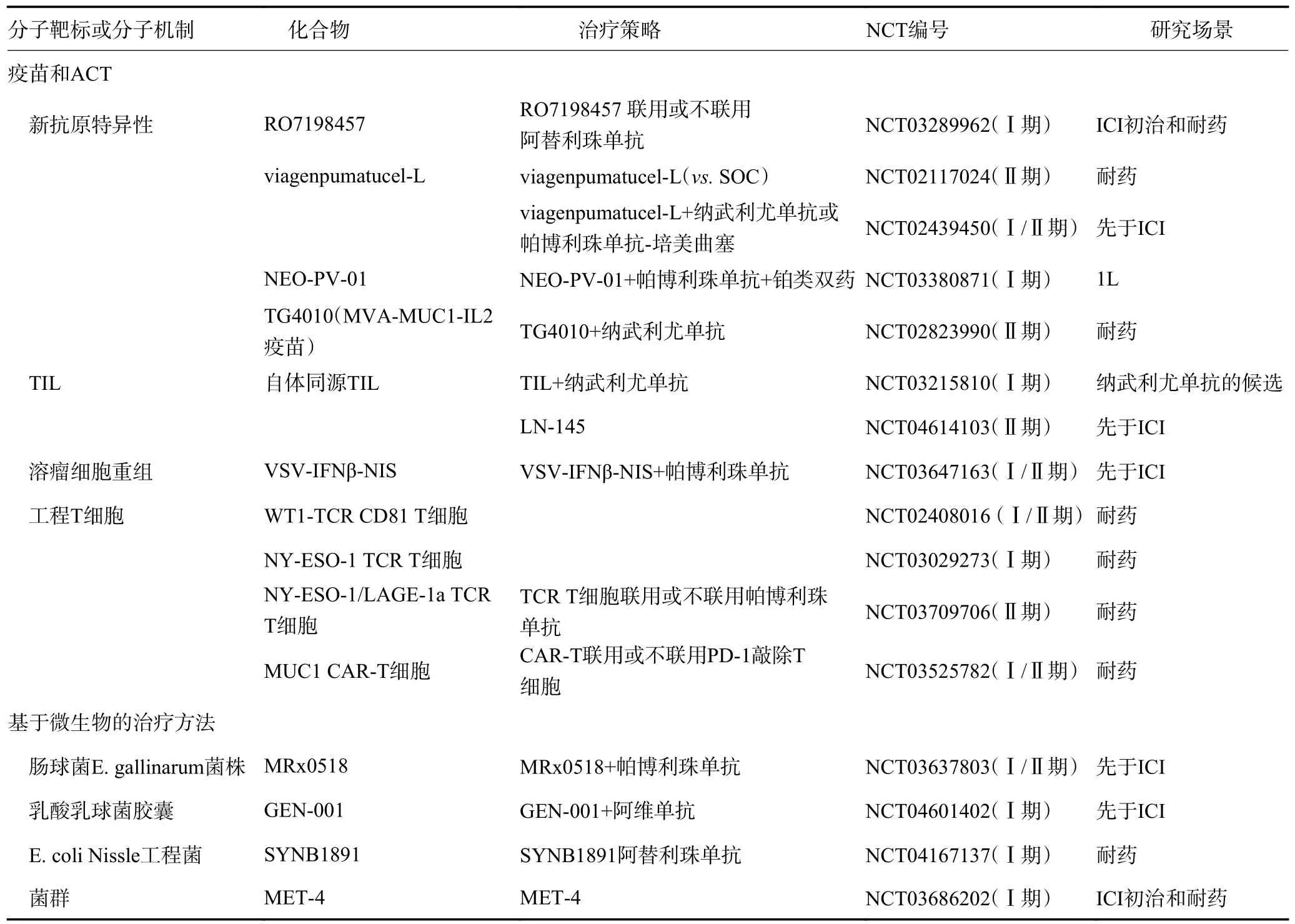
表3 早期(Ⅰ/Ⅱ和Ⅱ期)研究中预防或抗ICI 耐药的新靶点和机制
3.4 靶向VEGF
由于VEGF 的血管形成和重构的机械性损伤,淋巴细胞通过内皮细胞的过程中受损。VEGF 作为一种细胞外介质通过多种机制,如抑制树突状细胞成熟和抗原呈递;上调PD-L1、PD-L2 和免疫抑制介质如吲哚胺2,3-双加氧酶(indoleamine 2,3-dioxygenase,IDO)-1、IL-6 和IL-10 抑制T 细胞反应;调节性T 细胞的诱导以及MDSC 的累积等,对肿瘤免疫产生深远影响。
有研究评估靶向VEGF 轴的单克隆抗体和小分子,能否恢复VEGF 介导的MDSC 浸润及随后的免疫抑制。在针对非鳞状NSCLC 患者的IMpower150研究中,抗VEGF 单克隆抗体贝伐珠单抗联合阿替利珠单抗和化疗的一线治疗较单独化疗显著延长了患者的OS。目前正在评估其他药物,包括单克隆抗体(如雷莫芦单抗)和多激酶抑制剂(如仑伐替尼、sitravatinib、尼达尼布和阿西替尼)等的一线联合用药及其对ICI 耐药的NSCLC 患者的疗效(表1~4)。在一项Ⅰb/Ⅱ期研究中,仑伐替尼联合帕博利珠单抗获得了令人鼓舞的初步结果,纳入的22 例NSCLC 患者(大多数为经治患者,其中52%的患者接受了ICI 治疗)的ORR 为33%,中位PFS 为5.9 个月。基于上述结果,LEAP 系列Ⅲ期临床研究正在对仑伐替尼联合帕博利珠单抗作为一线和后线治疗的疗效进行验证。此外,一项针对ICI 耐药患者的Ⅲ期研究正在评估sitravatinib 联合纳武利尤单抗的疗效。而另一项Ⅱ期研究显示尽管有17%的患者因不良事件而终止治疗,但肿瘤消退率高达>80%且疗效反应延长。同样,在一项Ⅰ期试验中,帕博利珠单抗联合抗VEGF 受体-2 雷莫芦单抗在NSCLC 患者中具有良好的疗效和耐受性;该联合治疗方案目前正在Lung-MAP 研究中进行验证。在临床环境中,尼达尼布联合多西他赛是含铂化疗失败后的一种治疗选择。最近的数据证实了该联合疗法即使对于免疫治疗失败后患者仍然有效(表4)。
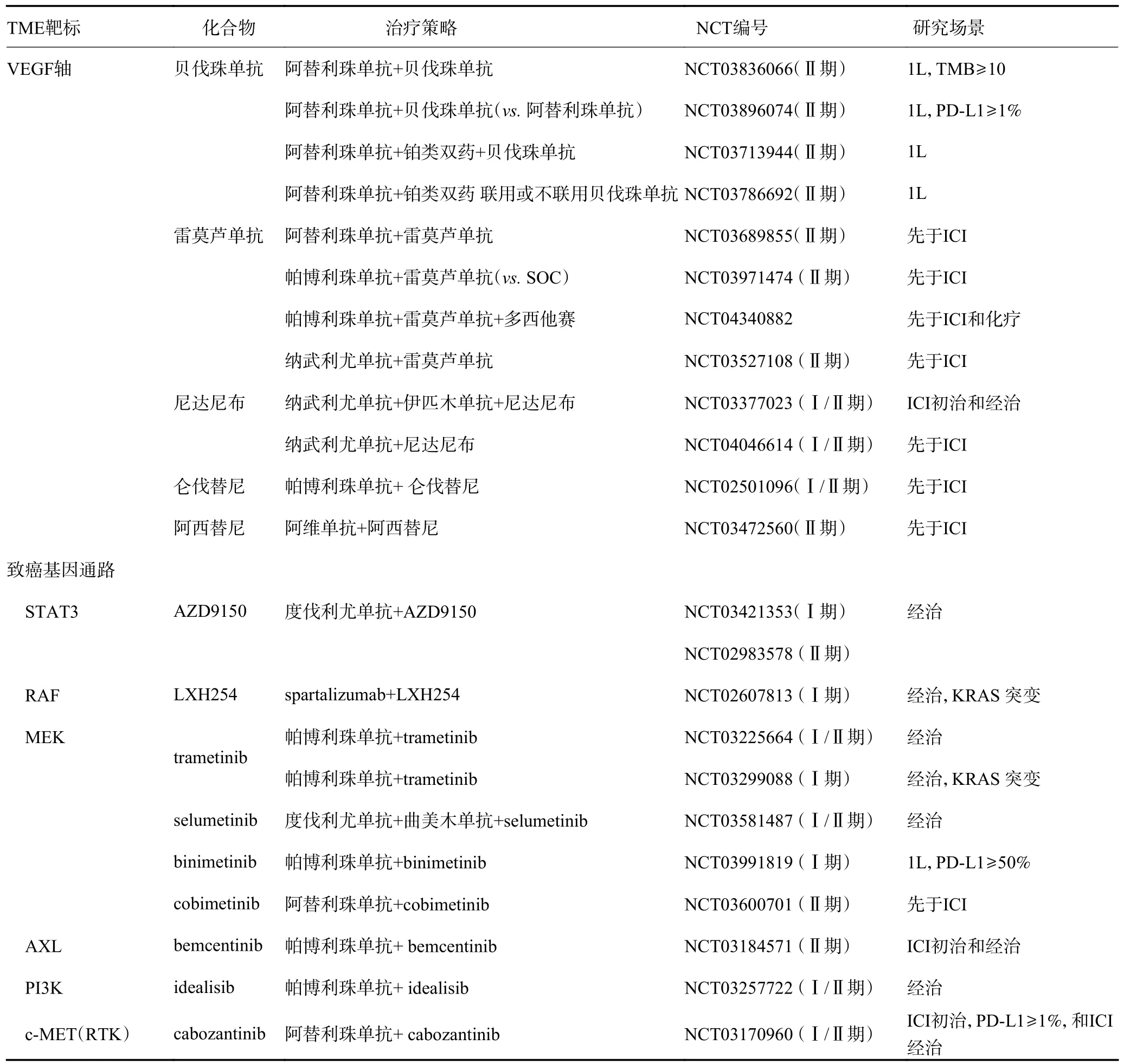
表4 早期(Ⅰ/Ⅱ和Ⅱ期)研究中预防或抗ICI 耐药的靶向VEGF 和致癌基因通路
3.5 细胞因子
有研究正在评估可直接靶向的细胞因子。在动脉粥样硬化患者中使用抗IL-1β 单克隆抗体卡那单抗(canakinumab)观察到肺癌发病率和死亡率显著降低,由此IL-1β 引起了研究者极大的兴趣。然而,在Ⅲ期CANOPY-2 研究中,卡那单抗联合多西他赛化疗未能使ICI 耐药的NSCLC 患者OS 获益。目前,该药物作为一线治疗与免疫+化疗联用应用于辅助治疗患者以减少免疫耐药性,正在Ⅲ期临床研究中验证。
靶向IL-10 和转化生长因子-β(transforming growth factor - beta,TGF-β)的研究结果令人失望。在Ⅱ期CYPRESS 1 和CYPRESS 2 研究中,聚乙二醇重组人IL-10 pegilodecakin 与ICI 联用未能使NSCLC患者的ORR 和生存率获益,且治疗导致的不良反应较大。然而,尽管bintrafusp alfa(靶向TGF-β 和PDL1 的双功能蛋白)的初步疗效和安全性令人鼓舞,在Ⅲ期Lung-037 研究中,bintrafusp alfa 较帕博利珠单抗未能使PD-L1 高表达的ICI 初治NSCLC 患者获益,该研究近期因无效而被终止(表5)。
Bempegaldesleukin(NKTR-214)是一种倾向与CD122 优先结合的IL-2 通路激动剂,与纳武利尤单抗联用,用于治疗NSCLC 在内的初诊实体肿瘤患者。目前有研究正在探讨NKTR-214 与帕博利珠单抗联用对于NSCLC 患者的疗效。THOR-707 是一种聚乙二醇化的非IL-2 化合物,目前THOR-707 单用或与帕博利珠单抗联用治疗实体肿瘤的Ⅰ/Ⅱ期HAMMER 研究正在进行中(表5)。
3.6 其他靶向TME 药物
TME 的治疗靶点之一为靶向免疫抑制作用的致癌通路和细胞周期的蛋白(如靶向RAS、AXL、PI3K、STAT3、多受体酪氨酸激酶和CDK4/6),从而增加抑制性趋化因子的产生,增强IFN-γ 信号,上调PD-L1表达以及下调靶向抗原呈递机制蛋白。
其他TME 靶点包括免疫抑制酶(如IDO)和表观遗传免疫调节酶[如组蛋白去乙酰化酶和维甲酸受体相关孤儿受体γ(retinoic acid receptor-related orphan receptor γ,RORγ)]。其中,IDO 活性决定了免疫抑制Treg 分化的结果,色氨酸的消耗和下游代谢物的积累。然而,评估IDO 抑制剂epacadostat 联合帕博利珠单抗或免疫化疗的Ⅲ期研究却未观察到阳性结果。与此同时,目前临床研究正在明确介导肿瘤内T 细胞浸润增加的组蛋白去乙酰化酶抑制剂(如伏立诺他和恩替诺特)和RORγ 激动剂单用或与ICI 联用对于ICI 初治和耐药的NSCLC 患者的疗效。TME 中发生应激和炎症反应后,腺苷在胞外间隙积聚,也可导致免疫反应受损。因此,抑制腺苷受体的化合物也正在进行临床研究(表5)。此外,越来越多的研究将肠道菌群作为免疫抗肿瘤治疗的靶点。有证据表明,不同微生物菌群的富集以及广谱抗生素的使用可以预测NSCLC患者应用ICI 的疗效,表明改变胃肠道微生物菌群组成,即粪便微生物移植的治疗策略,可能提高免疫治疗的疗效或逆转ICI 耐药(表3)。

表5 早期(Ⅰ/Ⅱ和Ⅱ期)研究中预防或抗ICI 耐药的TME 新靶点
综上所述,肿瘤患者免疫抗肿瘤反应的程度及持续时间取决于免疫系统的复杂性及其与TME 的动态相互作用,以及肿瘤克隆选择的演化过程。而大多数患者的耐药性往往发生的时间不同(包括治疗早期,在一段较长时间的临床获益后,甚至在因任何原因停药后)且形式多样。
影响免疫应答的因素和特异性免疫抵抗的机制是多方面的,然而目前减少ICI 耐药的研究仍处于初始水平,大多数策略仅基于生物标志物,也因此可能导致正在研究的新疗法疗效有限。
事实上,基于生物标记物和特定耐药模式的个体化治疗可能是预测、预防和减少ICI 耐药的最佳途径。由此,除PD-L1 外,目前还评估了不同类型的ICI 疗效或耐药性预测生物标志物,包括分子和遗传特征(如肿瘤突变负荷、新抗原负荷和选择性基因突变)、特异性免疫细胞亚型(TIL 和MDSC)以及免疫信号通路。最前沿的分析工具可通过整合基因组、转录组和空间定位数据,开发出一种高度复杂的多参数TME 和生物标志物评估方法,以便更有针对性地筛选可从免疫治疗获益的患者。
在上述背景下,统一耐药性定义并广泛使用包括免疫基因特征评估在内的全基因组分析将有助于优化临床研究设计,并依据临床研究结果进一步指导临床实践。
致谢
感谢默沙东(中国)投资有限公司郑尧杰和王曦辰为本文翻译提供学术支持,感谢上海北翱医药科技有限公司为本文提供辅助编辑工作,感谢默沙东(中国)投资有限公司的支持。
版权声明
本文原文“Managing resistance to immune checkpoint inhibitors in lung cancer: treatment and novel strategies”,首次发表在Journal of Clinical Oncology,2022 February 20; 40(6):598-610;本次二次发表已取得版权所有者©2022 Wolters Klwer 出版社的同意,对原文进行翻译,不涉及一稿多投及侵犯版权等问题。
