安罗替尼联合阿霉素和异环磷酰胺治疗软组织肉瘤肺转移的疗效及安全性分析*
2023-03-12申宇翔张超韩秀鑫冯巾晏刘永恒张岩卢凤张忠民王国文马育林
申宇翔 张超 韩秀鑫 冯巾晏 刘永恒 张岩 卢凤 张忠民 王国文 马育林
软组织肉瘤(soft tissue sarcoma,STS)是一类起源于间叶组织的恶性肿瘤,具有高度异质性,约占成人恶性肿瘤的1%。软组织肉瘤根据其来源可以分为不同亚型,目前已经有超过75 种不同的组织病理学亚型[1]。临床常见的亚型有胃肠道间质瘤、恶性外周神经鞘膜瘤、平滑肌肉瘤、脂肪肉瘤、纤维肉瘤等。软组织肉瘤早期转移倾向明显,容易经血道转移至肺脏,而肝转移和骨转移相对少见[2]。大约20%~25%的软组织肉瘤患者会出现肺转移,这些患者多数在初诊2年后发现肺转移的临床证据[3]。出现转移是软组织肉瘤患者预后不良的重要因素之一,其中位总生存期(median overall survival,mOS)仅为12~15 个月,而3年生存率仅为20%~25%[1]。化疗是延长进展期软组织肉瘤患者生存期的有效手段,目前转移性软组织肉瘤的一线治疗方案为阿霉素单药化疗或联合异环磷酰胺,一项Ⅲ期临床随机对照试验显示:使用阿霉素联合异环磷酰胺方案治疗转移性软组织肉瘤,患者中位生存期为14.3 个月,中位无进展生存期为7.4 个月,客观缓解率为25%~30%[4]。目前常根据不同亚型采取不同的化疗药物组合,但尚缺乏有力的证据表明患者可以从中获益,根据现有治疗手段,总生存时间无改善,因此临床上需要开发安全有效的治疗方案。
血管生成是肿瘤细胞增殖转移过程中的重要环节,因此抗血管生成是研发抗肿瘤药物的重要靶点。近年来一系列抗血管生成药物的问世大大提高了晚期恶性肿瘤患者的预后和总生存期,诸如贝伐珠单抗、索拉非尼、舒尼替尼等抗血管生成靶向药物在晚期结直肠癌、肝细胞癌、肾细胞癌等恶性肿瘤中都表现出了较好的治疗效果。安罗替尼是一种新型口服酪氨酸激酶抑制剂,能够抑制血管内皮生长因子受体(VEGFR)、成纤维细胞生长因子受体(FGFR)、血小板源生长因子受体(PDGFR)、c-kit 等多个靶点从而起到抗血管生成以及抑制肿瘤增殖生长的作用[5]。目前安罗替尼已经获批用于既往接受过蒽环类药物化疗失败,肿瘤出现复发或进展的晚期软组织肉瘤患者。但是对于软组织肉瘤肺转移目前临床上研究较少,也缺少相关研究资料。本项单中心回顾性研究希望通过对相关患者进行分析和随访,系统评价安罗替尼联合阿霉素和异环磷酰胺(adriamycin ifosfamide,AI)化疗方案对软组织肉瘤肺转移患者的有效性和安全性。
1 材料与方法
1.1 临床资料
回顾性分析2018年6月至2022年4月就诊于天津医科大学肿瘤医院的软组织肉瘤肺转移32 例患者的临床及影像学资料。纳入标准:1)病理学证实为软组织肉瘤且影像学发现肺转移证据;2)年龄为20~75 岁;3)患者ECOG 评分0~1 分,耐受化疗;4)根据实体瘤疗效评价标准RECIST 1.1,患者肺部影像学资料存在可测量病灶;5)未使用过其他靶向药物;6)患者理解同意治疗方案并签署同意书。排除标准:1)患者肺转移灶无法按照RECIST 1.1 标准测量;2)患者合并有严重基础疾病,无法耐受治疗;3)治疗过程中患者有使用其他化疗方案或靶向药物;4)患者拒绝治疗方案。本研究接受天津医科大学肿瘤医院伦理委员会监督,所有纳入研究的患者均同意治疗方案并签署知情同意书。
1.2 方法
1.2.1 资料收集 本研究收集了32 例患者一般资料(表1)和影像学资料,包括软组织肉瘤病理亚型、原发部位、转移情况、手术情况、发现肺转移时间及发现时肺转移大小、化疗周期、治疗过程中肺转移灶变化情况、使用安罗替尼前后患者的血常规、尿常规、肝肾功能情况、、患者生存状态、治疗过程中患者的主观不良反应等。其中男性患者23 例,女性患者9 例,中位年龄58 ( 23~74 ) 岁。

表1 患者一般资料
1.2.2 治疗方案 所有患者进行AI 方案化疗联合安罗替尼维持治疗,具体用药方案:多柔比星55~75 mg/m2或脂质体阿霉素30 mg/m2+异环磷酰胺6~9 g/m2,每 3 周为1 个周期。安罗替尼初始剂量为每次12 mg 或10 mg,每日口服1 次。若患者出现较严重的不良反应可减量至10 mg 或8 mg。以21 d 为1 个治疗周期,连续使用14 d 后停药7 d。治疗终点为患者疾病进展、死亡或出现无法耐受的不良反应。在开始治疗之前收集受试对象的影像学检查及血常规、尿常规、肝肾功能化验等,确定治疗前肺转移灶的基线大小和患者基础身体状况,用于后续评价治疗效果及安全性。
1.2.3 疗效与安全性评价 根据RECIST 1.1 标准,恶性肿瘤患者对治疗的反应包括:完全缓解(complete response,CR)、部分缓解(partial response,PR)、病情稳定(stable disease,SD )、疾病进展(progression disease,PD ),通过回顾患者随访复查时的胸部CT 结果评价治疗效果。主要研究内容为无进展生存期(progression-free survival,PFS)、总生存期(overall survival,OS)、客观缓解率(objective response rate,ORR)、疾病控制率(disease control rate,DCR)以及治疗过程中的不良事件。PFS 指从使用安罗替尼开始至病情出现进展或死亡的时间,ORR=CR+PR,DCR=CR+PR+SD。安全性主要根据患者治疗过程中出现不良事件的比例以及严重程度进行评价。治疗相关不良事件按照美国国家癌症研究所不良事件通用术语标准(NCI-CTC AE)4.0 版本进行随访统计和严重程度分级。
1.3 统计学分析
采用SPSS 22.0 软件进行统计学分析。使用Kaplan-Meier 法计算PFS 及OS,使用GraphPad Prism绘制生存曲线。定量资料以平均值(范围)或数字(百分比)形式呈现,患者基线特征的描述性变量及不良事件直接由数据库计算统计得出。
2 结果
2.1 患者一般治疗情况
本研究共纳入了32 例软组织肉瘤肺转移的患者,均在发现肺转移后予以AI 方案化疗联合安罗替尼维持治疗。治疗过程中有2 例(6.25%)患者在使用安罗替尼过程中由于不能耐受不良反应,每次口服剂量由12 mg 降至10 mg。
2.2 疗效评价
随访截至2022年4月,32 例受试患者中,22 例(68.8%)患者死亡。治疗12 周后疗效分析(表2),ORR 为34.4%,DCR 为62.5%。1 例多形性未分化肉瘤肺转移灶为寡转移,口服安罗替尼2 个月,肿瘤未见缩小,评定为SD,全身未见其他转移灶,胸腔镜下行肺转移灶切除,术后病理结果回报:左肺上叶病灶,结合病史及免疫组化符合多形性未分化肉瘤转移。该患者术后病理结果显示转移灶内仍存在肿瘤细胞,因而未达到Pcr。术后继续靶向药物治疗,目前仍处于存活状态。效果评价见表2。32 例受试患者详细治疗情况见表3。根据RECIST1.0 标准,32 例软组织肉瘤肺转移患者中,有14 例出现肿瘤退缩,平均退缩率为41.9%。不同病理类型软组织肉瘤肺转移患者治疗敏感性有所不同,但部分病理类型患者数量较少,数据可能缺乏代表性,具体详见表4。典型病例:患者4,女性,57 岁,病理类型为多形性未分化肉瘤,于2019年4月开始口服安罗替尼,当月胸部CT 检查发现右肺结节状病灶,考虑转移,病灶最大直径1.32 cm。2019年6月复查胸部CT 发现病灶明显缩小,最大直径为0.78 cm,见图1。

表2 治疗效果评估

表3 32 例软组织肉瘤肺转移患者治疗效果及生存期

表4 不同类型软组织肉瘤肺转移治疗效果

图1 多形性未分化肉瘤肺转移病灶
2.3 生存分析
所有受试患者平均随访时间为19.2(2~33)个月。使用Kaplan-Meier 法进行生存分析,统计了32 例软组织肉瘤肺转移患者,中位无进展生存期(median progression-free survival,mPFS)为6.0 个月,mOS 为15.0 个月,1 例患者通过治疗后,患者达到CR,目前仍处于生存状态,截止随访期末,患者生存时间为33 个月。生存曲线见图2,3。
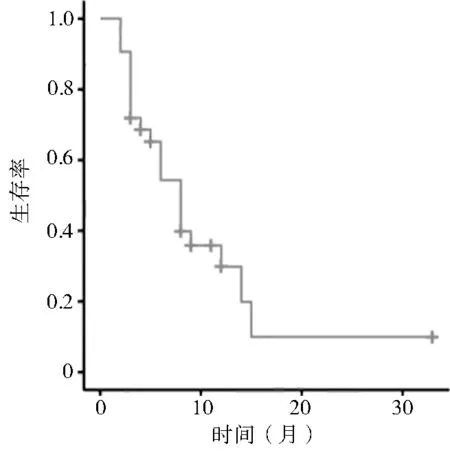
图2 32 例软组织肉瘤肺转移患者AI 方案化疗联合安罗替尼靶向治疗后无进展生存曲线

图3 32 例软组织肉瘤肺转移患者AI 方案化疗联合安罗替尼靶向治疗后总生存曲线
2.4 不良事件
治疗相关不良事件多为1~2 级,可自行或通过对症治疗缓解,常见包括高血压、手足综合征、口腔黏膜反应、乏力、食欲下降、恶心呕吐、贫血、白细胞较少、血浆白蛋白下降等。出现3 级以上不良事件,包括恶心呕吐、高血压、贫血、白细胞减少、血甘油三酯升高等,2(6.2%)例患者因不能耐受不良反应而减量,1 例(3.1%)患者因气胸死亡。具体不良事件情况见表5。

表5 治疗相关不良事件统计 例(%)
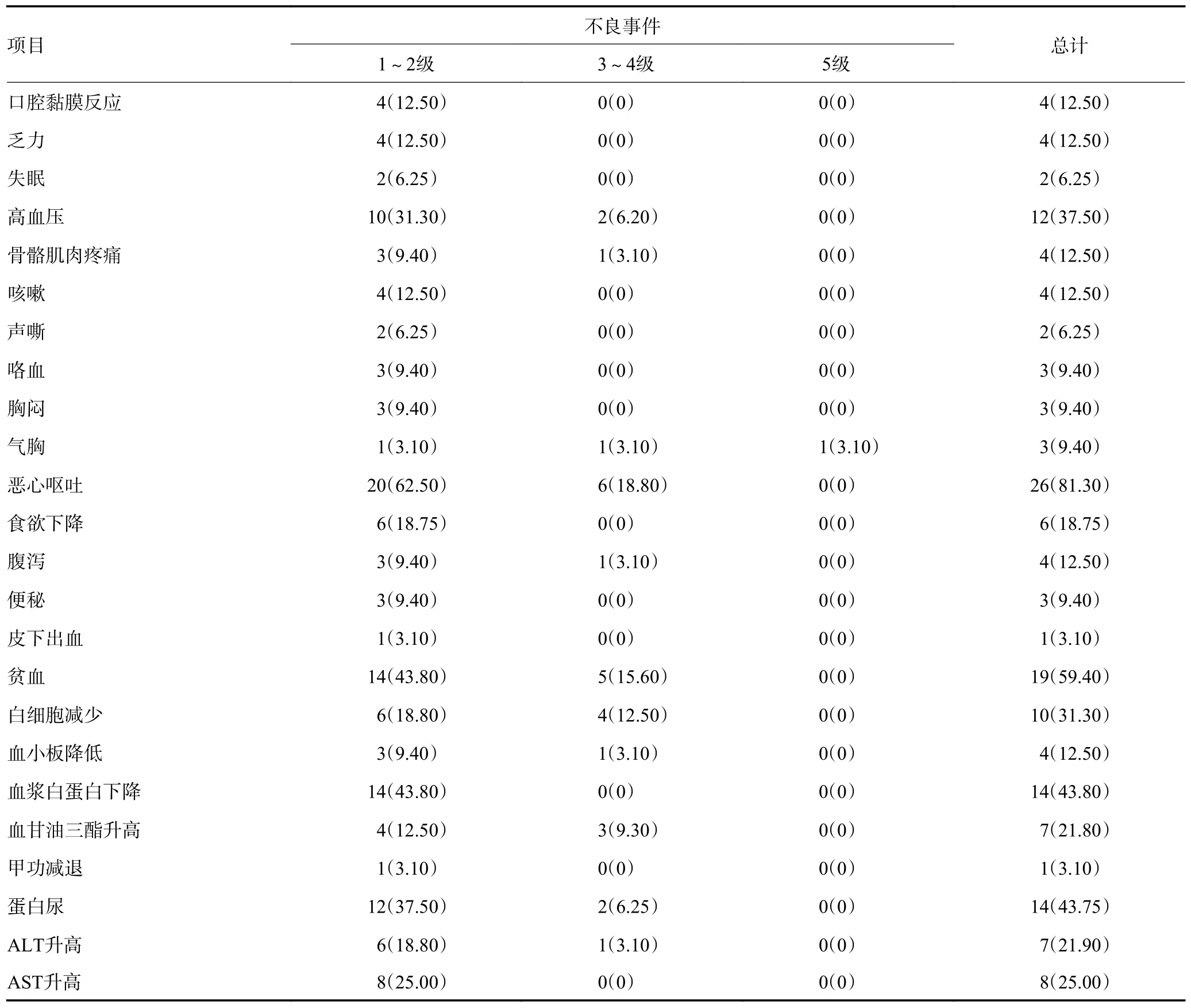
表5 治疗相关不良事件统计 (续表5)
3 讨论
软组织肉瘤是起源于间质细胞的侵袭性肿瘤,占成人恶性肿瘤1%,软组织肉瘤具有高度的侵袭性,复发率高达35%,16% 的病例在诊断时候就发现转移,最常见的转移部位为肺。然而,对于晚期或转移性软组织肉瘤患者及时接受传统化疗其中位生存时间为12~15 个月[6]。单药蒽环类化疗药物或联合异环磷酰胺是目前治疗晚期或转移性软组织肉瘤患者的一线治疗[4]。一项Ⅲ期临床试验分别应用阿霉素单药、阿霉素联合异环磷酰胺治疗晚期或者转移性肉瘤的治疗,研究结果发现阿霉素单药的mPFS 和mOS 分别为4.6 个月、12.8 个月,阿霉素和异环磷酰胺组的mPFS和mOS 分别为7.4 个月,14.3 个月,研究发现无论是否增加异环磷酰胺对OS 进行比较差异均无统计学意义(P=0.076),然而对于PFS 均有明显改善,差异具有统计学意义(P=0.003)[4]。对于软组织肉瘤的化疗预后现阶段出现瓶颈,鉴于晚期肉瘤常规化疗的局限性,迫切需要开发新的治疗手段来改善患者的预后。
近年来,靶向药物对于一些组织类型的晚期软组织肉瘤取得了较好的治疗效果,包括小分子酪氨酸激酶抑制剂、单克隆抗体、周期蛋白依赖性激酶4/6 抑制剂、mTOR 抑制剂等等。安罗替尼是一种新型酪氨酸激酶抑制剂,能够靶向作用肿瘤抑制肿瘤增殖、血管系统和肿瘤微环境等,安罗替尼可以通过VEGFR-2、VEGFR-3 和FGFR-1、FGFR-2、FGFR-3、FGFR-4 抑制VEGF/VEGFR 信号通路的传导,安罗替尼还抑制PDGFRα/β、c-Kit、Ret、Aurora-B、c-FMS 和DDR1的活性,从而显著抑制肿瘤细胞的增殖。在基础研究阶段,安罗替尼对多种异种肿瘤模型显示出广泛的抗肿瘤活性[7]。Chi 等[7]的多中心Ⅱ期临床试验(NCT018-78448),应用安罗替尼单药治疗蒽环类药物一线治疗失败的晚期软组织肉瘤患者,共纳入166 例患者,研究发现12 周的PFR 为68%,ORR 为13%。mPFS和OS 分别为5.6 个月和12 个月。2019年中国临床肿瘤学会(CSCO) 指南推荐安罗替尼为晚期、不可切除的软组织肉瘤的二线治疗。单纯应用安罗替尼存在耐药性的问题,靶向药物和化疗药物联合应用有可能提高肉瘤患者的PFS、OS 等,进一步改善晚期软组织肉瘤患者预后。
有研究表明肉瘤的进展与肿瘤血管生成和多种信号通路介导有关,抗血管生成药物与细胞毒性化疗相结合可能是克服化疗耐药性和抑制肿瘤生长的有效途径[8]。临床前研究证明使用抗血管生成药物可以促进肿瘤血管正常化,从而改善包括软组织肉瘤在内的许多实体瘤的药物递送和疗效。在过去的10年中,大量的临床研究表明,对于晚期非小细胞肺癌、结肠癌、卵巢癌和肾癌,贝伐单抗联合化疗显著延长了PFS 和OS[9]。Verschragen 等[10]报道了一项ⅠB 期临床试验,共纳入36 例晚期/转移性软组织肉瘤,给予贝伐单抗联合多西他赛和吉西他滨治疗,ORR 为31%,包括CR 5 例、PR 6 例和SD18 例,取得了较好的治疗效果。García 等[11]报道了一项Ⅱ期临床试验,对35 例晚期软组织肉瘤患者给予索拉非尼联合异环磷酰胺治疗,研究结果显示3 个月和6 个月的PFR 分别为66% 和37%,mPFS 为4.8 个月,OS 为16.2 个月,研究认为索拉非尼联合异环磷酰胺治疗对蒽环类药物耐药的晚期软组织肉瘤患者具有一定的临床疗效,且患者能够耐受不良反应。在本研究中共计纳入32例晚期软组织肉瘤患者,经CT 评估肺部有可进行评估的转移灶,除了肺转移外,还有6 例发生了骨转移,3 例淋巴结转移,1 例肝转移,1 例肾上腺转移,经过4~6 周期的AI 方案化疗,并给予安罗替尼维持治疗,第12 周进行评估,CR 为1 例(3.1%),PR 为10 例(31.2%),SD 为9 例(28.1%),PD 为12 例(37.5%),ORR 为34.3%,DCR 为62.5%,经疗效评估发现,总体有效率略高于既往研究[7]。mPFS 为6.0 个月,mOS为15.0 个月。与既往研究比较PFS,OS 也略高于既往研究[7]。但是本研究样本量小,且属于回顾性分析,存在偏倚较大,需要大样本的随机对照试验进一步论证。
不同病理类型的软组织肉瘤肺转移对于AI 方案联合安罗替尼维持治疗的敏感性有所不同,我们发现多形性未分化肉瘤患者效果较好,受试患者中有1 例达到CR,OS 达到33 个月。DCR 达到77.7%,平均生存时间为21.4 个月,mPFS 为13 个月,在Liu 等[12]等一项回顾性研究中,1 例多形性未分化肉瘤患者在接受了3 个周期的AIM 方案化疗联合5 个周期安罗替尼维持治疗后病情由PR 改善为CR。其推测在敏感病理类型的软组织肉瘤中安罗替尼的抗肿瘤活性可能叠加了化疗的延迟作用进而延长了无进展生存时间。Wang[13]一项回顾性研究中观察了32 例晚期或转移性软组织肉瘤患者应用化疗联合安罗替尼靶向治疗的治疗效果,其中6 例患者为多形性未分化肉瘤,1 例患者获得CR,2 例患者获得PR,1 例患者为SD,疾病控制率也达到了66.7%,表明不论是AI 方案还是其他化疗方案联合安罗替尼维持性治疗对于多形性未分化肉瘤均有较好的治疗效果,此外横纹肌肉瘤DCR 也达到了66.7%,但病例数较少(n=3)。其余病理类型患者数量少,数据可能缺乏代表性,需要更大样本的研究以进一步区别该疗法对不同病理类型软组织肉瘤肺转移患者的治疗效果。
安罗替尼在Ⅰ~Ⅲ期临床试验中,推荐使用12 mg(连续2 周每日1 次,然后休息1 周)的剂量。最常见的不良事件发生率超过30%,包括包括高血压(34%)、蛋白尿(67%)、手足皮肤反应(53%)、甲状腺功能减退(57%)、丙氨酸氨基转移酶升高(48%)、天冬氨酸转氨酶升高(43%)等[14]。本研究中患者使用安罗替尼相关不良事件具体见表5。安罗替尼治疗期间,最常见的具有临床意义的3 级或以上不良事件为高血压(4.8%)、甘油三酯升高(3.6%)和气胸(2.4%)[7]。本研究中对患者出现的不良反应均予以对症治疗,对于高血压的患者及时予以口服降压药物;所有的患者化疗后常规给予长效升白针治疗,因而白细胞减少发生率较低;在治疗期间给予保肝药物治疗,转氨酶增高的比例得到了有效控制。其余1~2 级不良反应,不论是血液学或非血液学毒性都是患者可以耐受的,不良事件的发生率与相关文献报道相似,本研究中所有的病例均进行了化疗,尽管给予5-HT3 受体拮抗药,但仍有81.25%的患者发生恶心、呕吐症状,此外本组患者中贫血及低蛋白血症患者较多,可能与化疗期间恶性、呕吐,进食差,导致营养状态较差有关联。
值得关注的是本研究中气胸的发生率为9.4%,要显著高于国内的相关研究。Chi 等[7]的多中心Ⅱ期临床试验(NCT01878448)报道安罗替尼应用于不可切除软组织肉瘤患者气胸发生率为2.4%,首先考虑这与本研究样本量较少有关。其次本研究所纳入的研究对象均为肺转移患者,容易出现肺组织破坏或胸膜侵犯,这也增加了气胸发生的几率。另外我们发现,出现气胸的患者均为50 岁以上男性,均有长期吸烟史,可能存在不同程度的化学性肺脏损伤。据相关文献记载,吸烟可以使女性出现自发性气胸的风险增加9 倍,男性增加22 倍[15],因而在临床工作中应予以注意劝导患者戒烟少量的气胸可以自行吸收,气胸严重时需要住院治疗,本研究中有1 例患者最终死于气胸。其他的罕见不良时间如过敏、皮下出血、甲状腺功能减退,给予对症处理后得到有效缓解。靶向治疗与AI 方案化疗相结合治疗晚期软组织肉瘤是安全可靠的,绝大多数患者是可以耐受的。
综上所述,AI 方案联合安罗替尼是治疗软组织肉瘤肺转移的有效治疗手段,但是本研究为单中心的、小样本量的回顾性分析,针对软组织肉瘤亚型种类多、发病率低、肿瘤异质性高等特点,需要大样本的、多中心的随机对照临床研究对不同种亚型的肉瘤分别进行研究,以进一步论证该治疗手段的有效性及安全性。
